365例电子输注泵不良事件报告分析
2020-06-09马丹华聂生东卞蓉蓉李尧
马丹华,聂生东,卞蓉蓉,李尧
1. 上海理工大学 医疗器械与食品学院,上海 200093;2. 江苏省药品不良反应监测中心,江苏 南京 210002
引言
电子输注泵预期用途为静脉或硬膜外给药的镇痛给药,将液体和药物精准、恒量、恒速、持续的泵入人体内,是目前临床上最常用的术后镇痛方法。它具有解除和缓解患者疼痛和不适感、有利于术后恢复、减少术后创面渗血、感染,保证患者术后充分休息等多种优点[1]。电子输注泵广泛应用于临床,有效缓解了疼痛给病人带来的巨大痛苦,提高了患者生活质量。但是随着用量的不断增多,使用过程中出现的不良事件也随之增加,产品安全性风险仍需注意。
本论文对2016年1月1日至2018年8月31日江苏省在国家药品不良反应监测系统收集到的电子输注泵医疗器械不良事件进行回顾性分析,了解电子输注泵不良事件的发生特点,探讨电子输注泵在使用过程中存在的风险点,为促进临床安全合理用械提供参考。
1 资料与方法
对2016年1月1日至2018年8月31日江苏省在国家药品不良反应监测系统收集到的电子输注泵医疗器械不良事件进行统计分析,筛选产品名称为“输注泵”“镇痛泵”“电子输注泵”的报告402例,剔除退回的、重复的、非电子输注泵报告37例,纳入统计分析的报告365例。通过采用回顾性分析方法,对365例电子输注泵医疗器械不良事件报告表中的报告来源、性别与年龄分布、预期治疗疾病与作用、不良事件情况等字段利用Microsoft Excel进行统计分析。
2 结果
2.1 报告来源
365例电子输注泵医疗器械不良事件报告表中,346例报告来源于医疗机构,19例报告来自于生产、经营企业(表1)。
2.2 性别与年龄分布
365例电子输注泵医疗器械不良事件报告表中,男性100例,女性239例,26例性别不详,男女比例为1:2.39,女性数量明显多于男性。年龄最小的1岁,最大的88岁,年龄在21~30岁的占比最高,为28.49%,详见表2。
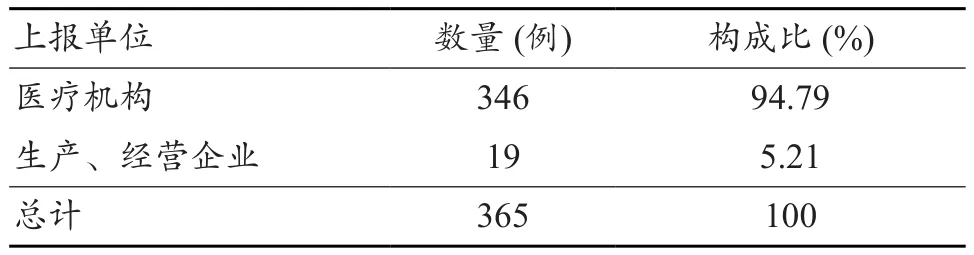
表1 报告来源情况
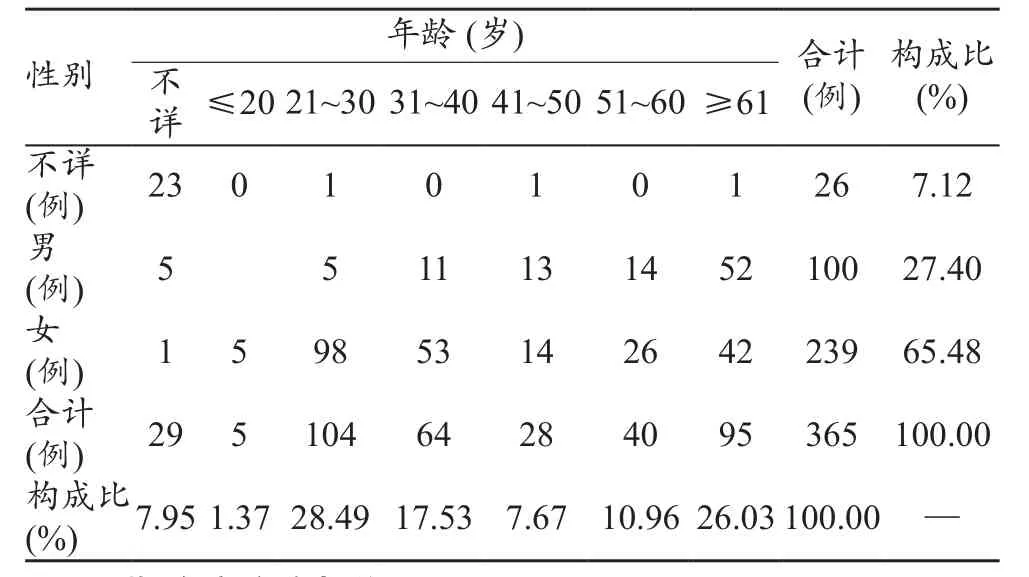
表2 性别与年龄分布
2.3 预期治疗疾病与作用
365例电子输注泵医疗器械不良事件报告表的报告中预期治疗疾病与作用主要包括术后镇痛、无痛分娩、化疗等,其中术后镇痛最为常见,289例,占79.18%,详见表3。
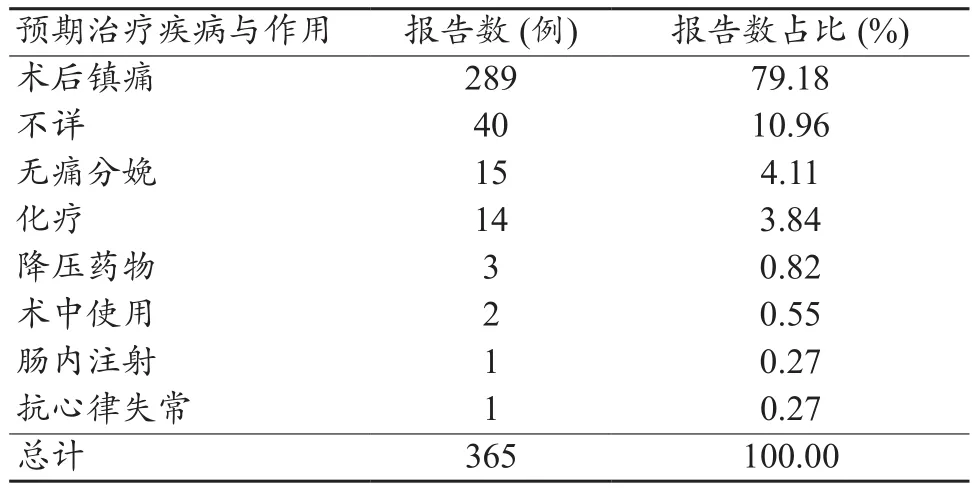
表3 预期治疗与作用报告表情况统计
2.4 不良事件情况统计
根据事件发生初步原因分析统计不良事件情况,主要表现为部件故障、输注速率不准、软件问题、药品不良反应、报警问题、电池问题等,其中部件故障235例,占64.38%,详见表4。

表4 不良事件主要表现
2.5 涉及生产企业情况
365例电子输注泵医疗器械不良事件报告表涉及生产企业42家,其中江苏企业27家,浙江生产企业4家,国外生产企业4家,具体报告数量,见表5,报告数量排名前五家生产企业不良事件统计,见表6。

表5 排名前五位的生产企业报告数量
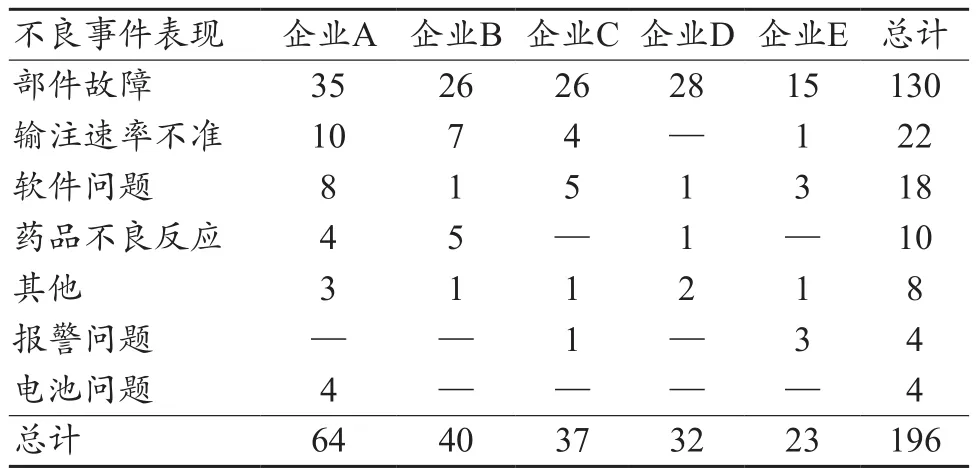
表6 报告数量排名前五的生产企业不良事件表现(例)
3 讨论
3.1 报告来源
365例电子输注泵医疗器械不良事件报告表的报告来源中346例来自医疗机构,这与电子输注泵本身的产品特点和使用范围有关,电子输注泵主要应用于术后的镇痛,患者在医院实施手术后使用本产品,能够有效缓解疼痛,医疗机构医护人员能够专业操作该医疗器械,患者使用过程中一旦出现问题,也便于及时处理和解决。19例来自生产、经营企业,来源于生产和经营企业的报告主要依靠销售人员收集医疗机构的反馈信息。由于收集渠道单一且往往不能及时有效的获得不良事件信息,生产经营企业主动上报的不良事件报告数量占比明显偏少[2]。
3.2 性别与年龄
365例报告中,在年龄段的分布上,21~30岁的年龄段较其他各年龄段相比,占比最大,为28.49%;其次为61岁以上人群,占比为26.03%。性别、年龄的分布与电子输注泵的使用人群有密切的关系。21~30岁的年龄段中女性98例,占该年龄段比为94.23%,处于21~30岁年龄段的女性正处于生育年龄高峰,结合不良事件报告的过程描述以及临床实际使用情况[3-6],该产品广泛应用于剖腹产的术后镇痛。对于61岁以上人群,体质较弱,易患各种疾病,术后镇痛、化疗应用该产品情况较多,收集到的不良事件报告较多。
3.3 预期治疗疾病与作用
365例报告中,预期治疗疾病与作用中术后镇痛占比较大,占79.18%,其次为不详(报告表填写为不详)、无痛分娩、化疗等。术后使用电子输注泵,可以极大缓解病人术后的疼痛,提高舒适度。同时临床上越来越多的病人通过使用电子输注泵进行化疗,该治疗方法无论在治疗疗效、减少病人痛苦、减少住院时间、费用、降低不良反应发生率、提高患者生活质量等方面均优于传统的静脉输注治疗方法,特别适用于半衰期较短的化疗药物,通过持续不断的输入化疗药物,维持体内血药浓度稳定,保证了治疗效果,电子输注泵值得在化疗过程中进一步推广和使用[7-13]。
3.4 不良事件表现
365例报告的不良事件表现主要包括医疗器械产品本身的问题导致的不良事件以及使用的药品产生的不良事件。产品本身的问题主要表现以部件故障为主,具体表现为电子输注泵接渗漏、气泡感应器故障、控制面板松动、储液部件损坏、部件断裂、部件发热发烫等;输注速率不准具体表现为输液速度与设定值不符、未按设定时间完成输入、流速不均匀等;软件问题具体表现为屏幕闪烁无法正常显示、黑屏、屏幕无反应等;其他问题主要是非医疗器械或药物引起的事项,主要包括药液出现浑浊、有杂质等;报警问题主要表现为报警失灵,如连续报警、异常报警等;药品不良反应是指患者使用镇痛药物后出现的不良反应,如患者出现恶心、呕吐、头晕、呼吸困难等;电池问题主要是电池接触不良、显示屏不亮等。以上不良事件经及时处理后均好转或缓解,未造成严重后果。对于常见的电子输注泵故障,医护人员应具体问题具体分析,可根据设备出现的报警提示[14],参考说明书进行故障排除。
3.5 涉及生产企业情况
365例电子输注泵医疗器械不良事件报告表涉及生产企业42家,江苏企业27家,占64.29%。以“输注泵”查询国家药品监督管理局医疗器械产品注册情况,共查到9个省份76家生产企业210个“一次性使用输注泵”或“电子输注泵”的相关批准文号,其中包括江苏35家生产企业(46.05%)的100个批准文号(47.6%),由于江苏省该产品的生产企业在全国占了一半左右,因此该产品的不良事件在国家药品不良反应监测系统的数据库中,江苏企业占比较高。
通过对不同生产企业的不良事件表现统计,各企业不良事件出现次数最多的均为部件故障,其次为输注速率不准。值得关注的是5家企业中有1家出现了4例有关电池问题的报告,提示该企业的电池问题可能存在风险因素,应引起企业关注。企业应及时开展相关调查,对出现的问题深入开展研究,分析原因,采取风险控制措施,保证患者安全使用。
4 建议
4.1 强化上市许可持有人主体责任意识,主动上报不良事件
国家药品监督管理局《关于药品上市许可持有人直接报告不良反应事宜的公告(2018年第66号)》[15]和 《医疗器械不良事件监测和再评价管理办法》[16](国家市场监督管理总局令第1号,下简称《办法》)已于2019年1月1日正式实施,在企业主体责任落实方面提出了新要求,明确了医疗器械不良事件监测与再评价工作办法,规定了上市许可持有人应当向医疗器械不良事件监测技术机构直接报告医疗器械不良事件。《办法》第三条明确规定:“医疗器械上市许可持有人(以下简称持有人),应当具有保证医疗器械安全有效的质量管理能力和相应责任能力,建立医疗器械不良事件监测体系,向医疗器械不良事件监测技术机构(以下简称监测机构)直接报告医疗器械不良事件。”
根据目前的不良事件报告统计,生产、经营企业普遍存在上报意识不强、报告较少的问题。生产经营企业可尝试通过多种行之有效的办法收集不良反应报告:一是积极与医疗机构进行沟通,第一时间获取不良事件信息;二是可以通过定期查找检索国内外文献资料获取该类产品的安全性信息;三是可以通过电话、网络等多种平台收集患者不良事件信息很多上市许可持有人尚未对医疗器械不良事件监测产生足够的重视,企业内部的不良反应监测体系尚不完善,程序制度缺位,未配备专人负责不良反应监测工作。随着新办法及配套指导原则的陆续颁布实施,上市许可持有人必须主动开展医疗器械不良事件监测和再评价工作,建立和完善企业内部监测管理体系,制定医疗器械不良事件监测系列制度文件和程序。拓宽企业收集不良事件的渠道,积极主动地在系统中提交更多的医疗器械不良事件报告。
4.2 加强临床使用环节的控制,防范不良事件的发生
针对21~30岁及61岁以上不良事件报告发生较多的人群,在临床实际使用过程中医护人员应予以密切关注,及早发现,及时处理。剖腹产术后的女性,产后虚弱,身体劳累,患者往往不能及时发现设备出现的异常情况,61岁以上的老年人群身体抵抗力差,且可能身体同时存在疾病,需要予以格外关注,因此医护人员应密切关注上述人群使用过程中存在的风险。对于所有使用电子输注泵的患者,在设备使用前医护人员应当告知患者基本操作规则、使用注意事项等信息,并实时监测设备使用过程中的情况。当患者发现电子输注泵输注异常或产生报警后,应当立即联系医护人员进行处置。医护人员应当熟悉电子输注泵的产品特性,熟练应对常见设备故障,及时排除风险,防止严重不良事件的发生,保障患者用械安全。上市许可持有人也应加强对医疗机构使用操作的医护人员的培训,特别是对产品可能发生的不良事件以及应对处理措施予以重点说明。接收到临床反馈的不良事件时,上市许可持有人应积极配合医院,认真分析事件原因,提供解决问题的方案。
4.3 不良事件相关处置措施探讨
(1)医疗机构。使用电子输注泵发生不良事件后,医护人员应及时赶到现场,根据设备报警提示,找出故障原因进行处理。如故障不能排除,应更换使用新的设备,确保患者安全使用产品。同时将该不良事件上报至国家医疗器械不良事件监测信息系统,便于上市许可持有人及时掌握不良事件信息。
(2)上市许可持有人。上市许可持有人接收到临床反馈的不良事件后,应按照《办法》第二十一条的要求,“持有人应当对收集和获知的医疗器械不良事件监测信息进行分析、评价,主动开展医疗器械安全性研究。”针对使用单位经常出现的不良事件进行数据汇总,深入分析原因,通过不断更新产品说明书,持续改进产品生产工艺等多种风险控制措施,提高产品安全性。生产企业是产品质量第一责任人,需建立涵盖产品研发、生产、销售、配送、使用全生命周期的质量控制体系,执行生产经营各项法律法规和技术规范,切实履行企业主体责任。
(3)药品不良反应监测机构。药品不良反应监测机构应加强对医疗器械不良反应监测信息系统收集报告的数据分析利用。通过对系统收集的报告进行定期统计分析,梳理汇总不良事件主要表现,探索挖掘风险信号,为监管部门提供技术支撑。同时,督促指导辖区内生产企业开展不良事件监测,提高企业对监测数据的分析与利用能力,对严重不良事件开展调查处置工作,指导企业开展上市后的重点监测等工作。2019年1月1日国家医疗器械不良事件监测系统改版上线,对生产企业提出了更高的要求,要求生产企业对收到的每1份不良事件报告进行核实评价,并及时在系统内填写不良事件的处理意见。如何科学评价并正确处理每份不良事件,对于生产企业是一个巨大的挑战。针对该问题,各级监测机构可根据系统内生产企业提交的报告,分析填写过程中可能存在的问题,在辖区内有针对性的尝试开展生产企业审核评价报告的相关内容培训,指导生产企业高质量完成报告的填写,提升生产企业监测水平。
(4)监管机构。监管机构要督促医疗器械上市许可持有人切实履行不良事件监测责任,全面加强医疗器械不良事件监测的监督检查。根据《医疗器械不良事件监测和再评价管理办法》第六十七条规定的情形开展重点检查,发现违法违规行为的,要及时采取控制措施并严肃查处。以查促建、以查促管,强化上市许可持有人开展不良事件监测和再评价工作的责任意识,指导企业提高开展不良事件监测和再评价的工作水平,确保医疗器械上市许可持有人落实主体责任。
