普通大气热氧化处理后镍钛诺合金的生物安全性评价
2020-06-09林钟石黄虹蓉臧德跃徐炜区林柏佑袁丽欣徐良刘尧
林钟石,黄虹蓉,臧德跃,徐炜区,林柏佑,袁丽欣,徐良,刘尧
深圳市药品检验研究院 a. 体外诊断试剂检测部;b. 无源医疗器械检测部;c. 医疗器械检测中心,广东 深圳 518057
引言
镍钛诺合金因拥有良好的抗腐蚀能力、形状记忆能力和超弹性[1]等特点被作为医用材料,主要用于制造可植入器械、临床检测、手术器械[2]以及部分牙科类器械[3]。但关于其生物安全性存在一些不确定因素,镍钛诺合金中镍离子的释放会引起血栓[4]、炎症反应和毒性效应[5]。为了减少镍钛诺合金的毒性,国内外学者尝试采用多种方法抑制镍离子的释放,主要分为表面氧化法[6-8]和表面涂层法[9-12]。其中,表面氧化法是最为经济简单的方法,因为镍钛诺合金材料在加工过程中伴随高温,会形成一层氧化膜。但有研究者认为,在普通大气下的热氧化法获得的氧化层均匀度较差,且与基体的结合力不强;在体内腐蚀条件下,循环负载可能导致氧化膜破坏[13-14]。但表面涂层法往往耗时较长,且过程复杂,大部分还仅停留在实验室研究阶段,而且各项改进后的镍钛诺合金材料都缺乏相应的系统性生物安全性评价。为了验证普通大气下热氧化处理后的镍钛诺合金材料作为医疗器械的生物安全性,本研究中将镍钛诺合金材料进行塑形处理为镍钛合金丝,然后基于一系列GB/T 16886医疗器械生物学评价标准评估该镍钛合金丝的生物安全性,包括细胞毒性试验、热原试验、皮内反应试验、迟发型超敏反应试验、溶血试验、血栓形成试验、急性全身毒性试验、亚慢性全身毒性试验、肌肉植入试验、遗传毒性试验等,从医疗器械监管的角度为表面氧化法处理后的镍钛诺合金材料在医疗器械的制造和应用提供系统的安全性依据。
1 材料和方法
1.1 材料和仪器
1.1.1 试验动物和材料
白化豚鼠(广州花东信华实验动物养殖农场);NIH小鼠、新西兰兔(广东省医学实验动物中心);比格犬(广东前沿生物科技有限公司);SD大鼠(北京维通利华实验动物技术有限公司)。镍钛诺合金材料(苏州天鸿盛捷医疗器械有限公司)。L929细胞、L5178Y TK+/-小鼠淋巴瘤细胞、中国仓鼠肺细胞(中国科学院典型培养物保藏委员会细胞库);鼠伤寒沙门氏组氨酸缺陷型TA97、TA98、TA100、TA102和TA1535菌株(美国Moltox公司)。
1.1.2 镍钛合金丝的制备
将镍钛诺合金材料(含有大约53%~57%的镍和不超过1%的碳钴铜等杂质,余量为钛)经过大约500℃的高温熔化塑形成丝,然后放入无菌蒸馏水中淬灭成型,最后放入无菌容器中保存备用。
1.1.3 仪器
CO2培养箱(Mermert GmbH,德国);倒置显微镜、正置显微镜(Leica Microsystems,德国);酶标仪、生物组织脱水机、石蜡组织包埋机、自动组织切片机、自动组织烤片机、自动组织摊片机(Thermo Fisher Scientific,美国);自动生化分析仪(Beckman Coulter,美国);自动血细胞分析仪(Sysmex,日本);染色、封片和烤片一体机(Roche,美国);展片机(Microm GmbH,德国);扫描电子显微镜(JEOL,日本)。
1.1.4 试验材料浸提液制备
分别用非极性浸提介质(棉籽油、含血清培养基、二甲基亚砜)和极性浸提介质(生理盐水、不含血清的培养基)按照6 cm2/mL的比例对镍钛合金丝进行浸提。镍钛合金丝全部没入浸提介质中,置于有盖的离心管中,37℃振荡浸提72 h。
1.2 方法
1.2.1 细胞毒性试验
将生长良好的L929细胞消化,配制成1×105个/mL浓度细胞悬浮液加入96孔板中。温育24 h使细胞形成半汇合状态后,弃去孔中的培养液,每孔加入100 μL的样品浸提液(浸提介质:含血清MEM培养基)、阴性对照、阳性对照(二甲基亚砜)和空白,继续培养24 h。受试24 h后,在显微镜下检查细胞形态,记录下样品组细胞形态的改变。平板检查完后,移除原培养液。每孔加入50 µL的MTT(噻唑兰)溶液,并在37℃下孵育2 h,然后弃去。每孔再加入100 μL异丙醇,振荡混匀后,在570 nm波长(参比波长650 nm)下测量吸光度,并计算细胞的存活率[15]。
1.2.2 热原试验
3只新西兰兔,试验前测量体温作为对照体温。在测量后30 min内,以10 mL/kg的剂量从耳缘静脉注射生理盐水浸提液。在注射后1~3 h内每30 min测量一次体温,进行总共6次测量。体温的最高值减去正常值,便是体温升高值[16]。
1.2.3 迟发型超敏反应试验
50只豚鼠,随机分成极性浸提液(浸提介质:生理盐水)组、极性对照组、非极性浸提液(浸提介质:棉籽油)组、非极性对照组和阳性对照(2,4-二硝基氯苯)组共5组。通过动物肩胛骨的内侧皮内注射0.1 mL进行皮内诱导。注射液分别为:溶液A(浸提介质与弗氏完全佐剂等体积混合的稳定性乳化剂)、溶液B(受试溶液)、溶液C(溶液A和溶液B等体积混合后的稳定性乳化剂)。
皮内诱导6天后,将10%十二烷基硫酸钠导入测试部位。24 h后,将吸收试验溶液的介质贴敷于诱导注射点以进行局部诱导,并在诱导48 h后去除。在局部诱导结束后13天,将吸收了试验溶液的介质贴敷于诱导期的未测试部分(每只动物的上腹部),并于24 h后去除。贴敷结束后24 h和48 h对对照组和试验组激发部位的皮肤进行观察,参照Magnusson和Kligman分级标准评价超敏反应结果[17]。
1.2.4 皮内反应试验
3只新西兰兔,将0.2 mL极性浸提液(浸提介质:生理盐水)、非极性浸提液(浸提介质:棉籽油)皮内注射入每只兔子脊柱两侧的各5个部位,对照(浸提介质)注射入另一侧对应的各5个部位。在注射后24、48和72 h时观察并记录每个皮内注射部位的情况,根据标准GB/T 16886.10中皮内反应评分标准进行反应评分,并记录试验结果[17]。
1.2.5 溶血试验
从新西兰兔心脏收集8 mL血液制备成新鲜抗凝兔血,并用10 mL生理盐水稀释。样品组取样品加入10 mL生理盐水,阴性对照只加入10 mL 生理盐水,阳性对照只加入10 mL蒸馏水。将所有试管置于37℃水浴中孵育30 min,每支试管加入0.2 mL稀释兔血,于37℃继续保温60 min后800 g离心5 min,取上清液在545 nm波长下测量吸光度,并计算溶血率[18]。
1.2.6 血栓形成试验
3只实验用犬麻醉,左侧分离出颈静脉,右侧分离出颈动脉,向心端接入血液回路装置,将样品和对照品(已通过血栓试验检测,批准上市的相似器械材料)置于回路装置两侧固定,保持血液畅通,观察动物在试验期间的临床状态。3 h后,安乐处死实验用犬,取下血液回路装置,观察样品和对照品导致血栓形成情况并记分。将样品和对照品用生理盐水漂洗后,戊二醛固定,乙醇系列脱水,真空干燥后喷金,在扫描电镜下进行观察[18]。
1.2.7 急性全身毒性试验
小鼠20只,随机分成样品组和对照组,每组5只。尾静脉注射极性浸提液(浸提介质:生理盐水),腹腔注射非极性浸提液(浸提介质:棉籽油),对照小鼠注射相同量的浸提介质。注射后立即观察小鼠,并在4、24、48和72 h观察小鼠,观察试验组和对照组的一般状态、毒性和死亡动物数,并在72 h观察后记录动物体重[16]。
1.2.8 肌肉植入试验
新西兰兔16只(每个观察期4只),沿脊柱两侧肌肉间隔植入6个样品。植入后密切观察创口愈合、摄料、饮水、行为活动等情况。植入1、4、12和26周后,目视检查植入部位的组织反应和植入物周围囊肿的形成。取出植入部位的肌肉,10%的甲醛溶液固定,石蜡包埋,常规制片,苏木素伊红染色,显微镜下进行组织病理学观察[19]。
1.2.9 亚慢性全身毒性试验
大鼠40只,随机分成样品组和对照组,每组20只,雌雄各半。样品组按照10 mL/kg BW的剂量经大鼠尾静脉注射样品浸提液,对照组注射生理盐水,每天1次,连续给予28天。试验期间,在给药前后观察大鼠是否存在中毒症状。给药前后及每周称重1次,并计算食物摄入量。最后一次给药后,禁食至少12 h,然后麻醉,动脉采血进行血液学检查和临床生化检查并对大鼠进行大体检查。解剖取出肾上腺、脑等器官,并尽快称重计算器官系数[16]。
四是“好教育进行时”促进了好校长、好教师的成长。好教育需要好教师,没有好的校长、教师队伍,不可能有好教育,不注重校长、教师队伍建设,不关注校长、教师专业化成长需求,就不可能有持续健康的教育发展态势。好教育一定会带来教育界“群星璀璨”“争奇斗艳”“繁花似锦”的美好景象。
1.2.10 遗传毒性试验
根据标准GB/T 16886.3推荐,采用细菌基因回复突变试验和使用小鼠淋巴瘤细胞进行的体外哺乳动物细胞基因突变试验组合进行遗传毒性试验[20]。
(1)细菌基金回复突变实验。将鼠伤寒沙门氏组氨酸缺陷型菌株在37℃下振荡培养以获得约109个/mL的菌液。将0.1 mL菌液和0.1 mL受试液加入到顶层培养基中。另外,活化组加入0.5 mL 10% S9混合液,无活化组加入0.5 mL 0.2 moL/L磷酸盐缓冲液。设置2,4,7-三硝基-9-芴酮(TA97 a、TA98,无活化组)、叠氮化钠(TA100、TA1535,无活化组)、丝裂霉素C(TA102,无活化组)、2-氨基芴(TA97 a、TA98、TA100、TA1535,活化组),1,8-二羟基吲哚(TA102,活化组)为阳性对照,设置浸提介质生理盐水和二甲基亚砜作为阴性对照。混合后将每管溶液倾倒在底层培养基上。将平皿置于37℃培养约48 h后,对菌落计数并以平均数和标准差来表示。
(2)使用小鼠淋巴瘤细胞进行的体外哺乳动物细胞基因突变试验。取自发突变消除后生长良好的L5178Y TK+/-细胞,将细胞浓度调整为1×106个/ mL。将10 mL细胞悬液与9 mL受试液混合。另外,向各组中的活化组中加入1 mL 10% S9混合物,并向未活化组中加入1 mL 150 mmoL/L氯化钾溶液。将4-硝基喹啉氧化物(无活化组)和环磷酰胺(活化组)设置为阳性对照。将极性浸提介质(无血清培养基)和非极性浸提介质(含血清培养基)设置为阴性对照。将上述各种混合液分别培养4 h和24 h。接触结束后,取部分细胞制作PE0(第0天平板效率)平板,剩余细胞调整浓度后继续培养表达24 h然后制备PE2 (第2天平板效率)板和TFT(三氟胸苷)拮抗平板。所有96孔板培养12天后,计算PE0、PE2、T-MF(TFT抗性突变的总频率)和S-MF(TFT抗性突变小集落频率)。
2 结果
2.1 细胞毒性试验
按照GB/T 16886.5的方法,镍钛合金样品浸提液接触后的显微镜下观察细胞形态正常与空白对照无差别(图1),且相对细胞活性大于70%(图2),无潜在的细胞毒性。

图1 镍钛合金丝细胞毒性试验显微镜观察结果
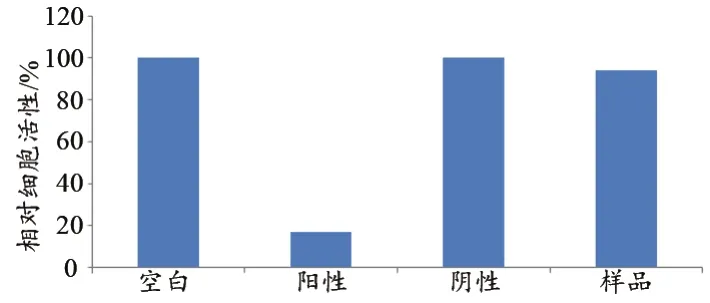
图2 镍钛合金丝细胞毒性试验MTT检测结果
2.2 热源试验
按照GB/T 16886.11的方法,镍钛合金样品浸提液注射后的新西兰兔肛温升高均不超过0.5℃,符合《中国药典》的规定,样品材料没有致热性因子。
2.3 迟发型超敏反应试验
2.4 皮内反应试验
按照GB/T 16886.10的方法,样品组和对照组动物在观察期内的反应均为无红斑、无水肿,样品组和对照组的总平均评分之间的差异为0,未观察到异常的皮内反应(图4)。
2.5 溶血试验
按照GB/T 16886.4的方法,样品组的溶血率为1%,低于5%,与医疗器械材料溶血率的要求一致。
2.6 血栓形成试验
按照GB/T 16886.4的方法,电子显微镜下观察样品的血栓大小,分布和组成与对照品无显著性差异(图5)。
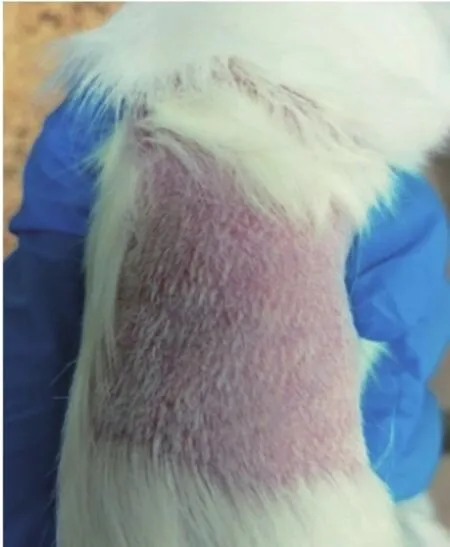
图3 镍钛合金丝迟发型超敏反应试验结果

图4 镍钛合金丝皮内反应72 h试验结果
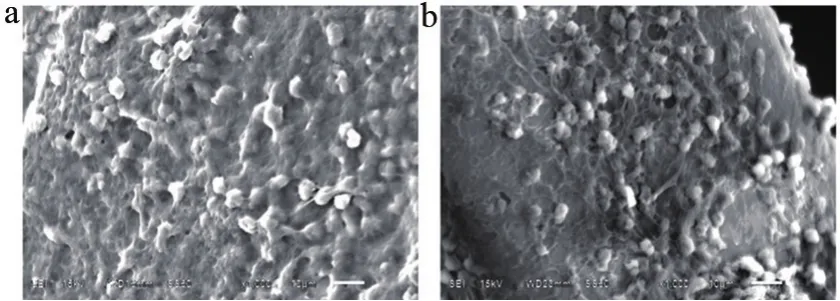
图5 镍钛合金丝血栓形成试验电子显微镜观察结果
2.7 急性全身毒性试验
按照GB/T 16886.11的方法,在72 h观察期内,样品组和阴性对照组的动物没有死亡和毒性反应,体重均有增长,样品组和对照组之间无差异显著性(图6)。
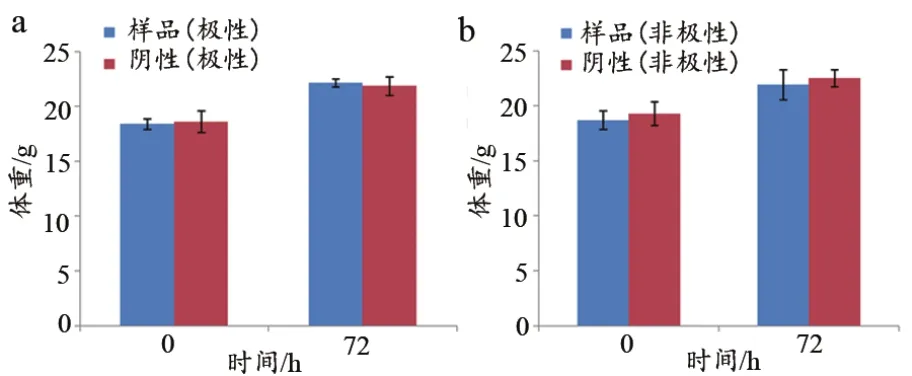
图6 镍钛合金丝急性全身毒性检测结果
2.8 肌肉植入试验
观察期内,植入部位创口皮肤愈合良好,植入部位肌肉未见明显感染、变色、坏死,无明显包囊形成。植入26周后,显微镜下观察镍钛合金样品周围可见薄层的纤维组织形成,局部偶见毛细血管形成,可见极轻度淋巴细胞浸润,中度-重度脂肪浸润,与对照品无显著性差异(图7)。

图7 镍钛合金丝肌肉植入试验显微镜观察结果
2.9 亚慢性全身毒性试验
连续给药的28天内,样品组动物状态良好,活动正常,口鼻未见异常分泌物,排尿和排便没有异常,没有观察到毒性反应和死亡,与对照组相比没有差异显著性。样品组和对照组之间的体重(图8)和动物饲料消耗(图9)没有差异显著性。动物血液学指标、动物血清生化学指标、各器官重量及器官系数均正常。

图9 镍钛合金丝亚慢性全身毒性试验中动物饲料消耗量变化
2.10 遗传毒性试验
(1)细菌基因回复突变试验。与阴性对照相比,样品组的回变菌落数未增加一倍或者一倍以上。镍钛合金丝细菌回复突变试验结果为阴性(表1)。
(2) 体外哺乳动物细胞基因突变试验。与阴性对照相比,样品组的MF值均未出现超过126×10-6的增长。镍钛合金丝体外哺乳动物细胞基因突变试验结果为阴性(表2)。
3 讨论
张媛媛等[21]将镍钛诺合金的植入体植入豚鼠的听泡,分别于7、14、28、56、112天进行观察,植入体周围新生组织生长正常,无异常组织出现,但新生的组织中含有痕量的镍。Olson等[22]将镍钛诺合金的眼内夹固定于猪的虹膜上,采用聚丙烯作为对照,手术后8周和10周分别进行全视野视网膜电图扫描和组织学分析。结果发现两者在角膜厚度、内皮细胞数量、镜面显微镜参数、视网膜细胞数量和电视曲线图参数均无明显差异。冯翠娟等[23-24]将镍钛诺合金浸提液与L929细胞接触,发现浸提液会引起L929细胞的Bax及Bcl-2 mRNA表达改变、细胞凋亡率的增加以及总RNA浓度的降低。Yang等[25]将镍钛诺合金与内皮细胞接触,发现裸露的镍钛诺合金对内皮细胞的生长没有任何影响,但从裸露的镍钛诺合金中释放的镍离子会影响细胞肌动蛋白骨架、黏着斑、能量代谢、炎症反应和蛋白代谢途径。Válková等[26]发现在与镍钛诺合金接触后,有着骨关节炎症的人骨细胞中的IL-1β因子、IL-8因子、MMP-1因子有显著性增加。此外,许多的国内外的研究也从不同的角度对镍钛诺合金的安全性进行了验证,但其数据基于的材料不尽相同,缺乏系统性的研究,并不能进行准确比较,甚至存在着相互矛盾的结论。

表1 镍钛合金丝细菌回复突变试验结果
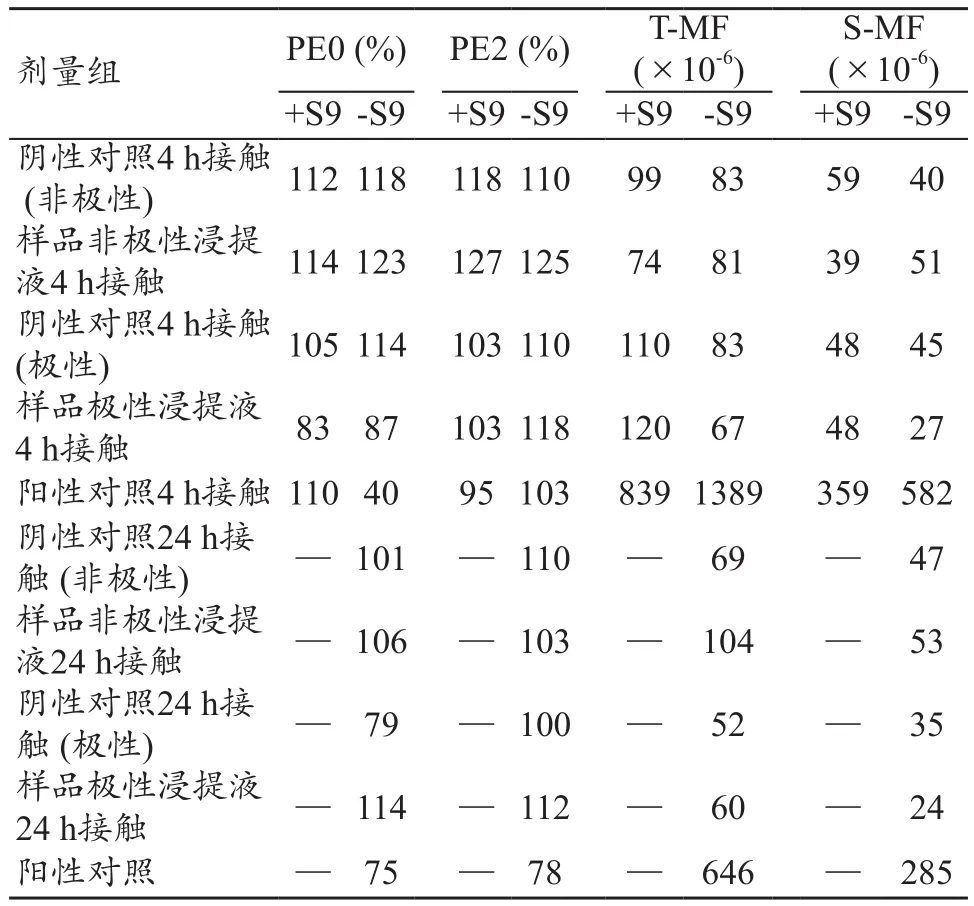
表2 镍钛合金丝用小鼠淋巴瘤细胞进行的体外哺乳动物细胞基因突变试验试验结果
生物学评价系列标准GB/T 16886是由全国医疗器械生物学评价标准化技术委员会对国际系列标准ISO 10993的等同转换,旨在为医疗器械的风险管理提供纲领和框架。其中,GB/T 16886.1《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》作为纲领性的文件,为医疗器械的生物安全性评价提供了一个框架,其附录A为常规医疗器械生物学评价所需的生物学评价项目提供了全面的指导。常规的医疗器械如若要完成生物学评价,其生物学评价的数据组要能够覆盖附录A表格中所要求的相应生物学评价项目。但根据医用材料的不同用途,应采取不同的生物学评价项目。镍钛诺合金材料可以被用于与人体短暂接触的表面器械,也可用于与人体长期接触的植入介入器械,其中与血液长期接触的植入介入器械所需的生物学评价项目最为严格也最为全面,涵盖现有GB/T 16886.1《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》附录A中推荐的所有的生物学评价项目。因此本研究选取了与血液长期接触的植入介入器械完成生物学评价所需的项目,包括细胞毒性试验、热原试验、皮内反应试验、迟发型超敏反应试验、溶血试验、血栓形成试验、急性全身毒性试验、亚慢性全身毒性试验、肌肉植入试验、遗传毒性试验对镍钛诺合金材料加工成的镍钛合金丝进行了生物安全性研究。
综上所述,根据GB/T 16886.1中的要求,镍钛诺合金材料在普通大气下热氧化处理后加工成的镍钛合金丝的生物学评价项目均符合GB系列标准的要求,能够完全覆盖完成常规医疗器械生物学评价的所需的所有数据终点,因此符合现有标准规范对于常规医疗器械生物安全性的要求。但在生物化学和分子生物学层面,标准法规和本研究都未涉及,这应该是未来需要探究和发展的方向。
