D6-CRP型与XN-9000型血细胞分析仪比对的结果分析*
2020-06-08吴志成赖小婷冯景虹
陈 娟 吴志成* 赖小婷 冯景虹
随着医学检验的发展,全自动血细胞分析仪得以广泛应用,各种血细胞分析仪的检测技术不断升级,而同一实验室采用不同厂家、不同检测原理的血细胞分析仪是检验科发展的必然趋势。由于不同血细胞分析仪的检测原理、使用试剂、校准品、质控品以及所处的环境温度和湿度不同,同一份标本检测结果间存在差异,导致无法满足实验室室间质量评价的要求。因此,为确保检测结果的准确性和一致性,满足室间质量评价的要求,做好实验室内不同仪器间检测结果的比对显得尤为重要[1-4]。本试验结合临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)发布的《用患者样本进行方法比对及偏差评估-批准指南》(EP9-A2)[5]文件和原国家卫生部发布的《临床血液学检验常规项目分析质量要求》(WS/T406-2012),以北京大学深圳医院检验科参加卫生部临床中心室间质评的XN-9000型血细胞分析仪为对照仪器,对D6-CRP型血细胞分析仪进行结果比对分析,并判断其结果间的临床可接受性[6]。
1 材料与方法
1.1 检测材料
使用乙二胺四乙酸二钾(ethylenediaminetetraacetic acid-K2,EDTA-K2)抗凝真空采血管,采集北京大学深圳医院2019年1-5月临床患者新鲜全血标本2 ml,按照原国家卫生部发布的《临床血液学检验常规项目分析质量要求》(WS/T406-2012)实验室结果可比性验证对样本浓度的要求,收集40份EDTA-K2抗凝新鲜全血样本,剔除由于检测原理限制导致结果不可靠的样本,如溶血、乳糜、小红细胞以及有核红细胞等,所有标本从采集到检测完成时间均在2 h内[7]。
1.2 仪器与试剂
使用D6-CRP型全自动血细胞分析仪(深圳市帝迈生物技术有限公司)、校准品(帝迈PLUS0319)、质控品(帝迈DH1901)及其配套试剂;XN-9000型血细胞分析仪(日本Sysmex公司)、校准品、质控品及其原装配套试剂。
1.3 检测方法
(1)比对项目。白细胞(white blood cell,WBC)计数、红细胞(red blood cell,RBC)计数、血红蛋白(haemoglobin,HGB)、血细胞比容(hematocrit,HCT)和血小板计数(platelet,PLT)。
(2)仪器与试剂。根据CLSI EP9-A2文件[8]选取XN-9000型血细胞分析仪为对照仪器及其配套试剂,定期用原装配套校准物进行校准;每个工作日用配套低、中、高3个浓度的全血质控物进行室内质量控制;定期参加卫生部和本省临检中心的室间质量评价。
(3)试验条件。根据原国家卫生部发布的《血细胞分析的校准指南》(WS/T347-2011)[9]要求,仪器在第一次使用前需对其进行校准,后期至少每半年进行一次校准,使用期间按使用说明书定期维护和保养[10-12]。比对期间对仪器开机后的空白允许值进行确认,并完成高、中、低3个水平浓度质控品的监控,确保结果均在控。
(4)试验方法。在仪器状态良好情况下,每日选取8份样本,同时用各仪器按常规样本检测方法测定各项参数,每份样本测2次,其测定顺序为1~8和8~1。连续测定5 d,共40份样本记录测定结果,取2次测定的平均值做比对分析,其取值范围为:WBC(1.18~55.97)×109/L,RBC(2.69~6.46)×1012/L,HGB(77~183)g/L,HCT(23.8~53.0)%,PLT(36~715)×109[13]。
1.4 判断标准
(1)日间精密度应符合《临床血液学检验常规项目分析质量要求》(WS/T406-2012)[6]表5的要求。
(2)实验室结果可比性每个检测项目的相对偏差应符合《临床血液学检验常规项目分析质量要求》(WS/T406-2012)[6]表8要求的比例应≥80%。
(3)线性回归计算斜率a、截距b及线性回归方程Y=ax+b。
(4)方法间相对偏差根据实验室使用要求,将各检测项目给定的医学决定水平(Xc)代入回归方程,计算Y与X之间预期偏倚Bc,Bc=|Y-Xc|,相对偏差(Bc%)=(Bc/Xc)×100%。以美国临床实验室改进法案修正法案(CLIA'88)规定的允许总误差(TEa)的1/2作为评价标准,两台仪器WBC、RBC、HGB、HCT和PLT比对的可以接受范围依次为±7.5%、±3.0%、±3.5%、±3.0%和±12.5%。
(5)方法间绝对偏差按该文件所给的公式计算Bc的95%置信区间(confidence interval,95%CI),即在Xc处的绝对偏差,Ea=1/2TEa,绝对允许误差TEa=TEa%×Xc,以1/2CLIA’88绝对允许总误差TEa作为判断标准。
(6)临床可接受性判断Bc%≤1/2TEa%,表明待评方法的检测结果与对照方法一致,相反则不具可比性[14]。1/2TEa在95%CI内,表明待评方法的偏差可接受,Ea>Bc的95%CI上限,表明预期偏差很可能(>97.5%)<Ea,表明待评方法的性能等同于对照方法;Ea<Bc的95%CI下限,表明预期偏差很可能(>97.5%)>Ea,表明待评方法的性能和对照方法不等同。
1.5 统计学方法
检测所得数据均使用Microsoft Excel 2010软件进行统计学分析,计算偏倚、制作散点图以及线性回归分析。
2 结果
2.1 日间精密度
检测低、中、高3个水平浓度质控品,均符合WS/T 406-2012的要求[6]。D6-CRP型血细胞分析仪各检测项目的日间精密度结果见表1。
2.2 实验室结果可比性
根据WS/T406-2012表8要求,分别计算不同浓度的相对偏差,WBC、RBC、HGB、HCT及PLT的5个检测项目的相对偏差符合要求比例均≥80.0%,且均符合WS/T 406-2012的要求,D6-CRP型血细胞分析仪各检测项目的相对偏差符合率结果见表2。
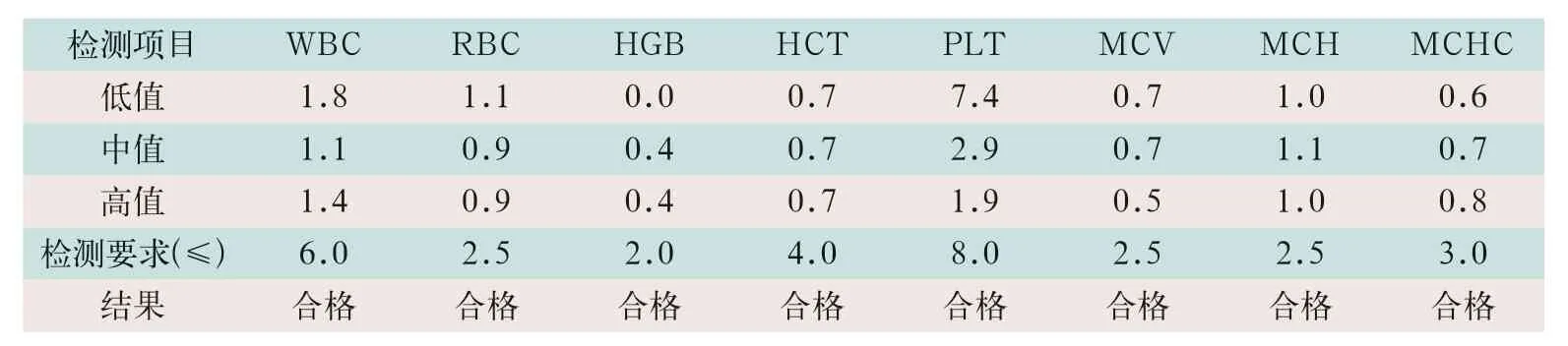
表1 D6-CRP型血细胞分析仪各检测项目的日间精密度(%)

表2 D6-CRP型血细胞分析仪各检测项目的相对偏差符合率
2.3 相关性
以XN-9000型血细胞分析仪为对照仪器,D6-CRP型血细胞分析仪与其进行线性关系和回归分析结果显示,2台仪器各检测项目间的相关系数均>0.975,符合EP9-A2的要求,其结果见表3。

表3 D6-CRP型血细胞分析仪各检测项目相关系数及直线回归方程
2.4 临床可接受判断
根据临床可接受性判断[14]标准,对其临床可接受性能进行评价,对检测项目相对偏差Bc%>1/2TEa,分析预期偏倚Bc的95%CI。其结果见表4和表5。

表4 D6-CRP型血细胞分析仪各检测项目临床可接受性能评价

表5 D6-CRP型血细胞分析仪检测项目临床可接受性能评价
3 讨论
血常规是临床上常见的检测项目,无论是健康体检、急诊检测或生病入院均离不开血常规检测。由于样本量大、采血方式和科室区分等限制,导致仅靠1台血细胞分析仪满足不了临床使用需求,目前较多实验室均配有多台相同或不同厂家的血细胞分析仪,不同的血细胞分析仪之间的检测原理、试剂、质控品及校准品等的不同,可能导致仪器间的检测结果存在较大的偏差。本实验比对的2台血液分析仪为不同公司的仪器,使用不同的室内质控品,因此选择EP9-A2指南进行了仪器间WBC,RBC,HGB,HCT和PLT的5个检测结果进行比对。研究结果表明,2台仪器间结果有良好的相关性,相关系数均>0.975;在各个医学决定水平处,其中PLT为50×109/L的相对偏差Bc%>1/2TEa,但其Ea均落在95%CI内,表明是由抽样误差所造成,其待评方法的偏差可接受,其余项目的相对偏差Bc%均≤1/2TEa。因此,XN-9000与D6-CRP仪器之间具有可比性,为临床所接受。
4 结论
为保证实验室内结果统一以及不同实验室结果的统一,除完善室内、室间质量检测体系,还需根据现有参考文件建立合理的比对程序制度,定期开展仪器间的比对工作,保证检测结果准确性,也给室内、室间质量控制得到良好补充[15]。医疗机构临床实验室管理办法明确规定同一检验项目在不同仪器或系统上测定时,每年至少要比对一次,既是重要的质量控制方法,也是同一份新鲜全血在同一实验室不同仪器间传递的可溯源性,从而使各检测系统之间具有一致性,才能给患者提供一份安全的保障和责任感,方可满足临床所需[16-17]。
