钆塞酸二钠增强磁共振和弥散加权成像诊断肝细胞癌TACE术后存活或复发病灶的价值
2020-06-08刘海峰许永生刘钊卢星如雷军强
刘海峰,许永生,刘钊,卢星如,雷军强
兰州大学第一医院放射科,甘肃兰州730000
前言
经导管肝动脉化疗栓塞术(Transcatheter Arterial Chemoembolization,TACE)被2018年TACE临床实践指南[1]推荐为肝细胞癌(Hepatocellular Carcinoma,HCC)的一线治疗方案,并且作为无法进行手术切除的HCC患者治疗的首选方案,但由于HCC由肝动脉及门静脉双重血供、侧支循环形成等因素导致HCC难以完全坏死,存在复发率高的不足[2]。因此,本研究探讨钆塞酸二钠(Gd-EOB-DTPA)增强磁共振成像(MRI)和弥散加权成像(Diffusion Weighted Imaging,DWI)在TACE术后HCC病灶存活或复发病灶的诊断价值,为临床精准诊断、治疗效果评价提供影像学依据。
1 材料与方法
1.1 临床资料
本研究经兰州大学第一医院伦理委员会审核批准通过。前瞻性连续纳入2016年9月~2018年12月在兰州大学第一医院住院并接受TACE 治疗的HCC患者。所有患者均在接受Gd-EOB-DTPA 增强MRI检查和DWI检查前签署知情同意书。
按照纳入标准初步纳入在兰州大学第一医院行TACE的HCC患者119例,其中23例患者因以下原因满足排除标准而未纳入研究:6 例患者因严重呼吸运动伪影导致MRI平扫或增强图像质量较差,4例患者TACE 术后肝内和肺内出现广泛转移、预计生存期短于3 个月,10 例患者接受CT、超声增强和/或PET/CT等检查,3 例患者术后随访缺乏诊断的金标准(DSA、手术病理及临床随访结果),故最终纳入96 例TACE术后的HCC 患者的129 个病灶,具体资料如表1所示。
1.2 纳入与排除标准
1.2.1 纳入标准(1)诊断符合2017年中国原发性肝癌诊疗规范指南[3]的HCC患者;(2)患者在兰州大学第一医院首次进行TACE,年龄大于18岁;(3)肝脏功能Child-Pugh 分级为A 或B 级;(4)患者美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分[4]≤2分;(5)患者TACE术后1~2个月接受Gd-EOBDTPA 增强MRI和DWI检查。
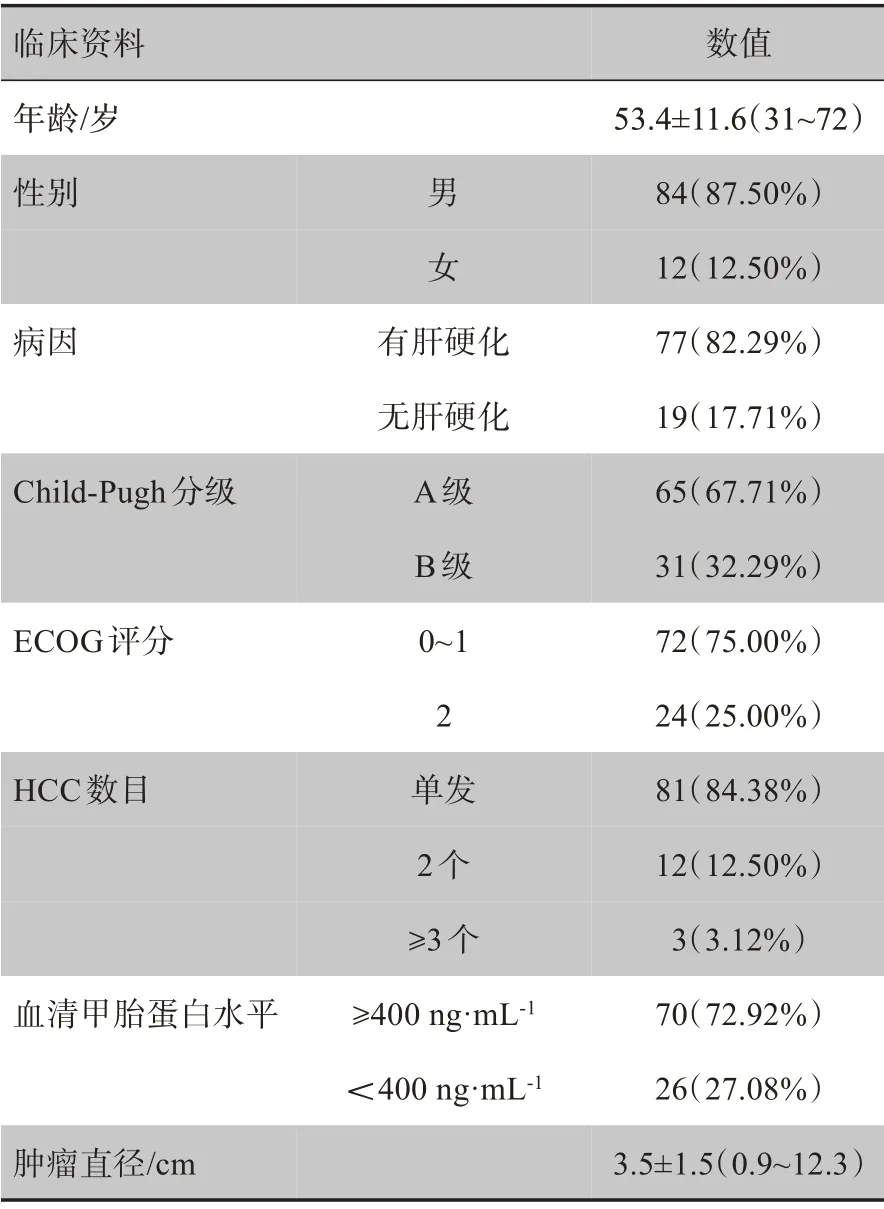
表1 纳入患者临床基线资料Tab.1 Clinical baseline data of enrolled patients
1.2.2 排除标准(1)不适宜接受TACE 的患者,包括:门静脉主干完全被癌栓阻塞或肝内存在明显的动静脉瘘,肝肾功能严重障碍,无法纠正的止凝血功能障碍,严重感染和/或活动性肝炎;(2)肝内胆管细胞癌、肝转移瘤等肝内非HCC 恶性肿瘤;(3)存在碘对比剂严重过敏、MRI检查禁忌症的患者;(4)HCC弥漫或广泛远处转移,预估生存期不大于3个月;(5)患者中途退出、随访资料不全;(6)因运动及呼吸伪影导致图像质量较差的患者。
1.3 TACE治疗方案
患者仰卧位于腹股沟及会阴部常规消毒、铺巾及1%利多卡因局部浸润麻醉后,采用Seldinger 技术经皮穿刺股动脉(穿刺点常规选择腹股沟韧带下方1.0~1.5 cm 股动脉搏动明显处),置入5F 导管鞘,在Artis Zee DSA 设备监视下插入导管置于腹腔动脉干、肝总或肝固有动脉造影,必要时行肠系膜上、右隔下及右肾上腺动脉造影,经高压注射器注入10~25 mL非离子型碘对比剂,注射速率为3~5 mL/s,DSA 采集图像速率为3帧/s,采集包括肝血管动脉期、实质期及静脉期图像,以了解HCC病灶数目及大小、肿瘤供血动脉走行及有无明显动静脉畸形等。选择插管(部分以微导管)至HCC 供血动脉并灌注HCC 化疗药物:奥沙利铂80~100 mg、5-氟尿嘧啶1 g,后将导管超选择性插管至肝固有动脉,透视下缓慢注入碘化油与多柔比星的乳化液行栓塞术,最后以聚乙烯醇(PVA)行补充栓塞,PVA 具体用量视HCC 直径及供血情况而定。
1.4 MRI成像扫描方案
患者在TACE 术后1~2 个月在Simens Magnetom Skyra 3.0T 磁共振成像仪及标准体部相控阵32 通道线圈一次性完成腹部MRI平扫、钆塞酸二钠(商品名普美显,德国Bayer-Schering 公司)增强MRI和DWI。患者在接受MRI检查前空腹6~8 h,取仰卧位、头先进体位并于检查前进行呼吸训练,扫描范围自膈顶至肝脏下缘。首先行MRI腹部常规序列,其具体参数:(1)T1WI:TR 220 ms,TE 1.2 ms(反相位2.5 ms),FOV(320 mm×320 mm)~(380 mm×380 mm),层厚5 mm,层间隔2 mm,激励次数(NEX)2,重建同反相位、水相和脂肪相图像;(2)T2WI采用脂肪抑制技术:
TR/TE 3 000 ms/90 ms,FOV(320 mm×320 mm)~(380 mm×380 mm),层厚5 mm,层间隔2 mm,NEX 2;(3)在3 个分别为50、400、800 s/mm2的扩散敏感梯度系数(b值)的基础上完成DWI:TR/TE 5 900 ms/83 ms,层厚5 mm,层间隔2 mm,NEX 1,FOV(320 mm×320 mm)~(380 mm×380 mm);(4)Gd-EOB-DTPA 多期动态增强MRI利用高压注射器经患者肘静脉以剂量(0.1 mL/kg)及1 mL/s 注射造影剂普美显,然后仍以1 mL/s 速度注射20 mL 生理盐水冲洗导管以确保造影剂完全进入体内。在注射对比剂15、60、120 s后依次分别进行肝动脉期、门脉期、平衡期扫描,于注射对比剂20 min后行肝特异期扫描。
1.5 TACE术后HCC存活及复发的诊断标准
1.5.1 金标准参考国家卫计委2018年公布的原发性肝癌诊疗指南[3],以影像学随访半年以上、手术病理结果作为诊断HCC在TACE术后是否为存活或复发、坏死病灶的金标准。(1)CT和/或MRI随访结果:CT和MRI增强扫描提示病灶增大,病灶增强扫描动脉期强化;(2)手术病理:病理结果符合HCC诊断。存活病灶:TACE术后病灶CT和MRI增强扫描结果提示病灶增大,病灶可见动脉期强化;复发病灶:肝内出现新发病灶,影像学检查提示病灶动脉期强化或随访病灶明显增大;完全坏死病灶:TACE术后病灶整体影像学检查未见增大、增强扫描均未见强化。
1.5.2 Gd-EOB-DTPA 增强MRI诊断标准由两名影像学高级职称医师采用双盲法分析TACE 术后HCC病灶的影像学表现:(1)以肝实质作为背景界定病灶信号高低,病灶整体信号较周围肝实质高则定义为高信号,信号等于或低于肝实质为等或低信号;(2)特异期病灶呈明显低信号则定义为无造影剂摄取。以增强扫描动脉期强化、特异期未见造影剂摄取呈低信号作为存活或复发的Gd-EOB-DTPA 增强MRI及诊断标准。
1.5.3 DWI和ADC 值诊断标准DWI信号高于周围肝实质为高信号,等于或低于周围肝实质为低信号。通过Siemens 后处理工作站在表观扩散系数(Apparent Diffusion Coefficient,ADC)图上选取病灶的最大层面,手工选择感兴趣区(Region of Interest,ROI),为避免因ROI面积不同造成的测量误差,ROI面积尽量为150~200 mm2以保持等大等圆,同时避开肉眼可见的肝内血管、胆管、肝脏边缘2 cm 内的肝组织及伪影等,在存活或复发、坏死病灶区域选择合适ROI连续3 个层面测量3 次ADC 值,取其平均值后确定最终ADC值。
1.6 统计学方法
应用SPSS 23.0 软件进行统计学分析,计量资料用均数±标准差表示,计数资料则用百分率(%)表示。以金标准结果作为对照,分析Gd-EOB-DTPA 增强MRI及DWI诊断TACE术后HCC存活或复发病灶的敏感度、特异度。采用受试者工作特性曲线下面积(AUC)方法评价ADC 值对诊断存活及复发的价值。采用卡方检验探究影像学征象对TACE 术后HCC 存活及复发的诊断及鉴别诊断价值。P<0.05 为差异有统计学意义。
2 结果
2.1 Gd-EOB-DTPA 增强MRI与金标准结果一致性分析
金标准证实TACE 术后存活病灶29 个、肝内复发病灶18 个(41 个经CT 和/或MRI随访证实,6 个经手术病理证实),坏死病灶82 个。Gd-EOB-DTPA 增强MRI共检出诊断存活或复发病灶44 个,坏死病灶79 个,漏诊、误诊病灶存活或复发的数目均为3 个,见表2。
2.2 DWI诊断TACE 术后HCC 病灶存活及复发的价值
DWI诊断TACE 术后HCC 存活或复发的敏感度和特异度如表2所示。存活或复发病灶的ADC 值为(1.12±0.23)×10-3mm2/s,明显低于坏死病灶的ADC值(1.83±0.26)×10-3mm2/s,且差异具有明显统计学意义(U=-15.29,P<0.05)。ROC 曲线图(图1)分析结果提示当ADC 值为1.49×10-3mm2/s,ADC值对诊断HCC病灶TACE术后存活或复发具有最高的诊断效能,此时敏感度和特异度分别为86.6%、100.0%,约登指数是0.87,AUC为0.977±0.010。
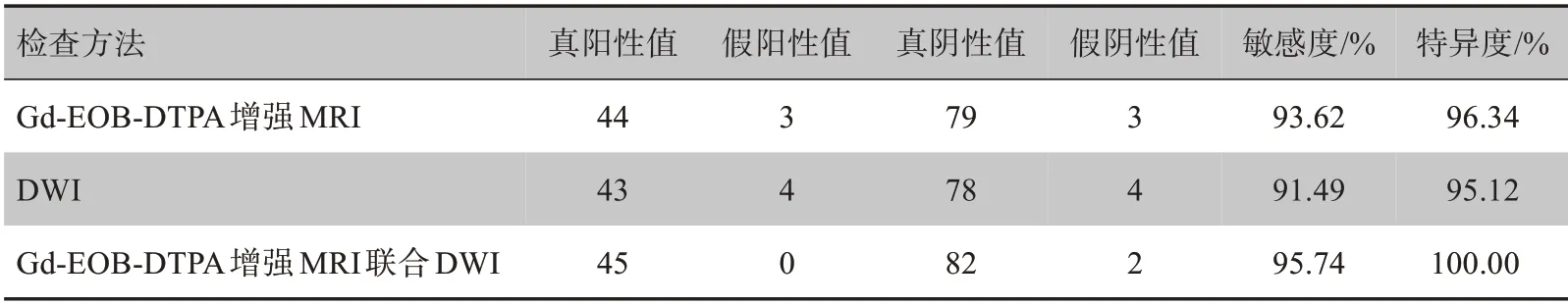
表2 Gd-EOB-DTPA 增强MRI和DWI诊断TACE术后存活及复发结果Tab.2 Results of Gd-EOB-DTPA enhanced MRI and DWI in diagnosing residual or recurrent lesions after TACE
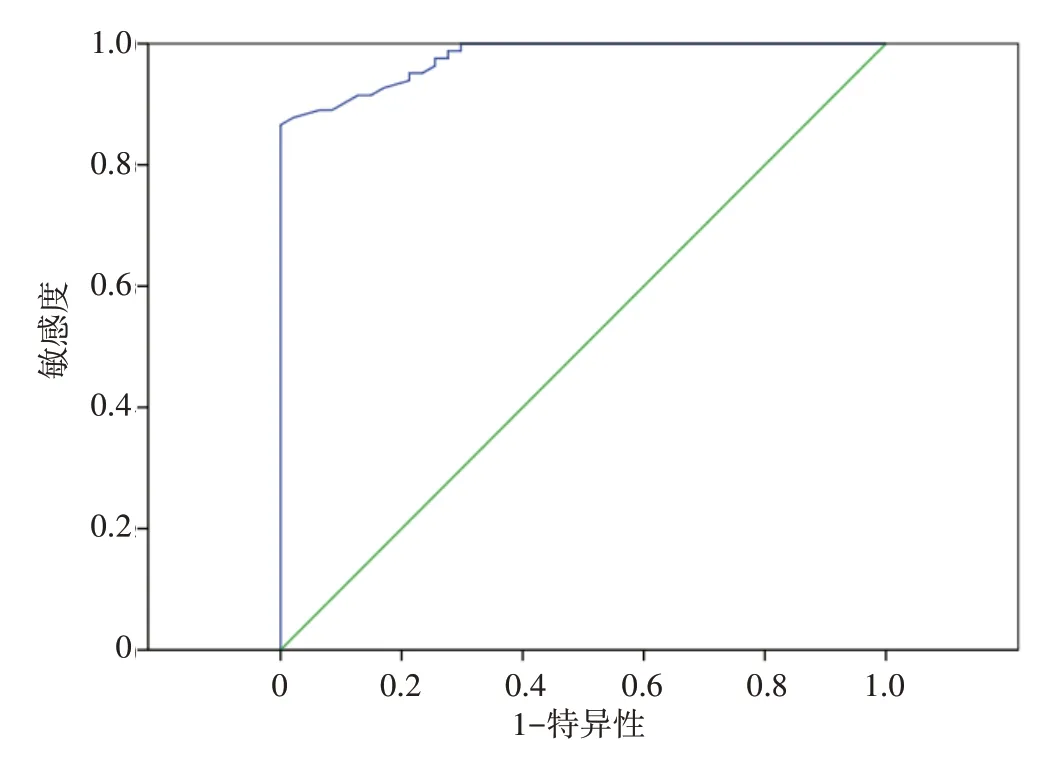
图1 ADC值鉴别诊断TACE术后存活或复发的ROC曲线Fig.1 ROC curves of ADC in the differential diagnosis of residual or recurrent lesions after TACE
2.3 Gd-EOB-DTPA 增强MRI影像学表现
TACE 术后HCC 存活或复发病灶多呈现出T1WI低信号、T2WI高信号、DWI信号弥散受限呈高信号的信号表现,增强扫描89.36%(42/47)表现为动脉期强化,肝胆期(特异期)91.49%(43/47)未见造影剂摄取故呈低信号,而坏死病灶动脉期不强化、特异期造影剂不摄取,见图2~图3。
2.4 影像学征象判断存活或转移的独立因素分析
从影像学征象角度探究其判断TACE 术后HCC存活或复发、坏死病灶的价值,结果提示病灶边缘有无包膜、DWI信号高低、动脉期增强表现的影像学征象是诊断及鉴别诊断存活或复发、坏死的重要独立影响因素(P<0.05),见表3。
3 讨论
MRI为多序列参数成像,能依靠MRI征象分析病理改变[5-6]。TACE 术后造成HCC 凝固性坏死同时常合并液化、出血、炎性细胞浸润和囊变等,凝固性坏死T1WI和T2WI均为低信号,液化、囊变T1WI呈低信号而T2WI为高信号,出血可因不同时间而信号混杂,因此TACE 术后病灶常表现出混杂T1WI和T2WI信号的特点,因此从单纯T1WI与T2WI信号难以有效鉴别TACE 术后存活或复发[7-8],本研究结果与上述理论相符。由于碘化油和化疗药物栓塞HCC 供血血管导致肿瘤坏死,但随后的修复过程在病灶边缘形成防御性和限制性的纤维肉芽组织假包膜,能抑制肿瘤生长、限制肿瘤侵袭及阻断肿瘤侧支循环形成,所以肿瘤包膜是否形成有助于判断TACE 术后疗效及患者预后[9]。包膜在T1WI和T2WI表现为肿瘤边缘低信号,本研究表明TACE 术后坏死、存活或复发病灶的包膜显示率分别为75.60%、4.26%,且差异具有统计学意义,提示包膜有助于鉴别诊断TACE 术后坏死病灶。
Gd-EOB-DTPA 增强MRI不仅可依靠三期动态增强(动脉期、门脉期及延迟期)的强化表现分析病灶血供情况,还能根据特异期有无造影剂摄取诊断TACE 术后病灶性质。研究结果显示Gd-EOB-DTPA增强MRI诊断TACE 术后存活或复发病灶的敏感度和特异度分别为93.62%和96.34%,提示Gd-EOBDTPA 增强MRI具有较高的诊断效能。但存活或复发灶表现出动脉期强化特点的仅为74.46%(35/47),这主要与TACE 术后存活病灶血供不丰富、侧枝循环和动静脉瘘形成、化疗导致血管炎及血管闭塞密切相关[10-12]。虽然绝大多数(43/47)存活或复发病灶在特异期未见造影剂摄取呈低信号,但特异期是否造影剂摄取较动脉期强化无法有效鉴别诊断TACE 术后存活或复发、坏死,这主要与存活或复发、坏死病灶造成正常肝细胞消失从而反映出低信号有关[13]。

图2 患者女,64岁,肝S5见大小3.1 cm×2.7 cm的团片状短T1信号影(图2A,白色箭头),边缘见低信号包膜,DWI低信号(图2B),增强扫描未见明显强化(图2C),肝特异期未见明显造影剂摄取呈低信号(图2D)。图2E(CT平扫)、图2F(CT动脉期):半年后CT随访结果提示TACE术后病灶碘油沉积良好,未见病灶明显增大及动脉期强化Fig.2 Images of a 64-year-old female patient.MR showed a 3.1 cm×2.7 cm well-defined lesion with hypointense capsule(Fig.2 A,white arrow)in the S5 of liver,hyperintense on T1WI and hypointense on DWI(Fig.2 B),no obvious enhancement in the enhanced scan(Fig.2 C),and no hypointense of contrast agent uptake in liver-specific phase(Fig.2 D).Fig.2 E(CT plain scan)and Fig.2 F(CT arterial phase)showed that CT scan obtained at her 6-month follow-up displayed iodine oil well-deposited in lesions after TACE,and no obvious enlargement or arterial enhancement was observed in the lesion

图3 患者男,45岁,肝S6见4.2 cm×4.6 cm的混杂信号影,后缘见片状以短T1信号影(图3A),DWI低信号(图3B),增强动脉期斑片状强化(图3C),肝特异期未见造影剂摄取呈低信号(图3D)。6个月后随访:图3E(T1WI)和3F(动脉期),肝S6内见斑片状短T1信号影较前增大,增强扫描动脉期不均匀强化,最终诊断为存活病灶Fig.3 Images of 45-year-old male patient.A mixed signal lesion of 4.2 cm×4.6 cm was found in the S6 of liver.On the posterior of the lesion,there was an irrregulr and patchy lesion with hyperintense on T1WI(Fig.3 A)and hypointense on DWI(Fig.3 B),and patchy enhancement in arterial phase(Fig.3 C);but no hypointense of contrast agent uptake was displayed in liver-specific phase (Fig.3 D).Images of Fig.3 E(T1WI),Fig.3 F(arterial phase)revealed that at his 6-month follow-up,there were patchy lesion with larger hyperintense on T1WI and nonuniform enhancements in arterial phase.It was eventually diagnosed as residual lesion

表3 影像学征象基线资料及诊断价值的单因素分析Tab.3 Univariate analysis on baseline data and diagnostic value of imaging signs
TACE 术后高浓度化疗药物的细胞毒性作用、碘化油栓塞HCC 供血动脉,能破坏肿瘤细胞的细胞膜或诱导细胞发生凋亡,不仅导致肿瘤组织内细胞坏死崩解、数量减少、密度减低,还会因细胞间隙增宽从而在病理生理水平出现水分子的弥散运动速度加快、范围增宽,因此坏死灶由于弥散不受限在DWI图像上呈低信号,ADC 值较高;而存活或复发HCC 病灶由于正常肝细胞被癌细胞取代,癌细胞密度高、水分子运动扩散受限,故在DWI呈高信号、ADC值为低信号[14-16]。本研究结果提示存活或复发DWI多为高信号,坏死灶多为低信号,而且DWI对诊断存活或复发灶具有较高的敏感度、特异度。但本研究中存在4例假阳性、假阴性结果,笔者认为与以下因素相关:(1)DWI图像分辨率较低造成小病灶检出较困难;(2)DWI信号受到磁场不均匀和T2穿透效应的影响,易产生伪影及图像变形[17-18];(3)TACE术后瘤周的炎性反应也会造成假阳性结果[6];(4)囊肿、血管瘤、高级别发育不良结节也会导致误诊[19-20]。但本研究中ADC 值鉴别TACE 术后HCC 存活或复发较DWI成像特异度高,提示通过测量ADC值能减少假阳性率,这可能与ADC 值不受T2穿透效应的影响有关[21]。但ADC 值的敏感度低于DWI,这主要与部分存活或复发灶直径较小而导致ROI包含部分正常肝组织从而出现ADC 值失真有关。通过Gd-EOB-DTPA 增强MRI和DWI联合成像对TACE 术后随访结果研究发现,除1 例直径0.5 cm 的较小存活灶因周围炎性反应漏诊外,其余46 例存活或复发灶均明确诊断,提示Gd-EOB-DTPA 增强MRI和DWI联合成像可以优势互补,能作为临床诊断TACE 术后存活或复发的“金标准”。
虽然本研究在国内外较先应用Gd-EOB-DTPA增强MRI和DWI联合成像评估TACE术后HCC存活或复发病灶的诊断价值、影像学征象预测病灶存活或复发的效能,但也存在以下不足:(1)由于Gd-EOB-DTPA 增强MRI检查费用较高、患者具有其他影像学资料(如超声、CT),因此未在TACE 术前进行Gd-EOB-DTPA增强MRI检查和DWI检查,无法对比分析TACE 术前术后ADC 值变化;(2)研究中部分缺乏病理学依据。
综上所述,Gd-EOB-DTPA增强MRI较DWI诊断TACE术后HCC存活或复发病灶的价值高,但两者联合能提高诊断价值,TACE 术后病灶无包膜、DWI高信号、动脉期增强表现有助于预测TACE 术后病灶存活或复发、坏死。
