QuEChERS净化-超高效液相色谱-串联质谱法测定凯特芒果中14种农药残留
2020-06-06田金凤尚远宏
田金凤,尚远宏
(攀枝花学院 医学院,四川 攀枝花,617000)
芒果(MangiferaindicaLinn.)是漆树科杧果属的多年生植物[1],其果实享有热带果王之称[2-3]。目前,攀枝花市的芒果上市时间较国内其他产区晚2~3个月,凯特芒果种植总面积在全市芒果种植中接近70%[4],且凯特芒果作为晚熟品种占比最大[5],具有较强的市场竞争力。同时,中国是世界最大芒果消费国和主要生产国,但我国芒果农药种类和农药残留标准指标少,针对性不强[6];随着进出口贸易逐年加大,如何使国家在制修订农药残留标准时,既符合贸易国的芒果进出口的规定,又要保护国内芒果生产,高度重视芒果质量安全问题变得非常重要。
我国芒果主要分布在海南、台湾、四川和广东等热带亚热带地区,该地区具有高温高湿的气候特点,且芒果缺乏优良的抗病品种[7],使得在芒果上发生的病虫害较为普遍。芒果生产过程中农药施用不合理,造成芒果产品农药残留问题日益凸显,导致其安全性和食用性均受到影响。2020年2月15日将正式实施的GB 2763—2019中,规定芒果专属的农药27种(表1)[8],包含11种杀虫剂,14种杀菌剂和2种植物生长调节剂。标准中,除芒果专属的农药(1种杀菌剂“咪鲜胺和咪鲜胺锰盐”及1种杀虫剂“氰戊菊酯和S-氰戊菊酯”)之外,有“皮不可食的热带和亚热带水果”要求的芒果非专属(间接)的农药47种,含44种杀虫剂和3种除草剂。目前,我国尚未对三唑酮、丙环唑、嘧霉胺、甲霜灵、烯酰吗啉、恶霜灵、腈菌唑等7种杀菌剂和氧乐果、克百威、三羟基克百威3种杀虫剂在芒果中残留限量做出规定,也无对其残留测定的标准方法。因此,探讨并建立同时检测芒果中14种农药残留标准具有实际意义。

表1 中国的芒果专属的农药残留标准限量Table 1 Maximum residue limits(MRL)to pesticides in mango of China
注:*表示该限量为临时限量
目前,现行国家标准 GB/T 20769—2008有水果和蔬菜中农药残留量分析的液相色谱-串联质谱检测方法,但该方法前处理操作繁琐、成本高、费时费力,不适合大批量样品的快速定性及定量分析[9]。而国内外也有利用气相色谱法和液相色谱法等方法检测芒果中农药残留的报道[10-12],常采用传统的固相萃取或液液萃取的前处理净化方法,存在操作繁琐、消耗时间长等不足,不适用于高通量检测芒果中农药残留。同时,芒果的基质成分复杂,特别是攀枝花的凯特芒果甜度高、含糖量大,分离分析难度大,检测干扰严重。尚未见同时检测凯特芒果中多菌灵、三唑酮、戊唑醇、丙环唑、嘧霉胺、甲霜灵、烯酰吗啉、苯醚甲环唑、恶霜灵、腈菌唑、吡唑醚菌酯等11种杀菌剂和氧乐果、克百威、三羟基克百威3种杀虫剂的残留报道。高通量检测蔬菜及水果中农药多残留的最有效和快速的前处理净化方法是QuEChERS法[13]。QuEChERS技术具有快速、高效等优点,被广泛运用于农药残留分析的前处理过程中。液相色谱-串联质谱法具有高通量、高选择性和高灵敏度等特点,是农药残留分析的热点技术之一[14-15]。但QuEChERS方法在结合液相色谱-串联质谱仪分析时,样品提取溶剂及量的变化会造成环境污染和溶剂效应,本文对提取溶剂、体积和提取次数进行优化,提高了方法的适用性。
食品中农药最大残留限量新标准的实施,对于芒果农残检测的数量增多和限量要求越来越严格,因此通过有效的技术手段,对芒果中的有关药物残留进行检测,以确保人类对芒果消费的安全,具有十分重要的意义。本文以凯特芒果为研究对象,优化了QuEChERS前处理条件、色谱条件和质谱条件等,采用超高效液相色谱-串联质谱法测定凯特芒果中14种农药残留,其方法准确可靠,操作简易,回收率稳定,能满足日常凯特芒果农药残留的检测要求。
1 材料与方法
1.1 材料与仪器
凯特芒果,攀枝花地区市售或采摘晚熟凯特芒果;甲酸、甲醇(色谱级) Fisher公司;农药标准品:多菌灵、嘧霉胺、甲霜灵、烯酰吗啉、三唑酮、戊唑醇、丙环唑、苯醚甲环唑、氧乐果、克百威、三羟基克百威、恶霜灵、腈菌唑、吡唑醚菌酯,纯度均大于98%,德国Dr.Ehrenstorfer GmbH;其他试剂为国产分析纯。
Agilent 6460A超高效液相色谱-串联四级杆质谱仪,美国Agilent 公司;1-14k离心机,Sigma公司;FA2014B电子天平,上海越平公司;Milli-Q IQ7000超纯水器,美国Millipore公司;VORTEX 4涡旋混合器,LMS公司;NEVAP-45氮吹仪,美国Organomation公司。
1.2 实验方法
1.2.1 标准溶液的配制
分别准确称取适量14种标准品,分别用甲醇溶解并配制成1.0 mg/mL的标准储备液,-20 ℃避光保存。其他浓度标准溶液用甲醇定量稀释即得。
1.2.2 样品前处理
芒果去皮去核取可食用部分,称取10.0 g芒果样品(精确至0.01 g)于50 mL聚丙烯刻度离心管中,加入10 mL体积分数0.5%甲酸乙腈溶液[16],振荡涡旋20 min,加入NaCl 1 g和无水MgSO45 g[17],立即涡旋混匀10 s,然后10 000 r/min离心5 min,取上清液5.0 mL,加入QuEChERS试剂管中涡旋混匀1 min,再10 000 r/min离心3 min,取上清液0.5 mL,用水定容至1 mL,混匀后14 000 r/min离心5 min,过0.22 μm滤膜,即得。
1.2.3 仪器条件
色谱条件:色谱柱ZORBAX SB-C18(2.1 mm×100 mm,1.8 μm);流动相4 mmol/L甲酸水溶液-甲醇[18],梯度洗脱;流速0.2 mL/min;进样体积2 μL;柱温30 ℃;洗脱方式:梯度洗脱,洗脱程序0~7.5 min,甲醇由体积分数30%升至90%;7.5~10 min,甲醇为90%;10~10.5 min,甲醇由90%降至30%;10.5~15 min,甲醇为30%。
质谱条件:离子源:电喷雾离子源;扫描方式:正离子扫描;检测方式多反应监测(multiple reaction monitoring, MRM);雾化气压力45 psi;辅助气流速11 L/min;辅助气温度300 ℃;电喷雾电压4 000 V。
14种农药的多反应监测质谱参数见表2。
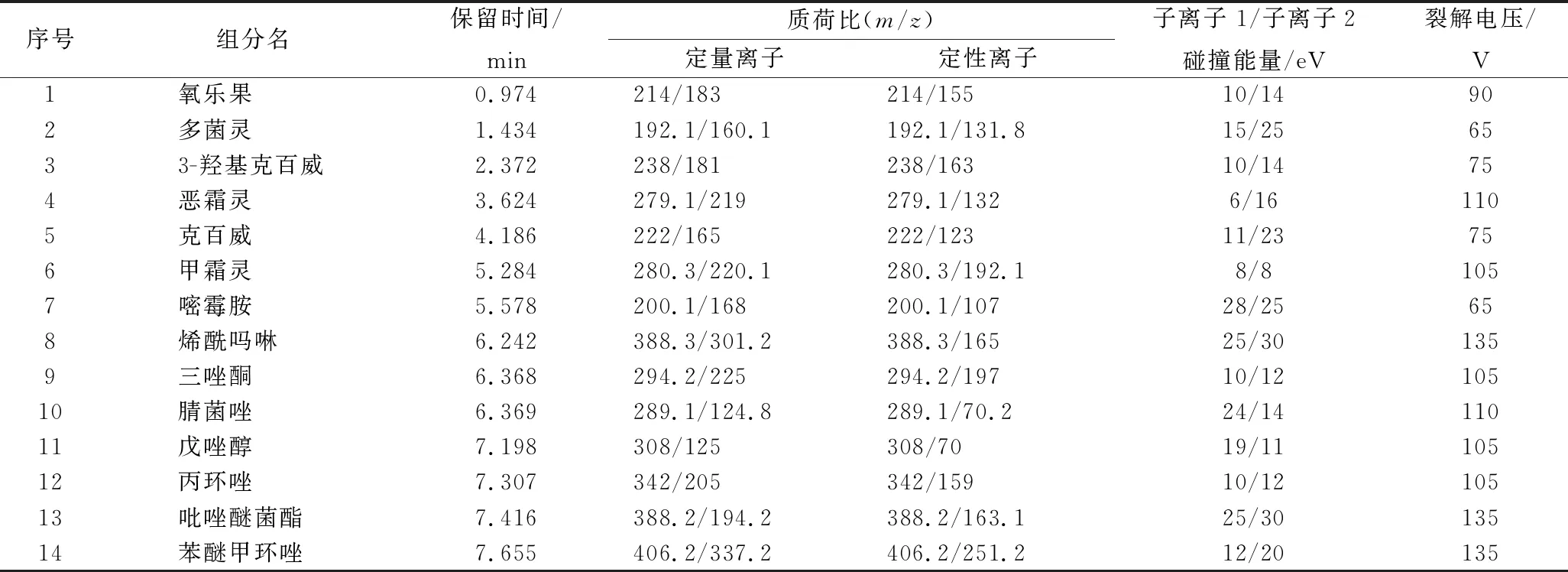
表2 多反应监测模式下14 种农药的质谱参数Table 2 MS conditions under MRM mode of the 14 pesticide residues
1.2.4 方法的标准曲线、线性范围及检出限
配制好的 14种农药标准储备液用甲醇稀释成400 μg/L混合标准溶液,用空白芒果基质提取液将混合标准溶液稀释成200、100、80、40、20、10、4 μg/L系列质量浓度的混合标准溶液分别进行测定。以质量浓度为横坐标,定量离子峰面积为纵坐标,采用外标法建立标准曲线。以3倍信噪比(S/N≥3)和10倍信噪比(S/N≥10) 分别确定检出限(limit of detection, LOD)与定量限(limit of quantitation, LOQ)[19]。
2 结果与分析
2.1 色谱和质谱条件优化
实验对比ZORBAX-C18色谱柱(2.1 mm×100 mm,1.8 μm)和核壳柱Poroshell 120 EC- C18(3.0 mm×100 mm,2.7 μm),分别对14种质量浓度为100 μg/L的目标化合物进样,优化其色谱和质谱条件。结果显示,使用ZORBAX-C18柱适用性好,出峰均匀,峰形尖锐,分离度好;而流动相中加入少量酸能够达到改善峰形、提高分离效率的作用,并且化合物更容易离子化,提高灵敏度;同时,在子离子扫描模式下,优化碰撞能量,得到相应的离子碎片。14种农药的MRM色谱图见图1,二级离子质谱图见图2。
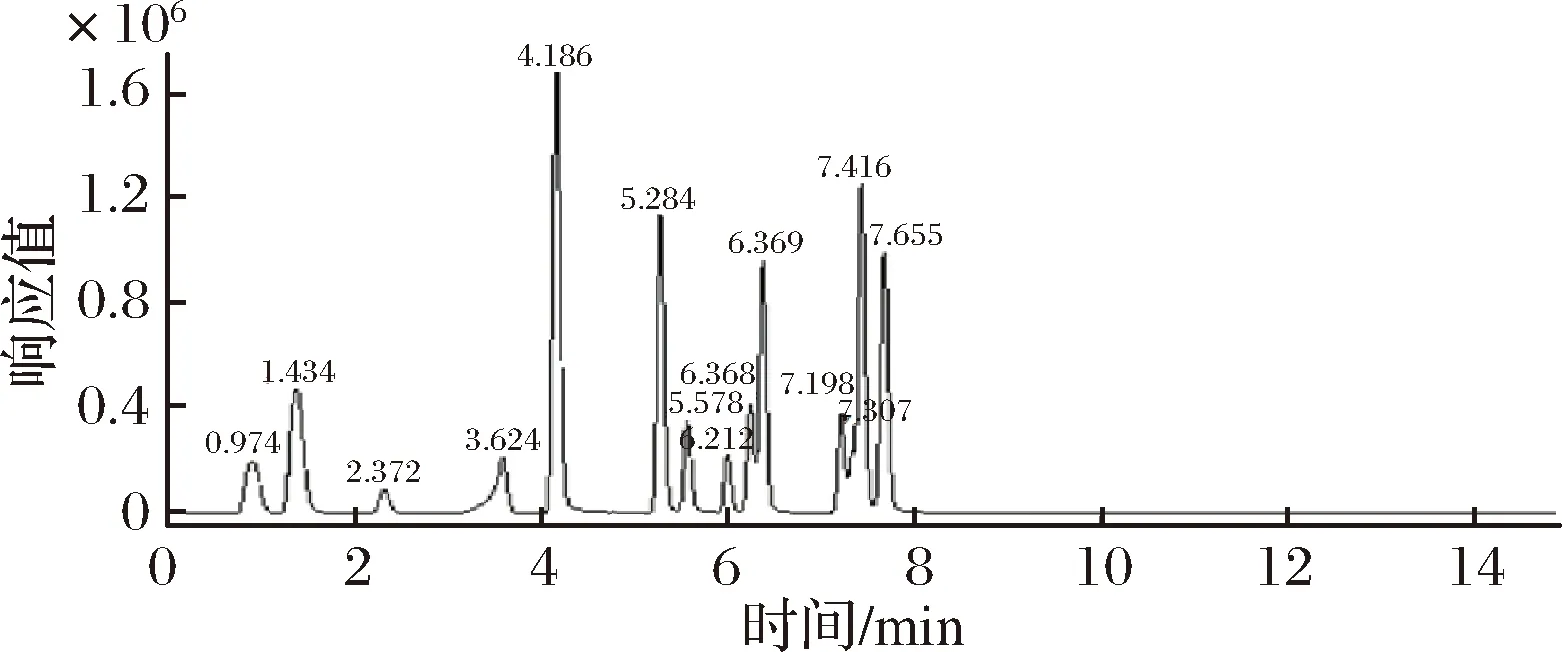
图1 100 μg/L混合标准溶液的MRM色谱图Fig.1 MRM chromatogram of 100 μg/L mixed standardsolution
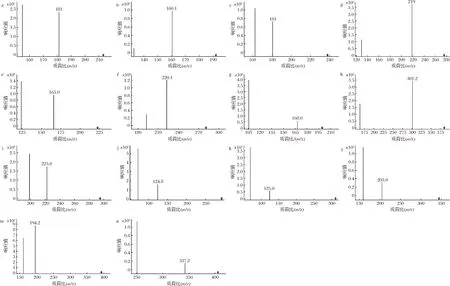
图2 14种农药的二级离子质谱图Fig.2 MS /MS spectra of the 14 pesticide residues注:a~n分别对应表2中1~14农药
2.2 提取条件的优化
样品前处理参照文献[16]方法适当改进,分别采用8、10、12 mL 0.5%甲酸乙腈和乙腈溶液提取进行比较,结果发现14 种农药经10 mL 0.5%甲酸乙腈溶液提取1次效果最好,而且提取次数的增加并不会引起提取率显著提高,达到节约试剂和减少环境污染,且用乙腈溶液提取比0.5%甲酸乙腈提取的杂质多。同时,样品前处理过程中用无水MgSO4和NaCl作为除水剂,NaCl加大水中的离子强度,因盐析作用将样品中水层和有机试剂乙腈层分离,而无水MgSO4和水分子结合来起到除水作用。
2.3 方法的线性关系及检出限
14种农药的线性回归方程、相关系数、线性范围及检出限见表3。14种农药在4.0~200.0 μg/L线性范围内的相关系数均>0.999,LOQ为0.15~1.0 μg/kg,均低于中国和欧盟规定的最大残留限量值[6]。同时,食品安全国家标准的检测方法中含14种农药残留以适用于“芒果”、“其他食品”或“其他蔬菜和水果”可参照执行的检测方法相比,GB 23200.8—2016中规定甲霜灵的LOQ为0.037 6 mg/kg、三唑酮为0.025 0 mg/kg、腈菌唑为0.012 6 mg/kg、丙环唑为0.037 6 mg/kg、恶霜灵为0.012 6 mg/kg、戊唑醇为0.037 6 mg/kg[20];GB 23200.34—2016中吡唑醚菌酯和3-羟基克百威的LOQ均为0.005 mg/kg[21];GB 23200.49—2016中苯醚甲环唑的LOQ为0.005 mg/kg[22];NY/T 1453—2007中多菌灵的LOQ为0.02 mg/kg[23];SN/T 0519—2010中丙环唑的LOQ为0.01 mg/kg[24];GB 23200.46—2016中腈菌唑的LOQ为0.01 mg/kg[25]。均比本文中14种相应农药的残留LOQ规定值大。本方法具备了更灵敏的定量检测能力,解决了芒果中农药检测的问题,对芒果的农残检测具有一定专属性,能满足凯特芒果中14种农药残留检测的要求。

表3 14种农药的线性范围、回归方程和相关系数Table 3 Linear regression equations, correlation coefficients and detection limits of 14 pesticides
注:克百威及3-羟基克百威之和,以克百威表示残留物
2.4 方法的回收率与精密度
以5、20、100 μg/kg的水平将14种农药添加到空白凯特芒果基质中,测定回收率,结果见表4。
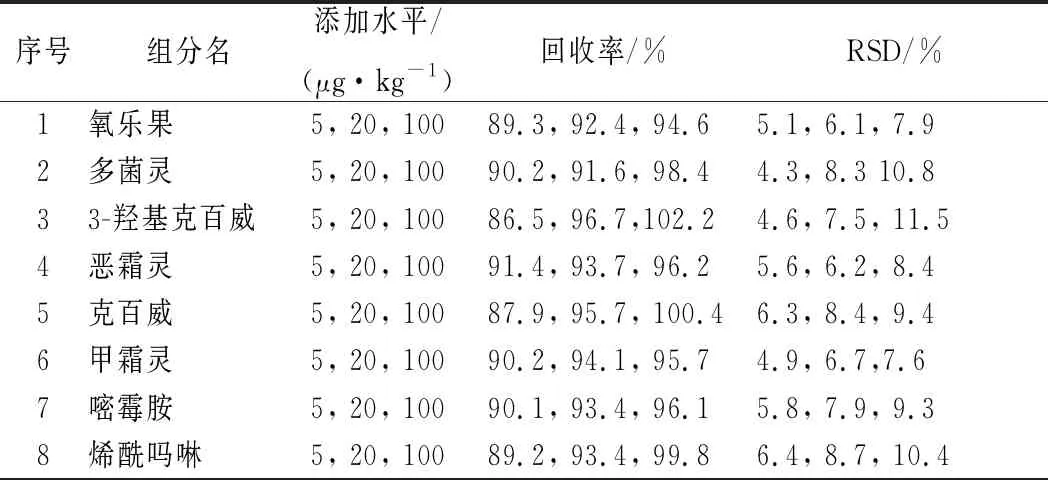
表4 14种农药的添加回收率和相对标准偏差(n=6)Table 4 Spiked recoveries and relative standard deviations(RSD) of the 14 pesticides (n=6)
续表4
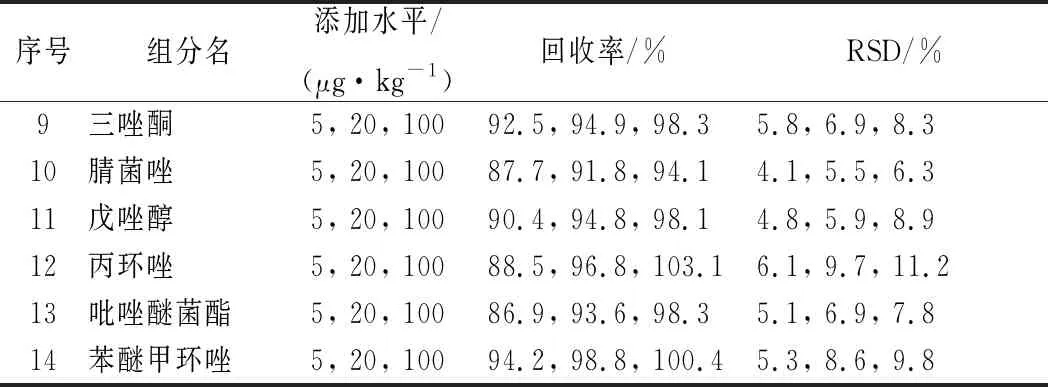
序号组分名添加水平/(μg·kg-1)回收率/%RSD/%9三唑酮5, 20, 10092.5, 94.9, 98.35.8, 6.9, 8.310腈菌唑5, 20, 10087.7, 91.8, 94.14.1, 5.5, 6.311戊唑醇5, 20, 10090.4, 94.8, 98.14.8, 5.9, 8.912丙环唑5, 20, 10088.5, 96.8, 103.16.1, 9.7, 11.213吡唑醚菌酯5, 20, 10086.9, 93.6, 98.35.1, 6.9, 7.814苯醚甲环唑5, 20, 10094.2, 98.8, 100.45.3, 8.6, 9.8
14种农药在凯特中的回收率范围为86.5%~103.1%,相对标准偏差为4.1%~11.5%,回收率与精密度满足农药定量分析要求[26]。
3 结论
本文结合固相萃取技术,以高效液相色谱-串联质谱法建立了凯特中14种农药残留的分析测定方法。该方法前处理操作简单,净化效果好,灵敏度高,干扰少,其LOQ 可达到0.15 μg/kg,凯特芒果样品中14 种农药均未检出,在实际检测中具有较强的可行性和实用性,也适用于芒果各品种中14种农药残留的定性和定量分析,且对于即将实施的GB 2763—2019标准的完善芒果中多种农药残留的检测方法和限量标准的制定是十分必要的。
