猪A 型塞内卡病毒感染诱导猪肾细胞(PK-15)长链非编码RNA 差异表达谱的分析
2020-06-05唐晓钰周芝海吴芮庭陈雨琪郑瑶瑶苏江南马静云
唐晓钰,周芝海,吴芮庭,陈雨琪,郑瑶瑶,苏江南,马静云
(华南农业大学 动物科学学院,广东 广州 510642)
猪A 型塞内卡病毒(Senecavirus A, SVA)是一种小核糖核苷酸病毒,最初被称为塞内加谷病毒(Seneca Valley virus,SVV)。SVA 感染的主要症状是猪的蹄、嘴和鼻子出现水疱,并且可能会伴有跛足,仔猪表现为急性死亡[1-2]。截至目前,巴西、美国、加拿大、泰国和中国等多个国家已经相继报道SVA 阳性病例[3-4]。口蹄疫(FMD)是世界动物卫生组织关注的疾病,鉴于SVA 的临床症状与FMD 相似,因此SVA 也具有很高的研究价值[5]。
lncRNA 是一类长度大于200 个核苷酸并且不具有编码蛋白质能力的RNA[6]。 研究表明,哺乳动物中数以千计的lncRNA 不仅涉及细胞代谢,细胞凋亡和细胞增殖等生命过程,而且还有一些lncRNA 能够作为先天性免疫的模式识别受体(PRR)调节免疫反应[7-9]。有学者发现lncRNA 能够参与病毒感染的过程,例如,横纹肌肉瘤细胞感染肠道病毒71(EV71)后,有超过4 800 个lncRNA 的差异表达[10]。狂犬病病毒感染小鼠脑组织后,与对照组相比实验组小鼠小脑组织中有88 个lncRNA 差异表达[11]。LncRNA 还能作为竞争性内源RNA(ceRNA)与miRNA 和mRNA相互作用从而影响miRNA 对mRNA 的调控,该作用模式能够在多种疾病进程中产生影响[12]。
SVA 已引起各国科学工作者和养猪企业的高度重视,相关研究例如分子流行病学、检测方法、致病性等内容已展开[13]。然而,截止到目前,有关SVA 感染引发宿主lncRNA 作用机制的研究未见报道。为研究lncRNA 是否在SVA 感染过程中起到功能性作用,本研究对SVA 感染PK-15 细胞24 h 后差异表达的lncRNA 进行分析,为lncRNA 调控SVA 感染的分子机制的研究奠定基础。
1 材料与方法
1.1 病毒株、细胞株及主要试剂 SVA CH-01-2015株由由本实验室分离鉴定,实验所采用的CH-01-2015 第5 代病毒液滴度为1×106.7TCID50/mL;PK-15细胞系由华南农业大学动物科学学院家禽研究室保存;TRIzol®Reagent 总RNA 提取试剂盒购自Invitrogen 公 司;RNeasy Mini Kit 购 自Qiagen 公 司;胎 牛 血清(FBS)及细胞培养基(DMEM)购自HyClone 公司;HiScript Ⅲ1st Strand cDNA Synthesis Kit(+gDNA wiper)及ChamQ Universal SYBR qPCR Master Mix 购自Vazyme;Agilent 2100 生物分析仪购自Agilent 公司。
1.2 引物的设计与合成 根据NONCODE 及NCBI中序列,利用Primer 5.0 软件设计引物,甘油醛-3-磷酸脱氢酶(GAPDH)用作内源对照(表1),引物由深圳华大基因合成。
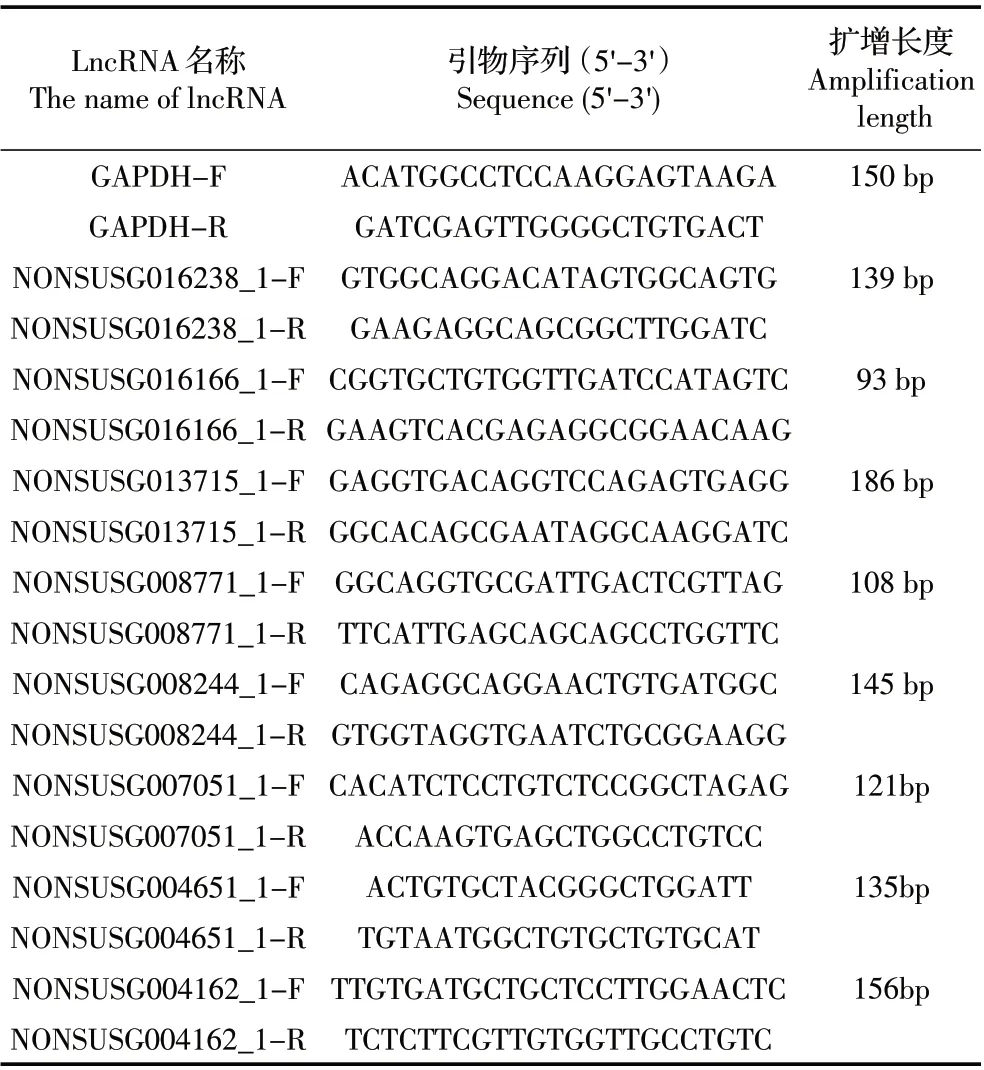
表1 引物序列Table 1 Primer sequences
1.3 SVA 感染PK-15 细胞基因文库的建立以及高通量测序 以1×106个细胞/孔的密度将细胞接种至六孔细胞培养板后加入含10%胎牛血清的细胞培养基,于37 ℃5% CO2培养。当细胞汇合度至80%~90%时,以MOI 1.5 的剂量接种SVA 作为感染组。病毒吸附1 h 后,换成含2%胎牛血清的细胞培养基于培养箱中继续培养。同时设置对照组(正常生长的PK-15 细胞),每组设置3 个重复。
利用TRIzol 提取对照组与感染组细胞的总RNA。根据Qiagen RNeasy Mini Kit 的说明书对RNA进行纯化。使用Agilent 2100 生物分析仪测量RNA 浓度和完整性。用带有OligodT 的磁珠处理总RNA 得到含polyA 尾巴的mRNA,随后用DNA 探针杂交rRNA,RNaseH 选择性消化DNA/RNA 杂交链,再用DNaseI 消化掉DNA 探针,凝胶电泳分析后胶回收纯化得到所需RNA;Mg2+溶液处理RNA 后利用随机引物N6 对RNA 反转录,合成cDNA 的第二链形成双链DNA;将3'端带有dT 突出的接头序列连接至5'端包含磷酸基团且3'端带有dA 突出的双链DNA 末端;连接产物通过特异性引物PCR 扩增后产物热变性为单链,再用一段桥式引物将单链DNA 环化得到单链环状DNA 文库。由上海派森诺生物利用Illumina NextSeq 500 进行测序。
1.4 LncRNA 筛选与生物信息学分析 对测序所获得的转录本进行筛选,初步筛选条件为:外显子个数≥2; lncRNA 长 度 大 于200 bp; FPKM≥0.5;Reads 最小覆盖度≥3,并且确定转录本不具有编码蛋白的能力后对转录本进一步分析,同时使用CPC(http://cpc.cbi.pku.edu.cn/)、CNCI(http://www.bioinfo.org/soft ware/cnci/)、Pfamscan(http://www.ebi.ac.uk/Tools/pfa/pfamscan/)3 种方法进行分析,取三者分析结果的交集,以期获得高可信度的lncRNA,并使用Cuffdiff软件计算对照组与感染组lncRNA 的差异表达。
采用DAVID 在线分析软件对lncRNA 的靶基因进行GO 和KEGG 分析,确定lncRNA 靶基因所影响的生物学功能或途径,利用Cytoscape 软件构建靶基因的GO 和KEGG 可视化图。
1.5 LncRNA-miRNA-mRNA 关联网络构建 使用在线靶基因预测软件RegRNA2.0 预测了与高通量测序所给的差异表达lncRNA 有靶向关系的miRNA,lncRNA 靶向关系miRNA 预测的阈值参数为:score>160;free energy≤-25。对lncRNA 具有靶向关系的miRNA 利用miranda 算法进行靶基因预测,针对上述筛选得到的差异表达miRNA,利用miranda 算法预测miRNA 的靶基因,阈值参数为:score>160;free energy≤-25。
1.6 差异表达lncRNA 的qPCR 验证 选取8 个与lncRNA-miRNA-mRNA 调控网络相关差异表达的lncRNA 进行qPCR 表达量验证。使用总RNA 提取试剂盒从细胞中提取总RNA, 利用反转录试剂盒将2 μg的总RNA 逆转录为cDNA。在ABI PRISM 7500 仪器上采用ChamQ Universal SYBR qPCR Master Mix 试剂进行qPCR 检测,反应程序为:95 ℃2 min;95 ℃15 s、60 ℃20 s、72 ℃30 s,40 个循环,在延伸结束收集荧光信号进入溶解曲线步骤:95 ℃15 s、60 ℃60 s、95 ℃15 s。每个反应进行3 个重复,以GAPDH作为对照对数据进行标准化,基于2-ΔΔCT方法计算lncRNA 的表达水平。
2 结 果
2.1 SVA 感染诱导PK-15 细胞差异表达的lncRNA在病毒感染后18 h 感染组细胞开始变圆,24 h 感染组细胞开始进一步皱缩脱落,出现明显的细胞病变(图1),因此提取感染后第24 h 对照组和感染组细胞的总RNA 进行数据库的建立及高通量测序。为研究lncRNA 在SVA 感染过程中的作用,本研究分析了细胞样品的RNA-seq 数据,去除了低质量序列和接头序列,同时lncRNA 需要满足Fold-change≥2 和FDR≤0.05 两个筛选条件,获得了420 个差异表达的lncRNA。其中,232个lncRNA的表达量上调,上调倍数最大的是NONSUSG012753_1;188 个lncRNA 的表达量下调,下调倍数最大的是NONSUSG018069_1。Cuffilinks软件利用测序的比对结果来组装转录本,鉴定出新的转录本,使用CPC、CNCI 和Pfamscan 预测转录本的编码能力,共鉴定出623 个新的lncRNA。
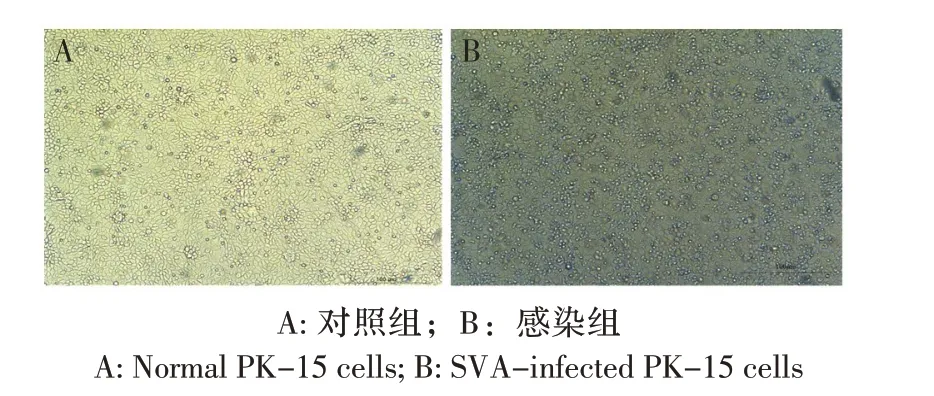
图1 SVA 感染PK-15 细胞24 h 的病变情况Fig.1 The cytopathy effect formation in SVA infected of PK-15 cells at 24 h
2.2 LncRNA 靶基因的生物功能分析 GO 数据库用于差异表达lncRNA 靶基因的富集分析,结果显示7 个靶基因共富集到113 个条目。lncRNA 临近编码基因GO 功能分析结果显示,SVA 感染细胞24 h后,对于生物学进程而言,lncRNA 的靶基因主要富集在细胞凋亡的调控、细胞程序性死亡的调控、RNA 代谢过程的调节、免疫系统的发育和转录调控等;对于细胞组分而言,lncRNA 靶基因的表达产物主要分布在细胞膜、内质网和细胞外基质等位置;对于分子功能而言,lncRNA 靶基因主要影响肽酶活性、离子结合和生长因子活性等方面(图2)。其中,NONSUSG013322_1 和NONSUSG012660_1 的 靶 基因转化生长因子β1(TGFB1)基因共富集到62 个GO条目,它具有调节细胞增殖、分化、生长和免疫调节等功能。
利用KEGG 数据库对lncRNA 靶基因的信号通路富集情况进行分析,结果显示共富集到28 条信号通路,这些通路大多与疾病的发生、细胞凋亡、物质代谢和免疫调节相关(图3)。其中,NONSUSG013322_1 和NONSUSG012660_1 的靶基因TGFB1 参与免疫球蛋白A(IgA)产生的肠道免疫网络信号通路和TGF-β信号转导通路的调控;NONSUSG006488_1 的靶基因CASP10 参与了RIG-I 样受体信号通路的调节,因此lncRNA 在SVA 感染期间能够参与宿主的免疫调节反应。
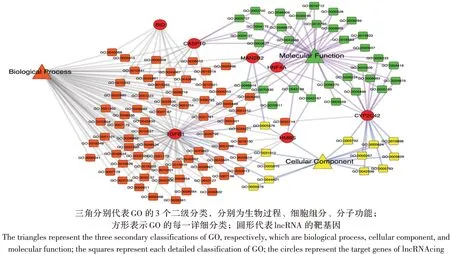
图2 lncRNA 靶基因的GO 分析Fig.2 GO analysis of lncRNA target genes
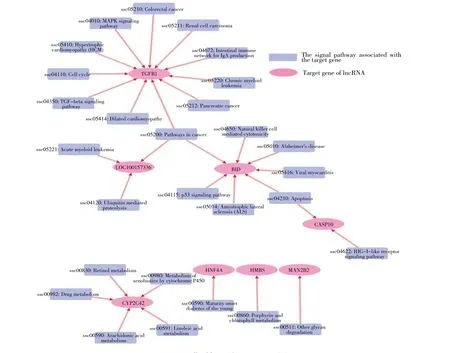
图3 lncRNA 靶基因的KEGG 分析Fig.3 KEGG analysis of lncRNA target genes
2.3 LncRNA-miRNA-mRNA 调控网络分析 将lncRNA-miRNA-mRNA 之间的靶向关系通过Cytoscape软件构建成可视化lncRNA-miRNA-mRNA关联网络图(图4)。从关联网络图中可见,一共涉及9 个lncRNA、6 个miRNA 以及85 个mRNA,这些lncRNA、miRNA和mRNA在SVA感染PK-15细胞后均存在差异表达。其中,NONSUSG017222_1 与ssc-miR-17-3p、NONSUSG004162_1 与ssc-miR-193a-5p、 NONSUSG 008244_1 与ssc-miR-320 以 及NONSUSG016166_1、NONSUSG016238_1 和NONSUSG008771_1 与ssc-miR-328这6对lncRNA-miRNA之间存在负调控关系,表明这些lncRNA可能作为ceRNA结合miRNA发挥作用。
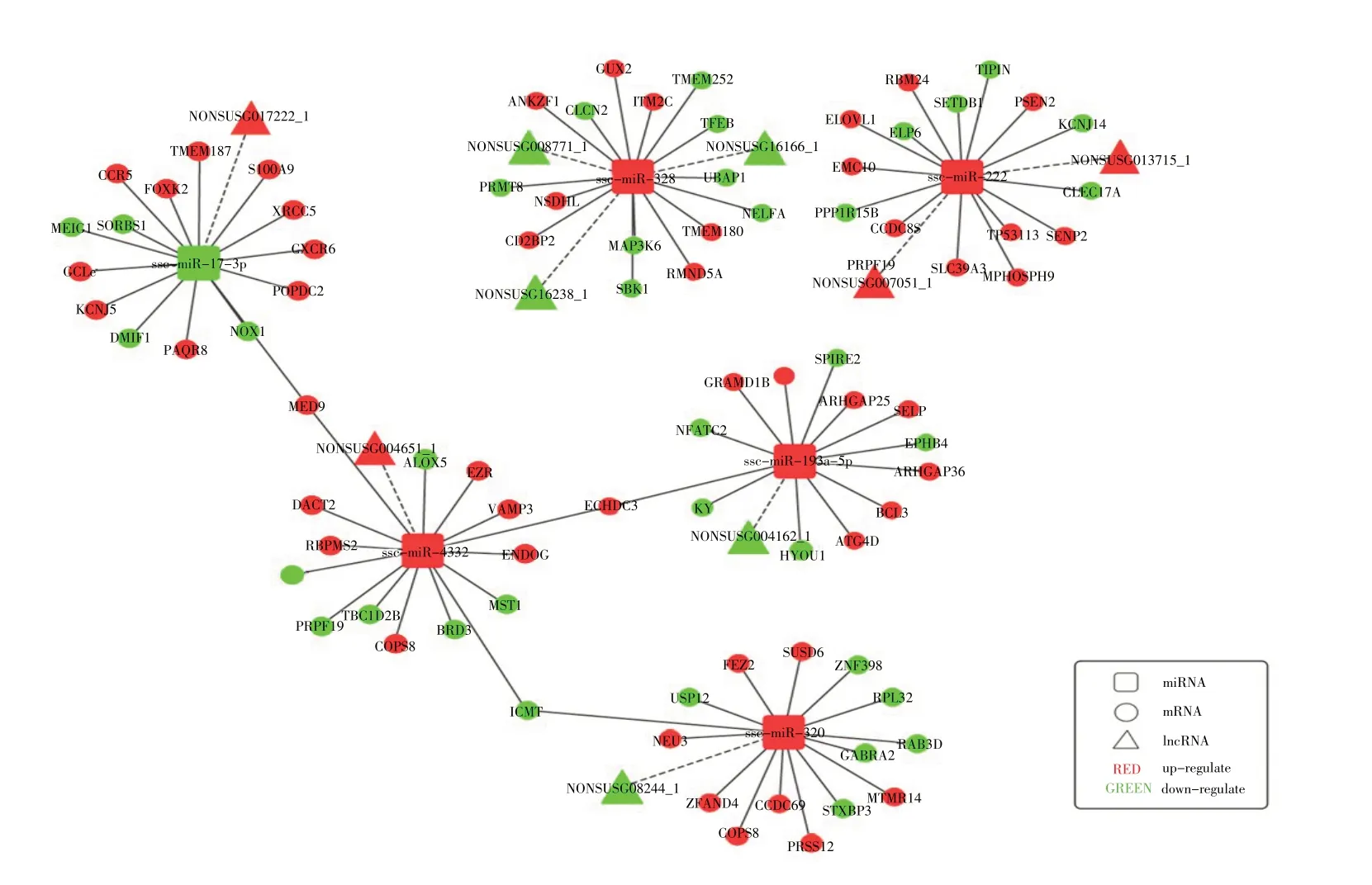
图4 lncRNA-miRNA-mRNA 关联网络图Fig.4 lncRNA-miRNA-mRNA association network map
2.4 荧光定量PCR(qPCR)验证差异表达lncRNA 的表达量 本研究选取8 个与lncRNA-miRNA-mRNA调控网络相关的差异表达lncRNA 进行表达量的qPCR验证。对从实验组与对照组细胞中提取的总RNA逆转录后进行qPCR,被选取的8 个lncRNA 包括NONSUS G007051_1、NONSUSG004651_1、NONSUSG008244_1、NONSUSG008771_1、NONSUSG016166_1、NONSUSG 016238_1、 NONSUSG013715_1 和NONSUSG017222_1,qPCR 的验证结果显示,8 个lncRNA 在SVA 感染期间表达量发生了显著变化,与RNA-seq 结果一致(图5),表明高通量测序结果真实可信。
3 讨 论
lncRNA 的主要研究成果集中在人类医学,如心血管疾病和肿瘤等[14-15]。 LncRNA 在兽医方面的研究还处于初期阶段,大多数现有的研究都是关于胚胎发育、脂肪代谢、动物肌肉和骨骼生长[16-17]。最近的研究表明,病毒感染诱导产生的lncRNA 能够促进或抑制病毒应答。例如,lncRNA ACOD1,可增强小鼠和人类细胞中多种病毒的复制;lncRNA NEAT1可以在病毒感染期间上调抗病毒因子,在抗病毒反应过程中起到积极作用,NEAT1 又可以促进HIV-1的复制[18]。目前尚未发现lncRNA 对SVA 影响的相关报道。
SVA 被认为是水疱病的致病原因之一,其临床症状与经典水疱病毒疾病难以区分,例如,FMD、水疱性口炎(VS)、猪水疱病(SVD)[19]。SVA 流行以来给养猪行业带来了严重损失。通过对SVA 感染PK-15 细胞后的高通量测序结果进行分析,本研究发现共有420 个已知的差异表达lncRNA,623 个新鉴定的lncRNA。在已知的lncRNA 中发现有10 个lncRNA(NONSUSG001286_1、NONSUSG002331_1、NONSUSG 005175_1、 NONSUSG006959_1、 NONSUSG007404_1、NONSUSG009128_1、NONSUSG015104_1、NONSUSG 015283_、 NONSUSG015673_1、 NONSUSG015836_1)在对照组中的表达量为0,也就是说这些lncRNA 是SVA 感染后特异表达的lncRNA,具体作用有待进一步研究。本研究对lncRNA 的靶基因进行预测并经功能分析,发现靶基因在113 条GO 条目富集,参与了28 条信号通路的调控。其中,靶基因参与了细胞的增殖、凋亡以及一些癌症相关的信号通路调控,这可能与SVA 是一种溶瘤病毒有关。引人注目的是lncRNA 的靶基因能够参与IgA 产生的肠道免疫网络和RIG-I 信号通路等与免疫相关通路的调控,说明SVA 感染宿主细胞后诱导产生的差异表达lncRNA 参与了SVA 感染后宿主的免疫反应。有研究表明SVA 3C pro 能够介导宿主线粒体抗病毒信号蛋白(MAVS)、β干扰素TIR 结构域衔接蛋白(TRIF)、肿瘤坏死因子受体相关因子家族成员相关的NF-κB 活化剂(TANK)在定点裂解,从而逃避宿主的抗病毒天然免疫[20]。2018 年有学者发现SVA 3C pro 能够通过降解干扰素调节因子3(IRF3)和干扰素调节因子7(IRF7)消除IRF3 和IRF7 介导的先天免疫反应[21],所以lncRNA 是否参与了SVA 感染后宿主的抗病毒先天免疫将是进一步研究目标。同时,本研究还对lncRNA-miRNA-mRNA 进行了关联分析,这将有助于对lncRNA 调控机制的研究。
综上所述,本研究首次利用全面深度测序技术分析SVA 感染PK-15 细胞后差异表达lncRNA 的研究,lncRNA 在SVA 感染PK-15 细胞的生物进程中发挥了必不可少的作用,并能够调控与免疫相关的信号通路,这为SVA 的感染机制和免疫应答研究提供了新的方向。
