不同分子量双参多糖抗氧化活性研究
2020-06-05李彩艺谢文静王福生
李彩艺 谢文静 王福生
大理大学药学与化学学院,大理 671000
多糖是由10个及以上的单糖通过糖苷键连接而成的糖,属于高分子化合物。研究表明许多植物多糖具有免疫调节、降血脂、降血糖、抗肿瘤等生物活性[1]。双参(Triplostegiaglandulifera)为川续断科双参属植物,又称萝卜参、对对参、童子参、肚拉、土洋参和一支蒿等,主要产于云南、西藏、四川等地[2-3],课题组前期对双参小分子化合物进行了系列研究,尚未见文献报道双参多糖的研究。本课题旨在研究双参不同分子量双参多糖的抗氧化活性,以期为进一步研究双参多糖结构与活性提供参考依据。
1 仪器与材料
1.1 仪器 HPLC-1260型高效液相色谱仪;FY135型中草药粉碎机(天津泰斯特仪器有限公司);湘立离心机TD5A-WS(湖南湘立科学仪器有限公司);Shodex OHpak 804色谱柱(300 mm×7.5 mm)。
1.2 材料 右旋糖苷系列标准品180 Da(批号:140637-201203)、2500 Da(批号:140638-201203)、4600 Da(批号:140639-201203)、7100 Da(批号:140640-201203)、10000 Da(批号:140641-201203)、21400 Da(批号:140642-201203)、41100 Da(批号:140643-201203)、84400 Da(批号:140644-201203)、133800 Da(批号:140645-201203)、2000 kDa(批号:140646-201203)均购自中国食品药品检定研究院;1 mol/L Tis-Hcl缓冲液(批号:20190219,北京索莱宝公司)、DPPH(1,1-二苯基-2-苦基肼自由基,批号:ZZZQK-EE,梯希爱化成工业发展有限公司),水杨酸、H2O2、邻苯三酚、VC均购自国药集团化学试剂有限公司。
双参植物于2017年10月采自于云南省大理州云龙县五宝山,经大理大学段宝忠教授鉴定为川续断科双参属植物双参(TriplostegiaglanduliferaWall.)的地下根,植物样本(编号:WFS-20171017)存放于大理大学药学与化学学院王福生教授课题组。
2 方法
2.1 提取与分离 取双参块根进行干燥(50 ℃恒温干燥),利用粉碎机粉碎双参块根至80目筛制成干粉备用。称取干燥的双参粉末1 Kg,加入95%乙醇2 L冷浸过夜,弃上清,滤出药渣,加入2 L蒸馏水置于索式提取器中加热回流,每次2 h,此操作重复三次,合并续滤液,经减压浓缩后利用Sevag法去除蛋白,萃取后上层为蛋白质层,弃去,浓缩下层滤液成浸膏200 g溶解至蒸馏水中通过AB-8大孔吸附树脂柱层析脱去色素等小分子杂质,依次采用蒸馏水、30%甲醇-水和60%甲醇-水洗脱剂洗脱。以苯酚硫酸法监测合并具有同一峰型的洗脱成分即得双参粗多糖,将双参粗多糖减压浓缩至600 mL。采用分步醇沉的方法,依次加入无水乙醇至醇沉浓度分别为 40%,60%和80%,置4 ℃冰箱内过夜。3500 rpm离心10 min,沉淀冷冻干燥分别得不同分子量的双参多糖TGPA、TGPB和TGPC。
2.2 不同分子量双参多糖相对分子质量测定
2.2.1 色谱条件 色谱柱:Shodex OHpak 804(300 mm×7.5 mm);流动相:超纯水;浓度:标准品及样品质量浓度均为1 mg/mL;进样量:10 μL;体积流量:0.5 mL/min;柱箱温度:35℃;氮气流速:1.3 mL/min,蒸发光检测器蒸发温度:55℃;雾化温度:45℃。
2.2.2 含量测定 将右旋糖酐标准品180、2500、4600、7100、10000、21400、41100、84400、133800 Da、2000 KDa依次进样,测定保留时间。以相对分子质量对数(log Mw)为纵坐标保留时间(tR)为横坐标绘制标准曲线。根据线性回归方程计算样品的Mw。
2.3 清除DPPH活性作用的测定 精密称取DPPH粉末0.0128 g于50 mL容量瓶加入无水甲醇定容至刻度线,配制成0.65 mmol/L的DPPH-甲醇溶液,将多糖溶液配制成浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的样品溶液,向96孔板中加入50 μL不同浓度的样品溶液,每个样品浓度设5个复孔,再向各孔中加入150 μL DPPH甲醇溶液,以相同浓度的Vc溶液作阳性对照组,蒸馏水作空白对照,于室温黑暗处放置30 min后,酶标仪517 nm波长处测定吸光度值。根据公式1计算TGPA、TGPB和TGPC的清除率。
公式1=(Ablank-Asample)/Ablank
2.4 清除超氧阴离子作用测定 按照 Kao 等方法[4],将多糖溶液配制成浓度0.2、0.4、0.6、0.8、1.0 mg/mL的样品溶液。取10 mL试管加入1 mL多糖溶液,依次向试管中加入0.05 mol/L Tis-HCl(pH=8.2)4.5 mL,25 mmol/L邻苯三酚0.4 mL,于25℃水浴反应5 min后,加入8 mmol/L HCl 1 mL终止反应,以相同浓度的Vc作阳性对照组,蒸馏水作空白对照组。于299 nm处测定吸光度值,根据公式2计算不同醇沉浓度多糖对超氧阴离子的清除率。
公式2=(Ablank-Asample)/Ablank
3 结果
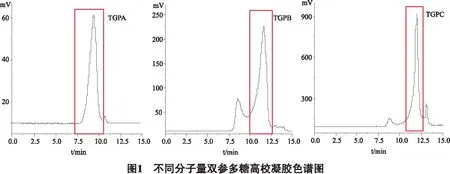
3.1 相对分子量的测定 根据系列不同分子量系列的标准品,按照相对分子质量对数(log Mw)为纵坐标;保留时间(tR)为横坐标绘制标准曲线,得曲线方程式为:y=-0.3491x+9.9531,R2=0.994。根据高效凝胶出峰时间(图2所示)可知TGPA分子量范围为1600~2000 KDa ;TGPB分子量范围为630~2000 KDa ;TPGC分子量范围为230~2000 KDa。其中TGPA主要的分子量为2000 KDa、TGPB主要为 691830KDa、 TGPC主要为575439KDa。如图1所示。
3.2 抗氧化活性 由图2可知,TGP-(A-C) 对DPPH和超氧阴离子的清除作用结果显示:在不同浓度下TGPA、TGPB和TGPC均对DPPH自由基和超氧阴离子均有一定的清除作用,其清除能力呈浓度依赖性。不同分子量的双参多糖对DPPH的清除作用效果没有太大的差距。而对于超氧阴离子的清除作用中,TGPC清除超氧阴离子的效果最为显著。TGPA和TGPB对超氧阴离子的清除也有一定的效果,其中TGPA的清除效果最弱。

4 结论
近年来,随着多糖研究的不断深入,发现植物多糖具有很多良好的生物活性。例如抗肿瘤、抗疲劳、降血糖等生物活性。而对双参多糖的研究尚未见其报道。本实验将双参多糖经水提醇沉、Sevag法脱蛋白、AB-8大孔吸附树脂柱分离,分步醇沉得到不同分子量的双参多糖。以蒸馏水作流动相,蒸发光检测器检测,采用不同分子量标准品建立标准曲线,从而确定双参多糖的分子量。理论上,分步醇沉中,低体积分数的乙醇溶液沉淀下来的双参多糖相对分子质量越大,而上清液部分则是相对分子质量小的双参多糖或寡糖,随着醇沉的次数增多,沉淀体积越来越少,离心后依旧存在少量沉淀部分存在上清液中,导致分子量存在交叉。由于交叉存在量很少可忽略不计。综合药理活性结果表明:不同分子量段的双参多糖均对DPPH体系和超氧阴离子体系具有清除作用,TGPA、TGPB和TGPC对DPPH的清除作用远远低于Vc的清除作用,而对超氧阴离子的清除作用中可以看出TGPC的清除作用远大于TGPA和TGPB双参多糖,当浓度达到1 mg/mL时清除超氧阴离子的作用与抗坏血酸作用相当。从而可以进一步推测在TGPC双参多糖具有更好的清除作用,继而为双参均一多糖的分离纯化、结构表征、药理活性及其作用机制的进一步研究提供了基础材料。
