乳腺包被性乳头状癌的磁共振成像特征及与囊实性乳腺导管内乳头状瘤的鉴别诊断
2020-06-05刘维肖刘春玲刘再毅叶维韬梁长虹
刘维肖 ,刘春玲,刘再毅,吴 磊, ,黎 娇,叶维韬,梁长虹
1. 汕头大学医学院,广东 汕头 515000;
2. 广东省人民医院(广东省医学科学院)放射科,广东 广州 510080;
3. 华南理工大学医学院,广东 广州 510006
乳腺包被性乳头状癌(encapsulated papillary carcinoma,EPC)也被称为包裹性乳头状癌、包膜内乳头状癌,过去叫做囊内乳头状癌,占所有乳腺癌的0.5%~1.0%[1]。随着病理学及免疫组织化学技术的发展,2012版世界卫生组织(World Health Organization,WHO)乳腺肿瘤分类,将乳腺EPC归为一类少见、特殊类型的乳头状肿瘤,存在浸润时被称为包被性乳头状癌伴浸润[2]。乳腺导管内乳头状瘤(breast intraductal papillomatosis,BIDP)是乳腺常见的良性乳头状病变,占乳腺疾病的0.7%~4.0%,临床常表现为乳腺肿块和(或)溢液[3]。影像学上可分为4种类型,其中囊实性肿块型,表现为扩张成囊状的导管内伴乳头状实性结节,不少良性导管内乳头状瘤可表现为囊实性肿块型[4]。乳腺EPC与囊实性BIDP同属于乳腺导管内乳头状肿瘤,在临床症状和影像学表现上有重叠,但二者的治疗方案及预后情况都有所不同,所以鉴别二者对临床尤为重要。磁共振成像(magnetic resonance imaging,MRI)具有良好的软组织分辨率,并且可提供多序列、多参数图像,相较于超声和钼靶对乳腺EPC与BIDP能起到更关键的鉴别作用。由于乳腺EPC发病率低,并且先前的很多研究都集中在组织病理学特征上[5-7],本研究回顾并分析10例乳腺EPC和10例囊实性BIDP的临床资料、术前MRI表现及病理学特点,以期提高乳腺EPC术前诊断准确率。
1 资料和方法
1.1 研究对象
回顾并分析2014年6月—2019年10月于广东省人民医院就诊的乳腺EPC患者10例。患者均为女性,年龄47~83岁,平均65.5岁,均为偶然触及或体检时发现乳房肿物就诊。随机选取同期BIDP并且MRI检查为阳性的患者10例。年龄28~80岁,平均50.4岁,其中1例临床表现为合并乳头溢血,其余9例表现为单纯乳房肿物。纳入标准:① 经穿刺或手术后病理学检查证实的乳腺EPC和BIDP患者;② 患者穿刺或手术前均已行MRI检查。排除标准:图像质量欠佳或伪影严重,影响后处理。
1.2 MRI检查
1.2.1 检查设备与参数
10例EPC患者中,5例采用荷兰Philips公司的Achieva 1.5T磁共振系统进行扫描,5例采用美国GE公司1.5T磁共振系统进行扫描。10例BIDP患者中,5例采用荷兰Philips公司1.5T磁共振系统进行扫描,5例采用美国GE公司1.5T磁共振系统进行扫描。检查时患者取俯卧位,双乳自然下垂于乳腺专用线圈内。动态增强扫描均使用高压注射器,经肘静脉快速团注钆喷替酸葡甲胺(Gd-DTPA),剂量0.2 mL/kg、速率1.5 mL/s。按相同速率快速推注20 mL 0.9%的NaCl溶液。
Achieva 1.5T磁共振系统扫描序列如下:首先行常规T1WI和抑脂T2WI扫描。① T1WI,重复时间(repetition time,TR)为4.8 ms,回波时间(echo time,TE)为2.1 ms,视野(field of view,FOV)为300×320;② 抑脂T2WI,TR为3 400 ms,TE为90 ms,FOV为320×260。层厚为3.0 mm、层间距为0.3 mm。③ 动态增强扫描,注射对比剂后25 s开始第1次增强序列图像采集,共6期,采集时间60 s/期;扫描参数:TR为5.1 ms,TE为2.2 ms,FOV为300×320,层厚1.0 mm。④ 动态增强前行扩散加权成像(diffusion-weighted imaging,DWI)检查,b值分别为0、1 000 s/mm2。扫描参数:TR为5 065 ms,TE为66 ms,FOV为300×300,层间距为1.0 mm,层厚为5.0 mm。
GE 1.5T超导磁共振系统扫描序列如下:首先行常规T1WI和抑脂T2WI扫描。① T1WI,TR为5.8 ms,TE为2.7 ms,FOV为330×330,层厚为2 mm;② 抑脂T2WI,TR为8 700 ms,TE为102 ms,FOV为340×340,层厚为3.0 mm,层间距为0.3 mm。③ 动态增强扫描,注射对比剂后25 s开始第1次增强序列图像采集,共6期,采集时间75 s/期;扫描参数:TR为5.1 ms,TE为2.3 ms,FOV为320×320,层厚为1.2 mm。④ 动态增强前行DWI检查,b分别为0、1 000 s/mm2。扫描参数:TR为4 622 ms,TE为81.2 ms,FOV为340×340,层间距为1.0 mm,层厚为5.0 mm。
1.2.2 图像处理
动态增强扫描图像传至Philips及GE后处理工作站,并在病灶强化最明显处勾画感兴趣区(region of interest,ROI),获取时间-信号强度曲线(time-signal intensity curve,TIC),具体方法如下:在动态增强扫描的第1期图像上选取病灶强化最显著、最均匀处作为ROI,避开囊变及坏死区,测得病灶的TIC。TIC按其形状分为Ⅰ型(持续上升型)、Ⅱ型(平台型)和Ⅲ型(流出型)。利用b=0和1 000 s/mm2的DWI图像获取表观扩散系数(apparent diffusion coefficient,ADC)值,方法如下:在DWI图像上,对应动态增强图像强化最明显的区域,选取相应的高信号区作为ROI,在ADC图对应的位置上测量病灶的ADC值。
1.2.3 图像分析
由两名副主任医师及以上职称医师共同阅片,并达成一致意见。肉眼观察两组患者的病变位置(病变与乳头的距离<2 cm时,定义为乳晕后区[8])、病灶数、形态学特点(包括形状、边界)、病变分布情况及信号特点、内部强化特点及导管扩张与否(T1WI图像上,朝向乳头的索条样高信号影定义为导管扩张[9])。
1.3 病理学诊断
手术标本使用15%的缓冲福尔马林液固定,石蜡包埋。所有切片用H-E染色。应用常规光学显微镜检查评估肿瘤成分,确定主要肿瘤成分。由1名病理学副主任医师反复阅片并进行诊断,诊断标准参照2012版WHO乳腺肿瘤病理分类[10]。在免疫组织化学方面,对雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)蛋白、细胞角蛋白(cytokeratin,CK)5/6和p63进行检测。
1.4 统计学处理
应用R语言进行统计分析。分别对乳腺EPC及BIDP患者的年龄、MRI特征及定量参数ADC值进行统计。分类变量比较采用Fisher精确检验;连续变量采用成组资料t检验进行比较。P<0.05为差异有统计学意义。此外,由于乳腺EPC组有2例患者是在b=800 s/mm2的DWI图像上获取的ADC值,所以ADC值的统计排除此2例患者。
2 结 果
2.1 一般资料
本组乳腺EPC患者的平均发病年龄为(65.50±11.64)岁,BIDP的平均发病年龄为(50.40±14.12)岁,乳腺EPC组的平均发病年龄显著高于BIDP组,差异有统计学意义(P<0.05)。在临床表现上,两组患者的差异无统计学意义,乳腺EPC组临床均为发现乳房肿物就诊,且均不合并乳头溢液(血);BIDP组有1例患者合并乳头溢血。
2.2 病理学表现
乳腺EPC镜下表现为多发乳头状结构附着于纤维性包膜包裹形成的囊腔。瘤细胞呈乳头状、筛状、实性排列,可见轻中度异型及纤维血管轴心。本组乳腺EPC患者病变周围乳腺组织伴发低级别导管内原位癌(ductal carcinoma in situ,DCIS)或浸润癌5例。在免疫组织化学方面,CK5/6、P63为标记肿瘤周缘及乳头轴心肌上皮细胞的指标。8例患者CK5/6、P63均为阴性;1例患者CK5/6为阴性,P63在数个细胞上呈阳性;1例患者CK5/6、P63在个别细胞上呈阳性。对9例患者(除去1例免疫组织化学资料不全者)进行Luminal分型,其中7例为Luminal A型,2例为Luminal B型(HER2阴性)。
囊实性BIDP患者在镜下可见导管囊性扩张,上皮增生和纤维血管轴心构成了乳头状结构凸向管腔。部分伴导管上皮普通型增生(usual ductal hyperplasia,UDH)、旺炽型增生或不典型增生,本组BIDP患者伴上皮不典型增生2例,伴导管上皮普通型增生者5例,伴旺炽型增生1例。
2.3 MRI表现
10例乳腺EPC均为单发,仅1例位于乳晕后区;其中囊实性肿块8例(图1),实性部分呈乳头状或不规则状凸向囊腔;实性肿块2例,肿块信号较均匀。10例EPC病灶直径16~42 mm,平均(24.000±7.601)mm。10例EPC均为结节/肿块型,其中卵圆/分叶状5例,圆形4例,不规则形1例;边界光滑者3例,不规则者7例。病灶内出现液平3例(图1);合并导管扩张2例(图1)。实性部分抑脂T2WI呈高或稍高信号8例,等信号2例。实性部分TIC平台型(Ⅱ型)4例,流出型(Ⅲ型)6例(图1)。去除2例不符合条件的患者后,病灶ADC值范围为(0.79~1.34)×10-3mm2/s,平均ADC值为(1.114±0.204)×10-3mm2/s。
10例EPC患者中有5例在病变的周围乳腺组织中伴发DCIS或浸润癌,相较于不伴发的患者,在MRI上,此5例病变在边界及是否出现液平上征象一致,在病灶边界上均表现为不规则边界,此外病灶内均没有出现液平。
10例囊实性BIDP,有7例为单发病灶,病灶位于乳晕后区的有6例。10例BIDP病灶直径11~63 mm,平均(27.300±16.984)mm;其中5例有液平(图2);7例伴随导管扩张。实性部分抑脂T2WI信号,有8例为等或低信号(图2)。实性部分TIC平台型(Ⅱ型)7例,流出型(Ⅲ型)3例(图2)。病灶ADC值范围(1.01~1.47)×10-3mm2/s,平均ADC值为(1.238±0.161)×10-3mm2/s。
对比乳腺EPC与囊实性BIDP的MRI表现,两组患者在实性部分抑脂T2WI信号之间的差异有统计学意义(P=0.019),而在病变位置、病灶大小、病灶数、内部强化特点、有无液平以及导管是否扩张上的差异无统计学意义(P>0.05);两组患者间的TIC曲线类型及ADC值比较,差异也无统计学意义(P>0.05,表1)。
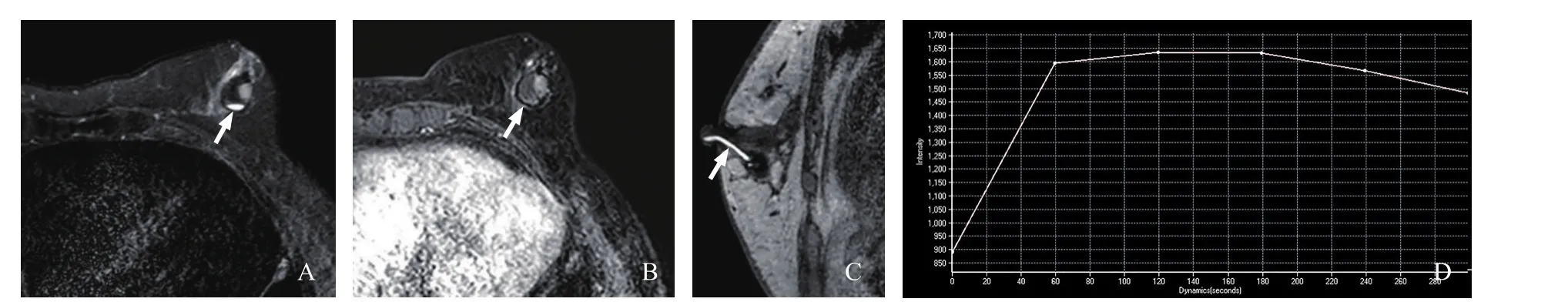
图1 典型病例1(患者,女性,78岁,EPC)影像图
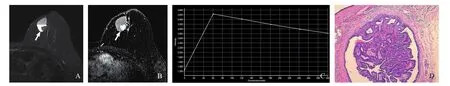
图2 典型病例2(患者,女性,47岁,BIDP)影像图及病理学表现
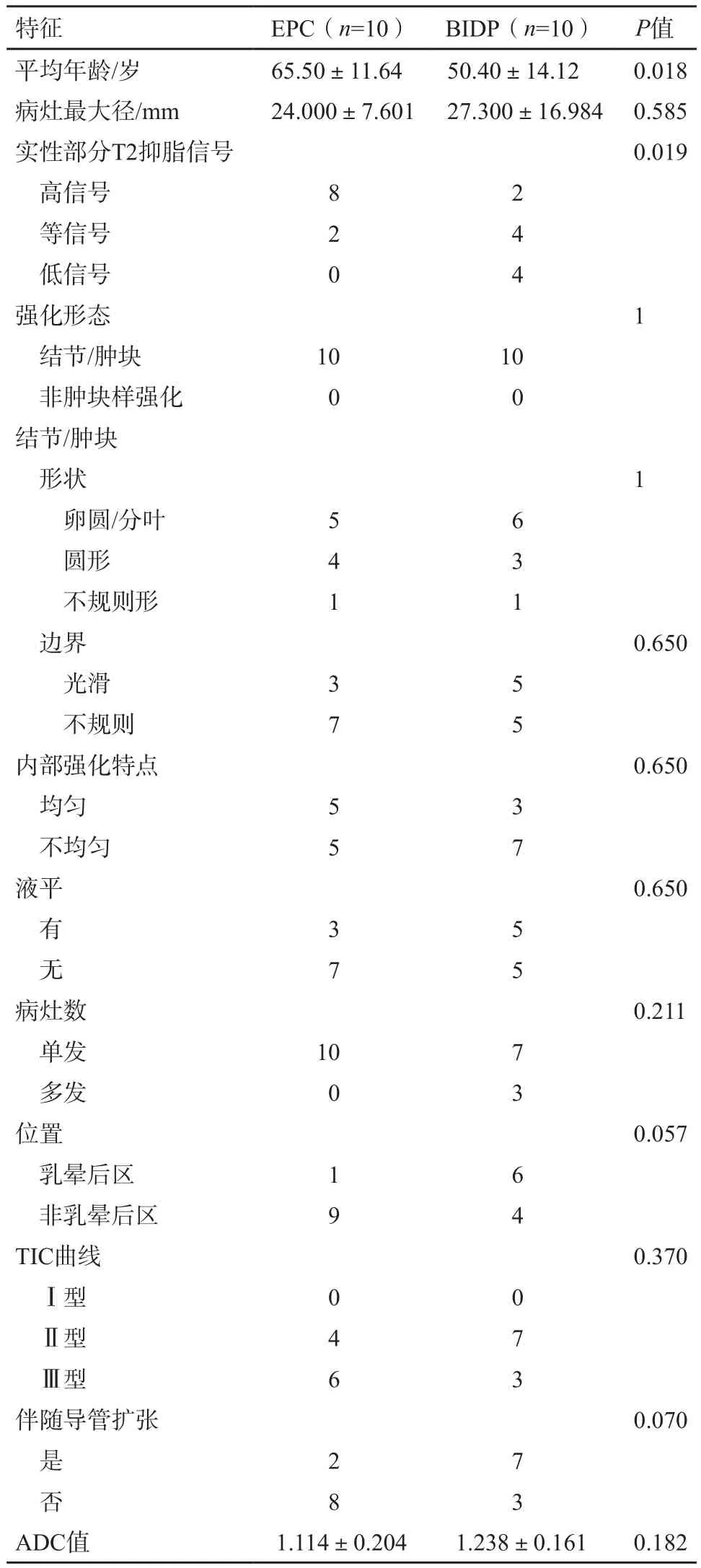
表1 EPC和囊实性BIDP的MR影像特征比较
3 讨 论
目前乳腺EPC被定义为乳腺乳头状病变中的一个亚群[2],发病率较低,表现为惰性的临床过程并具有良好的预后[1]。BIDP是起源于乳腺导管上皮的良性肿瘤,占乳腺良性病变的5.3%,可恶变。囊实性BIDP是Tominaga等[4]提出的一个新的分型,在BIDP患者中,呈囊实性表现者并不少见。
乳腺EPC在老年女性中更常见,发病的中位年龄约69.5岁[11],本研究入组10例患者,平均年龄为(65.50±11.64)岁。EPC主要发生在女性,但男性患者也有报告,有研究表明,与女性患者相似,男性乳腺EPC好发于老年人,且预后较好[12]。本研究中,所有的患者都是女性。BIDP好发于30~50岁的女性患者[13],本研究10例乳腺BIDP患者的平均年龄为50.4岁。乳腺EPC的发病年龄高于BIDP,所以发病年龄是两者很重要的鉴别点。乳腺EPC与BIDP在临床症状也有重叠,两者均可以乳房肿块为首发表现,合并导管扩张时可出现乳头溢液(血)。既往研究表明,72%的BIDP患者可出现乳头溢液(血)[4],而乳腺EPC则较少报道。本研究中,所有EPC患者临床均以发现乳房肿块就诊。10例BIDP患者有1例出现乳头溢血。
乳腺EPC与BIDP都是乳腺乳头状病变的亚型。大体上,乳腺EPC多表现为囊实性的肿块,实性肿块较少见,本组10例患者中有8例为囊实性肿块,肿块呈乳头状或不规则形的实性部分常以宽基底与囊壁相连。实性肿块呈圆形或卵圆形,边界可光滑或不规则。乳腺EPC切面常呈灰白或灰黄色,可见囊腔形成,囊内可有出血,本组10例患者有2例囊腔形成并伴出血。囊实性BIDP由囊性扩张的管腔和乳头状突起的肿瘤组成,在大体上的表现与EPC相似,鉴别较难[4]。在镜下及免疫组织化学方面,乳腺EPC的病理学特征是纤维包膜包裹的乳头状结构,肿瘤周缘及乳头轴心肌上皮细胞完全缺失或少量存在[5],在分型方面,大部分的乳腺EPC是ER阳性、PR阳性、HER2阴性的乳腺癌[14],说明乳腺EPC分化较好,本研究10例乳腺EPC中,有7例分子分型是Luminal A型,这与EPC的分化及预后良好相符。BIDP在2003年的WHO分类中被单独列出,定义为被覆于纤维血管茎上的上皮细胞和肌上皮细胞增生的树突状结构。因此与BIDP相比,肌上皮细胞完全缺失或少量存在是乳腺EPC重要的病理特点,CK5/6、P63是肌上皮的免疫组织化学标志物,本研究纳入的10例患者,免疫组织化学检测CK5/6、P63均为阴性或在个别细胞上呈阳性。
乳腺EPC和良性囊实性BIDP在MRI均可表现为囊实性的结构,在影像学上鉴别较为困难。本研究分析并总结了两者的MRI特点,发现实性部分T2WI抑脂信号可作为两者鉴别的影像特征。本研究大部分乳腺EPC实性部分在T2W抑脂相呈高或等信号,这与既往研究结论一致[13,15]。而大部分囊实性BIDP患者的实性部分在T2W抑脂相表现为等、低信号,以往也有研究显示,BIDP的乳头状部分相对于正常的腺体组织可以呈等信号[16],考虑这可能与BIDP的实性部分被覆的上皮出现不典型增生有关。乳腺EPC与囊实性BIDP实性部分在T2WI抑脂相上的差异,有助于二者的鉴别。在实性部分TIC曲线分型方面,乳腺EPC的肿瘤细胞增殖较快,并且纤维血管轴心的存在,使肿瘤血供较丰富,有学者研究发现,乳腺EPC实性部分的TIC曲线以Ⅲ型为主,这与组织病理学改变相符[13,17-19]。本研究乳腺EPC组患者,TIC曲线类型均为Ⅱ、Ⅲ型,以Ⅲ型为多(60%),与文献报道一致。既往很多研究表明,BIDP病灶的增强曲线表现多样,没有明确的特征性[3,20]。在以往BIDP与导管原位癌鉴别的研究中,认为TIC曲线类型对于两者的鉴别没有价值[21]。Tominaga等[4]报道8例囊实性BIDP实性部分的TIC曲线类型有6例表现为Ⅱ型,在本组BIDP患者中,TIC曲线均为Ⅱ、Ⅲ型,其中70%的病灶TIC曲线为Ⅱ型。乳腺EPC与囊实性BIDP在TIC曲线方面的差异无统计学意义,说明TIC曲线类型在临床上的确难以鉴别二者。另外,在实性部分的ADC值的比较方面,祁永红等[13]对9例乳腺EPC患者进行研究,9例患者的平均ADC值为(1.103±0.135)×10-3mm2/s;徐玮等[19]报道了15例EPC患者,平均ADC值为(1.14±0.27)×10-3mm2/s。本组10例EPC患者,平均ADC值为(1.114±0.204)×10-3mm2/s,与文献报道相符。本组BIDP患者与EPC患者间的ADC值差异无统计学意义,说明ADC值对二者的鉴别意义不大。
在治疗方式和预后方面,乳腺BIDP常随访观察或采用乳腺区段切除术,而有研究表明,乳腺EPC患者需要进行保乳手术,并且在术后进行放疗可降低早期复发率,使患者受益[22-23]。因而在MRI上准确鉴别二者,将有助于患者治疗方案的确定。
综上,乳腺EPC是一种预后较好的乳腺乳头状恶性病变,好发于老年女性,年龄通常较囊实性BIDP患者大。乳腺EPC实性部分在T2W抑脂相上常呈高或等信号,结合患者的年龄和MRI特征,有助于其与囊实性BIDP鉴别,并可为后续治疗方案的选择提供有力的佐证。
