大麦条纹病原菌的RAPD遗传多样性分析及大麦亲本抗性评价
2020-06-05侯静静何智宏司二静姚立蓉汪军成马占军李葆春孟亚雄马小乐王化俊
侯静静,何智宏,司二静,姚立蓉,汪军成,马占军,李葆春,4,杨 轲,孟亚雄,马小乐,王化俊
(1.甘肃省干旱生境作物学重点实验室/甘肃省作物遗传改良与种质创新重点实验室,兰州 730070;2.甘肃农业大学 农学院,兰州 730070;3.甘肃省林业科技推广总站,兰州 730046;4.甘肃农业大学 生命科学技术学院,兰州 730070)
大麦(Hordeum vulgare L.)是禾本科大麦属1a生草本植物,啤酒大麦是甘肃省优势特色产业[1]。大麦条纹病(Barley leaf stripe)是大麦的主要病害之一,在大麦种植区普遍发生[2-3]。国际范围内在地中海和北欧地区发病较为严重[4-5]。中国长江流域的沪、赣、浙、湘等地发病较重,病株死亡率高达30%~40%[6]。甘肃啤酒大麦和青稞的种植地同样发生该病害,发病严重时能造成10%~30%的减产[7]。由于耕作制度的变化以及多年的连茬种植,该病害发生日趋严重,对于该病原菌抗性研究显得尤为重要。现已得知,该病是由种子带菌引起的系统侵染性真菌病害,其病原菌的无性阶段为禾内脐蠕孢(Drechslera graminea(Rabenh &Schlecht)Schoemaker)[8],有性阶段为麦类核菌(Pyrenophora graminea)[9]。
运用分子标记技术研究该病原菌的遗传差异性,可以对大麦条纹病防治与抗性育种方面提供理论依据。分子标记技术包括许多类型,如IRAP、RAPD、RFLP、AFLP、SSR 等[10]。其 中RAPD(random amplified polymorphic DNA)技术是通过PCR(Polymerase Chain Reaction)扩增产物片段的多态性来揭示待测基因组DNA 的遗传多态性[11]。该技术的引物为随机多态单引物,且与模板配对稳定,其操作方便快捷,退火温度低等特点极大地提高了分析效率[12]。Jawhar等[13]对叙利亚地区不同地理来源的麦类核菌(P.graminea)进行RAPD 遗传多态性分析,结果得出不同地理来源菌株之间有明显差异性,表明RAPD可快捷准确地检测病原菌遗传多样性。Zein等[14]运用IRAP和ITS-RFLP 2种标记方法分析麦类核菌(P.graminea)的遗传多样性,得出2种标记方式均能很好地揭示多样性。Bayraktar等[15]研究表明,运用ISSR 分析可将供试的麦类核菌(P.graminea)菌株划分为4 个簇,用ITSRFLP分析结果显示菌株间无差异。在大麦条纹病抗性评价研究方面,Mueller等[16]在德国萨克森联邦州对620份大麦品种进行大麦条纹病的抗性鉴定,结果得出,超过186份品种在田间表现为抗性。
甘肃省的大麦种植区域广泛,河西走廊地区的生态环境多样,大麦条纹病原菌在该地区的遗传多样性及大麦亲本对该病菌的抗性尚未明确。因此本研究以河西地区的麦类核菌(P.gra-minea)为研究对象,运用RAPD 分子标记技术进行遗传多态性分析,采用“夹心法”鉴定大麦亲本材料对其抗性[17],以期为大麦条纹病病害的防控和抗性育种提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 20 个供试菌株于2009 和2012年采自河西走廊啤酒大麦种植区域,均采集于大麦条纹病发病植株的叶片部位,由甘肃农业大学麦类课题组保存并进行致病机理的研究。供试菌株信息如表1所示。
1.1.2 供试大麦品种 抗性评价的30份大麦品种由甘肃省干旱生境作物学重点实验室/甘肃省作物遗传改良与种质创新重点实验室提供,来自国内外不同大麦产区。
1.1.3 培养基的配制 使用的培养基为马铃薯葡 萄 糖 琼 脂 培 养 基(Potato Dextrose Agar,PDA),将新鲜马铃薯削皮去芽眼切成1cm2的小方块,称取重量200g,加1L蒸馏水煮沸20min,过滤去残渣,在滤液中加入20g葡萄糖和17g琼脂,玻璃棒搅拌混匀,加蒸馏水定容至1L,高压蒸汽灭菌。

表1 供试菌株信息Table 1 Information of Pyrenophora graminea
1.2 试验方法
1.2.1 菌株遗传多样性的RAPD 分析 参照真菌基因组DNA 提取方法来提取20 个供试麦类核菌(P.graminea)菌株基因组DNA[18]。用超微量分光光度计测定其OD230/OD260值,OD260/OD280值和浓度,用1%琼脂糖凝胶电泳进行检测,最终置于-20 ℃冰箱保存,备用。由华大基因公司(BGI)合成随机多态单引物[13,19]。
RAPD 扩增体系优化试验的引物为OPK3(序列:5′-CCAGCTTAGG-3′),DNA 模板为菌株SD,将 DNA 模 板 浓 度、2 × MasterMix(BIOTEKE,PR1701)添加量和循环数分别设置两个水平,30ng/μL和60ng/μL,5μL 和7μL,40和45(表2),PCR 反应程序如表3所示。扩增产物经GoldView Ⅱ(GV Ⅱ)染色,1.5%琼脂糖凝胶电泳分离,紫外光凝胶成像系统显像,拍照。
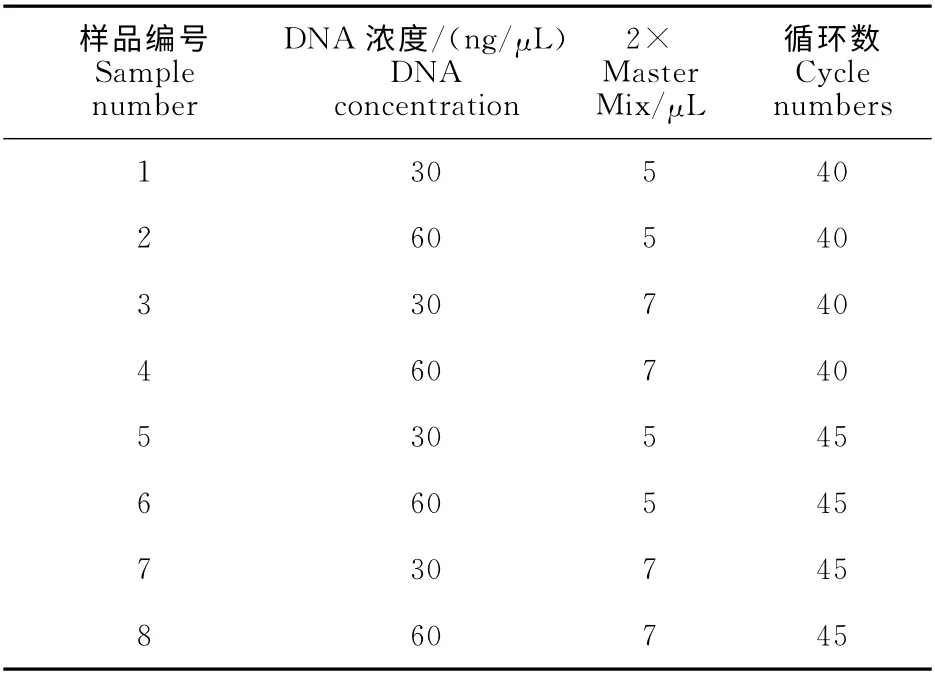
表2 RAPD优化设置Table 2 Optimal setting of RAPD

表3 扩增程序Table 3 PCR program
运用筛选出的多态单引物和优化后的扩增体系对20 个供试菌株基因组DNA 进行RAPDPCR 扩增和DNA 指纹图谱分析,将电泳结果DNA 图谱中的无条带DNA 记为0,有条带记为1,建立0,1型二元矩阵。各菌株间遗传相似性系数(Genetic Similarity,GS)的计算采用软件NTSYSpc 2.10e 完 成[20],聚 类 分 析 图 的 构 建 采 用UPGMA(Unweighted Pair Group Method with Arithmetic Mean)法[21]。
1.2.2 大麦亲本抗性评价 采用“夹心法”,以实验室前期鉴定出的大麦条纹病强致病性菌株QWC来接种侵染30 份供试大麦亲本材料[22]。首先进行大麦种子预处理,将种子置于200 mL锥形瓶,加入φ=70%酒精震荡30s,移除上清,加入无菌水,震荡后吸除,重复3次,再加入φ=5%次氯酸钠震荡5min,除上清,加入无菌水,震荡去上清,重复3次,然后将种子置于无菌滤纸上吸干水分,接着将处理后的种子放置于PDA 菌丝平板上,最后,在种子上层覆盖一层同样的PDA 菌丝平板,菌丝面接触种子。
试验以大麦种子置于空白PDA 平板培养基间作为对照,每个大麦品种设置30粒种子。4 ℃黑暗生化培养箱中侵染生长20d,然后移栽至花盆中。培养条件为12h(光照)/12h(黑暗),温度为20℃(光照)/12℃(黑暗),湿度为40%的环境中生长。观察大麦发病情况,统计感病率。参考Pecchioni等[23]方法进行大麦条纹病抗性等级评价:高感(HS):感病率>40%;感病(S):感病率15%~40%;抗病(R):感病率5%~15%;高抗(HR):感病率<5%;免疫(I):感病率=0%。
2 结果与分析
2.1 RAPD 扩增体系优化
如图1所示,在10μL的反应体系中,当变量仅为DNA 模板浓度时,30ng/μL和60ng/μL两个水平的扩增结果无显著差异,如1和2,3和4,5和6,7和8号泳道两两对比所得;当变量为扩增循环数时,40和45的扩增结果同样差异不明显,如1和5,2和6,3和7,4和8号泳道两两对比所示;但是5μL 和7μL 的2×MasterMix对扩增结果有较大差异,泳道1和3,2和4,5和7,6和8号两两对比可以看出,5μL较7μL的扩增条带清晰,且在1 000bp到2 000bp间多出两条条带。鉴于此,本试验的RAPD-PCR 扩增反应体系为:1μL 引物(10μmol/L),1μL DNA 模板(30ng/μL),5μL的2×MasterMix(BIOTEKE,PR1701),加ddH2O 至10μL。PCR 反应循环参数如表3 所示。扩增产物经GoldView Ⅱ(GVⅡ)染色,1%琼脂糖凝胶电泳分离,拍照。

图1 PCR 体系优化的扩增结果Fig.1 Amplification results of optimized PCR system
2.2 RAPD图谱和聚类分析
筛选出30对具有多态性且条带清晰的随机单引物(表4)进行RAPD-PCR 试验,共获得63条多态性条带,总条带数为138条,多态性条带数占总条带数的45.65%。其中引物S2082,S61,S9,S6和S1的多态性比率均为100%,引物S82的多态性比率最小,为12.50%。

表4 RAPD分析引物序列和多态性条带Table 4 Sequence of primers and number of polymorphic fragments obtained by RAPD analysis
采用UPGMA 法构建分子系统发育树,结果显示(图2):菌株HZ 和QWC、菌株QQ 和SW之间的遗传相似系数(GS)均为0.936 5,为20个供试菌株间遗传相似性最高,且它们地理位置各不相同,分别在武威市、兰州市、张掖市和金昌市,其次是来自金昌市的菌株SSB和CJZ间的GS为0.921 6。菌株YC 的遗传相似性系数(GS)为0.624 1,采自金昌市永昌县,在供试菌株间最小,与其余19个菌株间的遗传差异较大,次之是武威市黄羊河镇的菌株HYH,遗传相似性系数(GS)为0.674 1。供试的20 个不同地区麦类核菌(P.graminea)间的遗传相似系数(GS)范围为0.624 1~0.936 5,在遗传相似系数为0.716 6时可将20个菌株划分为4类,菌株XTB和JT 为一类,且这两个菌株的地理位置相隔较远,前者在张掖市,后者在白银市,GS最小的菌株YC 单独为一类,次小的菌株HYH 独自为一类,剩余16个菌株聚为一类,其中,菌株TB 与其他15个菌株差异较大,GS 为0.748 1 时菌株SS、CH、SD、GL、DQ、QZ和SSS聚在一起,剩余8个菌株聚在一起。综上可得不同地理来源的麦类核菌(P.graminea)菌株间存有一定的遗传差异性。
如图3所示,试验中20个菌株间遗传距离为0.052 3~0.819 1,图中数值与对角相应的方格颜色相一致。可以看出,菌株TB 和YC 间的遗传距离最大,对应方格颜色为深蓝色,说明这两个不同地理位置菌株之间的亲缘关系最远,分别采自武威市头坝村和金昌市永昌县。菌株QQ 和菌株SW 的遗传距离最小,对应方格颜色为深红色,说明两菌株亲缘关系最近,遗传差异较小,采自张掖市清泉镇和金昌市双湾镇。在供试的20个不同地区菌株中,菌株SW 和QWC,菌株HZZ 和SW,菌株SSB 和HZ 之间的地理位置均相隔较远,但遗传距离均较小,仅有0.069 9、0.065 3和0.088 0。菌株JT 和SSS,菌株YC 和XSB 的地理位置较接近,但遗传距离较大,分别为0.438 3和0.633 0。同时也存在地理位置接近遗传距离小和地理位置远遗传距离大的菌株,例如菌株CJZ和SW,菌株XTB 和YC,遗传距离分别为0.078 0和0.607 9,得出地理位置间的远近差异与菌株遗传距离的大小无显著相关性。

图2 基于RAPD分析的20个菌株间遗传相似系数的UPGMA法聚类图Fig.2 Phylogenetic tree constructed by UPGMA of similarity index matrix among 20tested isolates based on RAPD analysis

图3 基于RAPD分析的20个菌株之间的遗传距离Fig.3 Ggenetic distance of 20strains based on RAPD markers
2.3 大麦亲本抗性评价
用甘肃农业大学农学院麦类实验室前期筛选到的强致病性麦类核菌(P.graminea)菌株QWC对30个大麦材料进行苗期抗大麦条纹病鉴定(表5)[22]。试验未筛选出免疫(I)及高抗品种(HR),筛选得到抗病品种(R)为5 个,分别为‘J04970’‘Z200V038V’‘Z1450008W’‘Z1’和‘甘啤6 号’,均具有一定的抗病能力,感病率为5%~15%,在30份供试品种中占到16.67%;品种 ‘P002-3’‘2039040Q’‘TRADITION’‘Z040P111Q’‘Isotta’和‘Z02751407’的感病率均>40%,属于高感品种(HS),占供试品种数的20%;其余19个感病品种(S)的感病率不尽相同,抗大麦条纹病能力存在一定差异性,感病率介于15%~40%。在供试的30份大麦亲本材料中,抗病性结果表现出较大差异,品种‘甘啤6号’感病率为10.84%,对菌株QWC 的抗性最好,品种 ‘Isotta’的抗病能力最差,感病率达到73.53%。

表5 大麦亲本抗性鉴定Table 5 Resistant identification of barley varieties
3 讨论与结论
3.1 不同地理位置菌株遗传多样性分析
Jawhar等[13]和 郑 果[24]采 用RAPD 分 子 标记技术研究麦类核菌(P.graminea)菌株的遗传多样性时,筛选到的RAPD 多态性引物分别只有2条和9 条,本试验筛选出30 对多态性引物,RAPD 引物筛选的越多,不同地理位置麦类核菌的遗传差异性表现越明显。在Bakonyi等[25]的相关研究中,遗传相似系数(GS)为0.868 0~0.976 0,本试验中GS为0.624 1~0.936 5,与之相比范围更广,更好地揭示了麦类核菌(P.graminea)菌株间遗传差异性。
通过优化后的RAPD 扩增体系进行试验,共获得63条多态性条带。在遗传相似系数(GS)为0.716 6时将供试的20个菌株划分为4类,其中菌株HZ和QWC、菌株QQ 和SW 之间的遗传相似系数(GS)均为0.936 5,20个供试菌株间遗传相似性最高,且它们地理位置各不相同,但共同聚为一类。菌株SW 和QWC,菌株HZZ和SW,菌株SSB和HZ之间的地理位置均相隔较远,但遗传距离均较小,仅有0.069 9、0.065 3和0.088 0。同时也存在地理位置接近遗传距离小和地理位置远遗传距离大的菌株,例如菌株CJZ和SW,菌株XTB和YC。因此得出不同地区所分离的麦类核菌菌株间亲缘关系的远近与地理差异无明显相关性,与司二静等[22]运用ISSR 方法分析结果相一致。李登辉等利用8 对AFLP 选择性引物组合对19份麦类核菌进行多态性扩增,试验菌株划分为4个类群,相似系数(GS)为0.83,同样得出菌株间遗传距离的远近与其地理分布无明显规律[26]。
综合RAPD 分析结果得出甘肃河西地区麦类核菌菌株间有较大遗传差异,但菌株遗传特性与地理分布区域无明显相关性。菌株间之所以存在较大遗传差异,推测可能与河西不同地区的海拔、光照、温度、湿度等环境因素造成的遗传变异有关。条纹病菌株遗传特性与地理位置无明显相关性,可能与大麦条纹病的是种传病害的特性有关,其病原菌-麦类核菌(P.graminea)的菌丝不存在胚中,它在果皮薄壁细胞之间的种子中存活,在果壳和种皮中生长[27-28],不同地理位置所分离的麦类核菌聚为一类的原因可能是种子带菌传播所致。
3.2 大麦亲本抗性评价
本试验采用强致病性菌株QWC 鉴定30 个大麦品种的苗期抗病性,结果表明,同一麦类核菌(P.graminea)菌株侵染不同大麦亲本材料,大麦条纹病抗性差异较大,与Bayraktar等[15]的相关研究结果相似。本研究中,鉴定筛选出6份高感品种、19份感病品种和5 份抗病品种,抗大麦条纹病品种分别为‘1J04970’‘甘啤6 号’‘Z200V038V’‘Z1450008W’和‘Z1’。所有供试材料中,‘甘啤6 号’感病率为10.84%,对菌株QWC 的抗性最好,‘Isotta’的抗病能力最差,感病率达到73.53%,共同组成大麦条纹病的抗感组合。Mueller等[16]采用自然侵染和“夹心法”侵染两种方式鉴定610份大麦材料的大麦条纹病抗性,发 现 品 种‘HOR 333’‘HOR 11475’‘OU J362’和‘BGRC 5592’在两种方式中都显示出抗性。吴宽然[29]鉴定115份大麦品种的抗性,得到抗性品种31 份、中抗24 份、中感54 份、高感7份,其中二棱品种的平均感病率较六棱品种高。张万霞等[30]鉴定191份大麦材料,抗条纹病品种89份,其中‘单2’‘单6’和‘Harrington’农艺性状优良,具有较好的利用前景。孙立军等[31]筛选优异大麦种质资源,发现国内‘豫大麦1号’‘东阳三月黄’‘乌米大麦’等品种,国外‘Konal’‘ZF2262’‘岗12’等品种对大麦条纹病都具有良好抗性。本试验未筛选到免疫及高抗品种,可能由于试验品种数量较少,菌株类型单一,后期将选择较多大麦品种材料和强致病性菌株进行抗性鉴定,筛选出更加优良的大麦条纹病抗感品种组合,为大麦条纹病病害的防控,抗性育种及病原菌研究奠定基础。
