肉鸡盲肠微生物群落特征与体质量的相关性
2020-06-05艾佐佐饶友生柴学文詹怡昕
罗 雯,艾佐佐,饶友生,柴学文,詹怡昕
(1.南昌师范学院 生物系,南昌330032;2.地方鸡种遗传改良省级重点实验室/南昌师范学院生物技术研究所,南昌330032)
家禽肠道菌群在个体的营养消化吸收及生长发育方面起重要作用,个体生长速度的差异与肠道菌群组成之间存在一定关联。体质量相关细菌的鉴定与调节是调控体质量的策略之一,它可能是提高禽畜生产效率的有效策略。
利用高通量测序技术对肠道微生物的研究表明,肠道微生物区系对宿主的代谢和生理[1],血管生成[2],肥胖[3-4],免疫功能[5-7]和大脑发育[8]等均有影响。在过去的十几年里,较多研究关注了人类和小鼠肠道微生物菌群与体质量之间的关系,相对而言,针对家禽肠道微生物区系的相关研究较少。通过研究经多代选择获得的高体质量和低体质 量 肉 鸡 系[9],或 高 脂 和 低 脂 肉 鸡 系[10],证 明宿主遗传背景对肠道微生物有显著影响,且肠道微生物参与宿主代谢,宿主和肠道菌群在基因水平的相互作用导致二者的协同进化。韩国学者以罗斯308雄性肉鸡为研究对象[11-12],证明体质量不同的肉鸡肠道菌群结构有显著差异,但显著差异的微生物类群却不尽相同。Lee等[11]研究揭示,低体质量雄性肉鸡盲肠中,厚壁菌门的梭菌属显著增加;而与高体质量显著相关的盲肠菌群包括变形菌门克罗诺菌属以及厚壁菌门的3个属。Han等[12]对试验结果进行线性回归分析的结果表明,在门的水平上,回肠中广古菌门和螺旋体菌门微生物与肉鸡体质量呈正相关,属水平上甲烷短杆菌属和双歧杆菌属与肉鸡体质量正相关;而盲肠的分析结果只显示门水平上与体质量负相关的是疣微菌门和黏胶球形菌门,此外在属的水平上,回肠和盲肠中疣微菌门阿克曼氏菌与肉鸡体质量呈负相关。
禽类肠道菌群的研究揭示[13-14],肠道微生物的组成受宿主遗传因素影响,不仅种间,甚至品种间也有明显差异[15]。虽已发现肉鸡长势不同,其肠道菌群组成也有差异,但至今获得的结果仍存在分歧,因此还需开展更多研究。宁都黄鸡是中国小型优质肉鸡的宝贵地方品种资源,利用高通量测序技术对宁都黄鸡个体生长与肠道菌群相关性的系统研究尚未见报道。本试验对笼养宁都黄公鸡盲肠菌群16SrDNA 基因进行扩增子测序分析,探究个体生长速度差异与宿主盲肠微生物多样性及组成的相关性。
1 材料与方法
1.1 试验动物及样品采集
1.1.1 试验动物 种蛋来源于赣州市宁都县惠大集团宁都黄鸡原种厂,饲养试验在“江西省地方鸡种遗传改良重点实验室”家禽分子遗传育种实践基地(江西省南昌市南昌县武阳镇)进行。试验起点为1 日龄雏鸡苗,初始体质量平均32g,试验群体为200 羽宁都黄公鸡,全程笼养育雏。饲料采用漓源饲料厂的全价料(0~6周龄育雏料,7~10周龄育成料,均无抗生素添加),自由采食与饮水。日粮营养标准见表1。
1.1.2 试验样品采集 在饲养至10周龄时称体质量,根据体质量由高至低以等差方式分为个体数量相等的4 组,分别为极高体质量组(L43)、次高体质量组(L33)、次低体质量组(L23)和极低体质量组(L13),每组随机抽取10羽带回实验室进行后续试验。各组公鸡体质量见表2。当天无菌采集盲肠内容物,立即冷冻于-70 ℃冰箱,备用。

表1 日粮营养标准Table 1 Dietary nutrition standard

表2 肉鸡体质量分布Table 2 Body mass distribution of broiler chickens
1.2 盲肠内容物基因组DNA 的提取与测序
采用QIAamp 快速粪便DNA 提取试剂盒(QIAampFast DNA Stool Mini kit,Qiagen),根据试剂盒操作说明,提取盲肠内容物基因组DNA 样品。每组10个生物学重复,样本重复提取3份,每份样本粪便用量约0.2g。以提取的基因组DNA 为模板,采用16SrRNA 基因V3~V4高变区通用引物扩增16SrRNA V3~V4基因,引 物 序 列 为:341F:5′-CCTAYGGGRBGCASCAG-3′,806R:5′-GGACTACNNGGGTATCTAAT-3′。扩增程序:98 ℃变性1min,扩增30 个循环(98 ℃,10s;50 ℃,30s;72 ℃,30s),72 ℃延伸5min。用20g/L琼脂糖凝胶电泳分离扩增产物,对目的条带使用Thermo Scientific公司的GeneJET 胶回收试剂盒纯化。使用TruSeq○R DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,合格文库使用HiSeq2500PE250进行上机测序,由北京诺禾致源生物信息科技有限公司协助完成。
1.3 微生物群落分析
在97%的相似水平下对有效数据进行操作分类单元(Operational Taxonomic Units,OTUs)的聚类,并做物种注释。使用MUSCLE[16](Version 3.8.31,http://www.drive5.com/muscle/)软件得到所有OTUs代表序列的系统发生关系。对各样品的数据进行均一化处理,后续Alpha多样性分析基于均一化处理后的数据。
使用Qiime软件(Version 1.7.0)计算Alpha多样性指数Chaol(http://scikit-bio.org/docs/latest/generated/generated/skbio.diversity.alpha.chao1.html# skbio.diversity.alpha.chao1)、Shannon(http://scikit-bio.org/docs/latest/generated/generated/skbio.diversity.alpha.shannon.html#skbio.diversity.alpha.shannon)、Simpson (http://scikit-bio.org/docs/latest/generated/generated/skbio.diversity.alpha.simpson.html#skbio.diversity.alpha.simpson)、样品覆盖率(http://scikit-bio.org/docs/latest/generated/generated/skbio.diversity.alpha.goods_coverage.html#skbio.diversity.alpha.goods_coverage)。使用R 软件(Version 2.15.3)绘制稀释曲线。
基于物种注释结果,绘制物种相对丰度柱形图和物种丰度聚类热图,获得门和属两个分类水平的物种分布和丰度差异信息。
软件分析由北京诺禾致源生物信息科技有限公司协助完成。
1.4 组间差异细菌特征分析
使用LEfSe软件进行线性判别分析效应大小(LEfSe,LDA Effect Size)检测,将对数线性判别分析(LDA)评分阈值设为2,在LDA 评分计算过程中进行Kruskal-Wallis秩和统计检验,分析获得在组与组之间具有统计学差异的生物标识(Biomarker)[17]。
1.5 数据统计分析
采用SPSS 19.0对试验数据进行处理,采用单因素ANOVA 分析组间差异,数据以“平均数±标准差”表示,显著水平α=0.05,P<0.05认为具有统计学意义。
2 结果与分析
2.1 高通量测序数据统计
对4组宁都黄鸡盲肠内容物基因组DNA 进行测序分析,各组样品有效序列与OTU 数量见表3。单因素ANOVA 分析结果显示,有效序列数和OTU 数量在组间无显著差异(P<0.05)。从样品中随机抽取一定测序量的数据,统计它们所代表的OTUs,构建稀释曲线(图1)。各组样品随机抽取的数据量达到30 000以上时,曲线已趋向平坦,说明测序数据量渐进合理,更多的数据量只会产生少量新的物种(OTUs),试验测序量足以覆盖各样品的大多数微生物。

表3 各组样品有效序列与OTU 数量统计Table 3 Effective tags and OTU numbers of different groups
图1 各组样品的稀释曲线Fig.1 Rarefaction curve of each group
2.2 宁都黄鸡盲肠菌群多样性分析
对4 组样本的多样性指数(Shannon、Simpson)、丰富度指数(Chao1)和测序深度指数(样品覆盖率)进行分析(均一化时选取的数据量:cutoff=33 236),结果见表4。单因素ANOVA 分析结果显示,Alpha多样性指数Chaol值、Shannon指数和Simpson 指数在组间无显著差异(P <0.05)。
另外,Shannon指数曲线揭示,当样品测序数量超过5 500时,各组曲线已趋向平坦(图2),结合稀释曲线特征,进一步说明测序数据量充足,可反映样本中绝大多数的微生物信息,获得的菌群分析结果是合理且充分的。

表4 样本多样性分析Table 4 Diversity analysis of samples

图2 各组样品的Shannon指数曲线Fig.2 Shannon index curve of each group
2.3 宁都黄鸡盲肠微生物菌群组成分析
对4 组宁都黄鸡盲肠内容物微生物16S rRNA 基因V3~V4区序列进行高通量测序,共鉴定出18个菌门,30个纲,51个目,84个科,179个属和109种微生物。在盲肠细菌群落中,有3个菌门共占比90%以上,分别是拟杆菌门(Bacteroidetes)、厚 壁 菌 门(Firmicutes)和 变 形 菌 门(Proteobacteria)。其中丰度最高的是拟杆菌门,其 次 是 厚 壁 菌 门。此 外,L 4 3组 广 古 菌 门(Eur yarchaeota)占比7.55%;L23 组疣微菌 门(Verrucomicrobia)占比2.82%,螺旋体门(Spirochaetes)占比1.77%,互养菌门(Synergistetes)占比1.22%;L13组互养菌门占比1.75%。各组肠道微生物门水平排名前10的菌群相对丰度见图3。单因素ANOVA 分析结果显示,变形菌门、广古菌门、螺旋体门、脱铁杆菌门(Deferribacteres)、迷踪菌门(Elusimicrobia)丰度组间差异显著(P<0.05)。
在属分类水平上,各组样本中丰度最高的是拟杆菌门理研菌科(Rikenellaceae)RC9 gut group,占比16.94%~20.89%;其次是拟杆菌属(Bacteroides),占比8.59%~14.80%。L13、L23和L33组的第三优势属都是变形菌门脱硫弧菌属(Desulfovibrio),丰度分别是7.04%、6.14%和5.80%;该属在L43组为第四优势属,占比4.14%。L43 组的第三优势属是广古菌门甲烷短杆菌属(Methanobrevibacter),占比7.48%,但该菌属在其他3 组占比均不足1%。各组肠道细菌属水平排名前10的菌群相对丰度见图4。单因素ANOVA 分析结果显示,拟杆菌属、甲烷短杆菌属、脱硫弧菌属、栖粪杆菌属(Faecalibacterium)、Ruminiclostridium 9 的 丰度组间差异显著(P<0.05)。
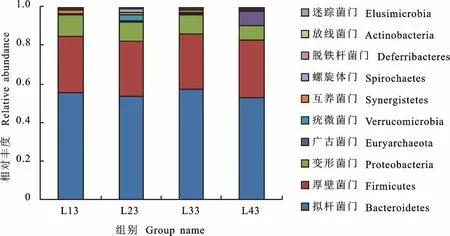
图3 各组样品门水平菌群相对丰度Fig.3 Relative abundance of microbial communities at phylum level of each group
虽然宁都黄鸡不同体质量组盲肠微生物群落组成具有明显的相似性,但相对丰度却有差异。根据所有样品在门和属水平的物种注释及丰度信息,选取丰度排名前10的门或属,根据其在每个样品中的丰度信息,从物种和样品两个层面进行聚类,绘制成热图(图5)。由图显示,在门水平上,广古菌门丰度与体质量正相关;而互养菌门和脱铁杆菌门菌群丰度则与体质量负相关;属水平上,与体质量呈正相关的为甲烷短杆菌属、栖粪杆菌属;脱硫弧菌属、互养菌属(Synergistes)则与体质量呈负相关。
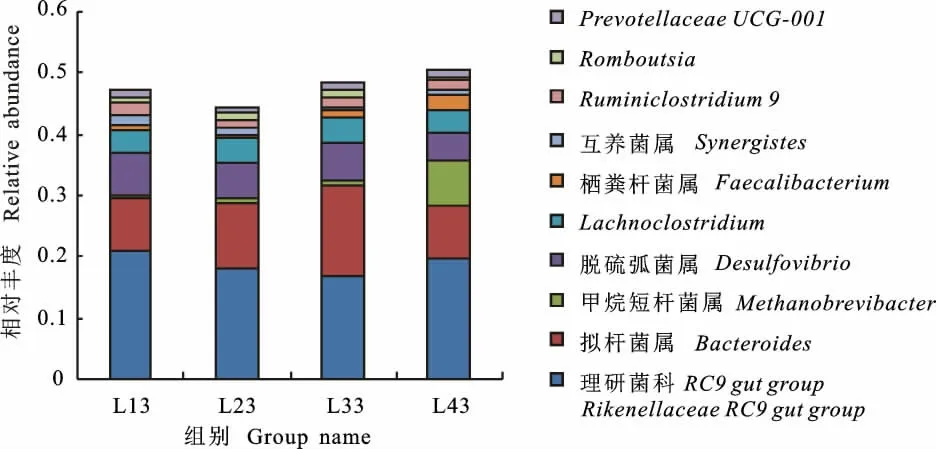
图4 各组样品属水平菌群相对丰度Fig.4 Relative abundance of microbial communities at genus level of each group

图5 样品微生物门(A)或属(B)水平丰度聚类热图Fig.5 Microbial community heatmap analysis at phylum(A)or genus(B)level
2.4 不同体质量组间差异菌群特征分析
LEfSe分析强调统计意义和生物相关性,通过LEfSe算法进行组间微生物差异分析。根据LDA 值的大小判断差异菌群的影响大小。LDA值大于2的组间具有统计学差异(P<0.05)的生物标识中,与极高体质量组和极低体质量组相关的部分生物标识丰度变化在4个体质量组间呈现明显规律性。与体质量增长正相关的是,门水平上的广古菌门;属水平上包括,广古菌门的甲烷短杆菌属、厚壁菌门瘤胃菌科5个属(栖粪杆菌属、UCG 005、NK4A214group、UCG 013和Eubacterium coprostanoligenes group)、拟杆菌门另枝菌属(Alistipes);种水平上,Methanobrevibacter woesei的丰度从极低体质量组的0.11%逐渐增至极高体质量组的7.49%,唾液乳杆菌(Lactobacillus salivarius)丰度从极低体质量组的0.02%逐渐增至极高体质量组的0.09%。与体质量增长负相关的是互养菌门和脱铁杆菌门;属水平上包括互养菌门互养菌属、变形菌门脱硫弧菌属和嗜胆菌属(Bilophila)、脱铁杆菌门穆齐螺旋菌属(Mucispirillum)、厚壁菌门3 个属(巨球型菌属--Megasphaera、瘤胃菌科UCG_004和Eubacterium nodatum group);种水平上,Mucispirillum schaedleri 丰度从极低体质量组的0.36%逐渐下降到极高体质量组的0.09%,产气荚膜梭菌(Clostridium perfringens)从极低体质量组的0.009%至极高体质量组未检测出,脱硫弧菌属的bacterium New Zealand D 丰度从极低体质量组的1.15%逐渐下降到极高体质量组的0.38%。
与体质量增长正或负相关生物标识中相对丰度>1%的19 个生物标识信息见表5。在这19个生物标识中,种(或属)水平上的生物标识在不同组中丰度比较见图6。相对丰度低于1%的生物标识未逐一列出。

表5 基于LEfSe分析的不同体质量雄性宁都黄鸡盲肠细菌群落差异Table 5 Cecal bacterial community differences of male Ningdu Huang chickens with different body mass based on Linear Discriminant Analysis Effect Size(LEfSe)
3 讨 论
动物肠道内存在一个复杂而庞大的微生物群落,它在许多方面影响着宿主的健康和生长[3,18]。为进一步了解肠道微生物菌群在肉鸡生长过程中发挥的作用,本研究以宁都黄鸡为试验对象,将饲养10周的公鸡按照体质量分组,分析不同体质量组盲肠微生物的组成特点。
3.1 不同体质量宁都黄鸡盲肠菌群丰度和多样性比较

图6 生物标识组间丰度比较图Fig.6 Comparative graph of relative abundance of biomarkers among groups
多项研究显示肠道微生物多样性与宿主体质量 增长呈负相 关[3,12,19]。针 对 鱼 类 的 研 究 显 示 生长缓慢组的鱼肠道菌群丰富度和多样性都显著高于正常组,推测该变化源于健康状况下生长被抑制的菌群过度繁殖[20]。但在本研究中,按体质量递增划分的4组样本,虽然体质量差别已经超过80%,其盲肠微生物丰富度和多样性却无显著差异,可见,肠道微生物的多样性并非与体质量增长速率必然相关,可能仅是在特定健康状况下的一种变化。
3.2 门和属水平上不同体质量宁都黄鸡盲肠菌群组成特征
对鸡肠道微生物16SrDNA 测序结果的分析表明[13,21-22],门水平上丰度较高的是厚壁菌门、拟杆菌门和变形菌门(>90%),对宁都黄鸡盲肠菌群的研究获得类似结果,差别在于丰度最高的是拟杆菌门,而非其他研究[22-24]结论中的厚壁菌门。属水平上,已有报道揭示梭状芽孢杆菌、瘤胃球菌、乳杆菌和拟杆菌属是鸡肠道的主要菌群[21-22];但本研究结果却存在较大差异,各体质量组丰度最高的是理研菌科RC9gut group,其次是拟杆菌属,而梭状芽孢杆菌属和乳杆菌属占比较低。在试验中出现这些差异的原因可能主要与饲料成分有关。已有研究报道[25],饲料成分影响到鸡消化道的微生物群,特别是在消化道下段,高纤维和低脂饮食增加了拟杆菌门的数量,而低纤维和高脂肪饮食则增加了鸡消化道微生物群中厚壁菌门的数量。
3.3 不同体质量宁都黄鸡盲肠差异菌群
虽有部分研究[9-12]分析了肉鸡体质量差异与肠道菌群之间的相关性,但分析获得的相关微生物类群却各不相同。在已有同类研究中,大多只设 置 体 质 量 显 著 不 同 的2 个 组[9-10,12]或3 个组[11]。本研究设置体质量逐级变化的4个组,在菌群差异分析时,不仅考虑分组两两比较时菌群丰度的变化,也兼顾4个体质量组间菌群差异是否同样呈现规律性变化,有助于准确判断菌群丰度变化是否和体质量变化相关联。
本研究结果显示,广古菌门菌群丰度与体质量增长正相关,在针对罗斯308 肉鸡的研究中[12],回肠部分析得出相同结论。对体质量增长影响最大的属是广古菌门的甲烷短杆菌属,在动物肠道中,它们是主要的产甲烷菌,并有助于纤维素的消化[26]。本次测序分析结果显示,甲烷短杆菌属的Methanobrevibacter woesei是影响体质量变化的主要菌种,其丰度从极低体质量组的0.11%显著增至极高体质量组的7.49%,该菌种已在大鼠和家禽肠道分离获得[26-27],并被证明是鸡盲肠产甲烷菌中的优势种[28]。结合本次研究和其他分析结果[12]发现,当饲料成分为高纤维低脂型,该属细菌则表现出与体质量增长正相关;而使用同样肉鸡品种,饲料改为低纤维高脂型时,就没有检测到该菌群与高体质量组的相关性[11]。因此,推测在使用高纤维低脂型饲料时,该属细菌对饲料的消化吸收起到显著促进作用,因而促进体质量的增加。
在属水平上,与本研究结果相似,栖粪杆菌属和另枝菌属与高体质量肉鸡的相关性在罗斯308肉鸡研究中也有报道[11]。栖粪杆菌属是一类丁酸产生菌[29],另枝菌属则可以发酵产生乙酸[30]、琥珀酸[31],哺乳动物试验表明,这些短链脂肪酸(尤其是丁酸盐),可作为小肠上皮细胞的重要能源[32],并通过促进细胞分化、促进紧密连接或上调胰高血糖素基因在肠道L 细胞中的表达来改善肠道屏障功能[31]。此外,另枝菌属还具有产生纤溶酶和消化明胶的能力[30]。因此,这两个菌群可能通过改善肠道功能促进消化吸收,进而促进肉鸡的生长。
虽然在本研究中对体质量影响最大的负相关菌群是变形菌门脱硫弧菌属,但在其他研究中却认为该菌群属于有益菌[30,33],因为脱硫弧菌在鸡的盲肠生态系统中充当氢库的角色,而氢会抑制短链脂肪酸的产生。哺乳动物肠道菌群研究的结果却有所不同,由于该菌群是内毒素产生菌,且可以将硫酸盐还原成硫化物,对上皮细胞产生毒性,并且是溃疡性结肠炎的病因之一[34-35],因此被认为是有害菌群[36]。虽然关于脱硫弧菌对肠道功能的影响依然存在争议,但本研究再次验证了该菌群对肉鸡生长的不利影响。
综上分析,虽然需要对微生物群与体质量之间的关系进行更多的研究,但这些细菌群可用于改善肉鸡的生长性能。另外,通过功能推断分析,对不同细菌类群的代谢过程深入了解,可能扩展对鸡消化道微生物群的认识。
4 结 论
日龄相同而体质量显著差异的宁都黄鸡盲肠菌群丰富度及多样性无显著差异,但菌群结构存在显著差异。广古菌门甲烷短杆菌属和厚壁菌门栖粪杆菌属菌群丰度与体质量正相关,且对宁都黄鸡生长起到主要促进作用。其中,甲烷短杆菌属的Methanobrevibacter woesei可能是促进宁都黄鸡生长的主要菌群之一。属水平上,对体质量产生主要影响的负相关菌群是变形菌门脱硫弧菌属和互养菌门互养菌属。其中,脱硫弧菌属Bacterium New Zealand D 菌在盲肠内丰度的增加可能导致宁都黄鸡生长减缓。
