CXCR2在膀胱癌干细胞增殖、凋亡及侵袭转移中的作用及机制
2020-06-05李顺来姜亭起马天加
李顺来,姜亭起,马天加
1济南市第五人民医院,济南250022;2山东大学第二医院
膀胱癌是最常见的泌尿系统恶性肿瘤,其中以膀胱尿路上皮癌所占比例最大。虽然放化疗以及靶向药物的应用改善了早期膀胱癌患者的预后,但对于中晚期患者而言,肿瘤复发转移率高,预后仍然较差;此外,化疗耐药也是导致膀胱癌治疗效果不理想的另一个重要原因。研究证实,肿瘤干细胞是肿瘤复发转移以及耐药的主要原因[1],然而其具体机制尚未完全阐明。探讨膀胱癌干细胞在膀胱癌复发、转移中的机制,对于降低中晚期患者的复发转移率、改善预后极为重要。趋化因子受体2(CXCR2)是趋化因子受体家族中的一员,是CXC阳性趋化因子的公共受体[2]。CXCR2在肾癌、乳腺癌以及胰腺癌等肿瘤中均出现差异表达,且通过调控肿瘤细胞增殖、血管形成等促进肿瘤细胞的侵袭、转移[3]。近年研究显示,CXCR2在肿瘤干细胞的增殖以及侵袭、转移中亦起着关键调控作用[4]。2017年10月~2019年2月,我们从膀胱癌组织中提取、培养肿瘤干细胞,采用慢病毒技术沉默干细胞中CXCR2基因的表达,观察其对细胞增殖、侵袭、转移能力的影响,并分析其作用机制。
1 材料与方法
1.1 膀胱癌干细胞的组织来源 收集1例膀胱尿路上皮癌患者的新鲜肿瘤组织。纳入标准:①首次手术经病理证实为膀胱尿路上皮癌;②术前未接受过放化疗以及内分泌治疗;③除膀胱癌以外,无其他恶性肿瘤病史;④无肝肾功能障碍以及传染病史。本研究经济南市第五人民医院伦理委员会审核通过,患者签署知情同意书。
1.2 膀胱癌干细胞的分离鉴定与CXCR2蛋白检测 将新鲜肿瘤组织置于超净工作台内,去除脂肪、血管等非肿瘤组织,用眼科剪将肿瘤组织剪碎,加入1 mg/mL Ⅳ型胶原酶,37 ℃摇床上消化2 h。加入含10%胎牛血清的DMEM/F12完全培养基终止消化,用70 μm孔径的细胞筛网过滤,2 000 r/min离心5 min,弃上清。加入含有表皮生长因子和碱性成纤维细胞生长因子的无血清培养基,倒置显微镜下观察,2周左右开始形成悬浮细胞球,采用流式细胞仪分选CD44+膀胱癌干细胞,其余细胞标注为CD44-细胞,接种于无血清培养基中扩大培养。采用Western blotting法检测CD44+与CD44-细胞的干细胞标志基因Oct4、Sox2蛋白表达,并检测CXCR2蛋白表达。
1.3 膀胱癌干细胞的培养与分组、转染 取对数生长期细胞,接种至6 cm培养皿中。将细胞分为sh-CXCR2组和sh-scramble组,sh-CXCR2组加入慢病毒转染试剂polybrene与CXCR2敲减慢病毒sh-scramble组加入慢病毒转染试剂polybrene与对照scramble按照转染说明书操作。置于37 ℃培养箱中培养8 h后,更换新的培养基继续培养。
1.4 膀胱癌干细胞增殖能力观察 采用MTS法。取对数生长期细胞,0.25%胰酶消化,制成单细胞悬液,以2×103/孔接种于96孔板中。将细胞分为sh-CXCR2组和转染对照组,每组设6个复孔。按照“1.3”方法进行慢病毒转染,转染72 h后,每孔更换150 μL新鲜培养基并加入30 μL MTS工作液,在37 ℃细胞培养箱中孵育2 h后,酶标扫描仪490 nm波长处测定吸光度值,细胞增殖率=实验组OD值/对照组OD值×100%。实验重复3次。
1.5 膀胱癌干细胞克隆形成能力观察 采用软琼脂克隆形成实验。1.2%琼脂糖高温高压灭菌后放入42 ℃水浴中,加入等体积无血清培养基混匀,取2 mL琼脂糖与无血清培养基混合液均匀铺至6 cm培养皿中做为底层胶,放置4 ℃冰箱中冷却至固态。按照“1.3”的方法对膀胱癌细胞进行分组、转染。将2 mL高温灭菌后的0.6%琼脂糖与无血清培养基等体积混匀做为上层胶,取转染72 h的膀胱癌干细胞以3×104/孔、100 μL培养基与37 ℃预热的上层胶充分混匀,铺至固态的底层胶上,置于细胞培养箱中培养14~16 d,显微镜下观察,计数克隆球的形成数目并拍照。
1.6 膀胱癌干细胞凋亡率测算 细胞转染72 h后,加入无EDTA的胰酶消化。PBS洗3次,按照说明书分别加入Binding Buffer、7-ADD、Annexin Ⅴ-APC染液。枪头吹吸混匀后避光孵育10~15 min,流式细胞仪检测细胞凋亡率。实验重复3次。
1.7 膀胱癌干细胞转移能力观察 采用Transwell转移实验。细胞转染72 h后,加入无EDTA的胰酶消化制成单细胞悬液,聚碳酸酯微孔膜(孔径8 μm)分布于运动小室和侵袭小室的上下室之间,下室加入500 μL含体积分数为10%胎牛血清的完全培养基,上室加入5×104个细胞,37 ℃培养箱孵育6 h。显微镜观察下室有明显细胞时终止实验,取出聚碳酸酯微孔膜,中性甲醛固定,苏木精染色。光镜下观察穿膜细胞数,随机计数5个视野取平均值。
1.8 膀胱癌干细胞侵袭能力观察 采用Boyden侵袭实验。将“1.7”中的聚碳酸酯微孔膜侵袭小室滤膜上包被人工基底胶,其余步骤同上。
1.9 膀胱癌干细胞抗凋亡相关蛋白FOXO1A、Bcl-2及侵袭转移相关蛋白MMP-2、MMP-9表达检测 采用Western blotting法。细胞转染72 h后,加入RIPA细胞裂解液裂解,用蛋白提取试剂盒提取细胞总蛋白,BCA法测定蛋白浓度。加入上样缓冲液,煮沸后-20 ℃保存备用。SDS-聚丙烯酰胺凝胶电泳,湿转法将电泳产物转移到PVDF膜,8%脱脂奶粉封闭3 h。分别加入FOXO1A、Bcl-2、MMP-2、MMP-9一抗(稀释浓度均为1∶500)孵育过夜,加入兔二抗和鼠二抗(稀释浓度均为1∶8 000)孵育2 h,TBST洗涤3次,化学发光底物曝光条带,Image J软件分析条带光密度。以GAPDH作为内参,以目的蛋白与GAPDH光密度比值表示目的蛋白的相对表达量。

2 结果
2.1 膀胱癌干细胞的筛选鉴定结果及CXCR2蛋白表达情况 经流式细胞仪筛选出的CD44+膀胱癌干细胞约占全部细胞的2.37%。CD44+膀胱癌干细胞中Oct4、Sox2、CXCR2蛋白表达均高于CD44-细胞(P均<0.05),见表1。
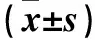
表1 CD44+与CD44-膀胱癌干细胞中Oct4、Sox2、CXCR2蛋白表达比较
注:与CD44-细胞比较,#P<0.05。
2.2 两组细胞增殖率比较 sh-CXCR2组细胞增殖率为100%±1.54%,转染对照组为48.41%±2.11%,sh-CXCR2组细胞增殖率低于转染对照组(P<0.05)。
2.3 两组克隆形成能力比较 转染对照组克隆球形成数目为(23.47±1.97)个,sh-CXCR2组为(6.36±1.21)个,sh-CXCR2组克隆球形成数目少于转染对照组(P<0.05)。
2.4 两组细胞凋亡率比较 sh-CXCR2组细胞凋亡率为7.41%±0.24%,转染对照组为0.87%±0.18%,sh-CXCR2组细胞凋亡率高于转染对照组(P<0.05)。
2.5 两组细胞侵袭、转移能力比较 Transwell实验结果显示,sh-CXCR2组穿膜细胞数为(33.17±5.48)个,转染对照组为(249.38±9.57)个,sh-CXCR2组少于转染对照组(P<0.05)。Boyden实验结果显示,sh-CXCR2组穿膜细胞数为(53.18±8.21)个,转染对照组为(153.12±11.26)个,sh-CXCR2组少于转染对照组(P<0.05)。
2.6 两组细胞FOXO1A、Bcl-2、MMP-2、MMP-9蛋白表达比较 见表2。
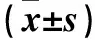
表2 两组细胞中FOXO1A、Bcl-2、MMP-2、MMP-9蛋白表达比较
3 讨论
膀胱癌包括肌层浸润性膀胱癌、非肌层浸润性膀胱癌以及转移性膀胱癌,3类膀胱癌的治疗手段和预后均相差甚远。早期非肌层浸润性膀胱癌多采用经尿道膀胱肿瘤切除术后膀胱内灌注化疗,而对于肌层浸润以及转移性膀胱癌多采用全膀胱切除术联合化疗治疗,但其复发率、转移率较高,预后极差[5]。研究显示,膀胱癌患者术后复发率高达48%~70%,且将近半数患者术后会发生恶性进展或远处转移[6],给膀胱癌的治疗带来了极大的挑战。新近研究发现,肿瘤干细胞是导致肿瘤复发和转移的主要原因[7]。肿瘤干细胞具有很强的自我更新和持续增殖能力,且具有多项分化潜能,在肿瘤细胞增殖、侵袭转移中起重要作用。肿瘤干细胞的存在是肿瘤无法根治的关键因素,阐明肿瘤干细胞致癌的具体机制将为肿瘤治疗提供新的策略。有学者发现,膀胱癌中存在膀胱癌干细胞[8],但其在膀胱癌发病中的作用及机制尚不明确。
CXCR2编码基因位于2q35,由约350个氨基酸组成,属于G蛋白偶联受体。其结构域包含有胞内端与胞外端,N末端位于胞外端,是趋化因子配体结合区;C末端位于胞内端,是将胞外信号活化并继续向下传递的关键区域[9]。近年研究发现,CXCR2在肿瘤细胞增殖、侵袭、转移中具有重要的调节作用。Ignacio等[10]报道,CXCR2可通过调控P21抑制肿瘤细胞凋亡,促进肿瘤细胞增殖。Cui等[11]报道,CXCR2可通过调控上皮间质转化促进肿瘤细胞的侵袭转移能力。Huang等[12]报道,CXCR2可增强肾癌细胞的干样特性。Wang等[13]认为,CXCR2可能是一个新的干细胞标记物,CXCR2可通过CXCR2-Src-PKL/Vav2-Rac1促进间充质干细胞向内皮细胞迁移[14],推测CXCR2可能通过调控膀胱癌干细胞的增殖、侵袭、转移而促进膀胱癌的复发、转移。本研究采用原代培养技术分离CD44+膀胱癌干细胞,采用Western blotting法检测发现CXCR2在膀胱癌干细胞中呈高表达。为了进一步研究CXCR2在膀胱癌复发、转移中的作用,我们将慢病毒转染试剂polybrene与CXCR2敲减慢病毒转染至膀胱癌干细胞中,观察沉默CXCR2基因表达对细胞增殖、侵袭、转移能力的影响,结果显示,sh-CXCR2组细胞增殖能力显著降低,细胞凋亡率显著升高,侵袭、转移能力明显减弱。表明CXCR2可以促进膀胱癌干细胞增殖以及侵袭转移。
最新研究发现,CXCR2可通过调控细胞周期相关蛋白如CDK4、CDK6促进细胞周期进程,通过调控凋亡相关蛋白Bcl-2抑制细胞凋亡[15]。Bcl-2是重要的抗凋亡基因,Bcl-2凋亡信号通路是线粒体途径引发的细胞凋亡,在细胞凋亡过程中起着关键调控作用。细胞凋亡信号经胞质传递至线粒体,并通过BH结构域与线粒体膜上的Bcl-2蛋白结合,降低Bcl-2的抗凋亡作用[16]。FOXO1A是叉头转录因子FOX家族的重要一员,参与调控细胞氧化应激、DNA损伤以及细胞凋亡等多种生物学过程。FOXO1A是Bcl-2上游的调节因子,CXCR2可能是通过FOXO1A/Bcl-2通路,调控细胞凋亡进程促进恶性肿瘤的发生与发展。本研究结果显示,沉默CXCR2基因表达后,sh-CXCR2组FOXO1A、Bcl-2蛋白表达均降低。提示CXCR2可通过调控FOXO1A通路抑制膀胱癌干细胞凋亡,促进其增殖。
MMP-2和MMP-9属于MMP家族成员,其主要作用是降解细胞外基质。与其他MMP相比,MMP-2催化区含有半胱氨酸嵌入物,在与胶原蛋白以及弹力蛋白结合过程中发挥关键作用。MMP-9位于20q11.1~13.1上,其含有一个O-糖基化的胶原蛋白V样嵌入物,促进MMP-9与血红素样区结合。目前研究已经证实,MMP-2以及MMP-9在肿瘤细胞的生长、侵袭、转移、肿瘤血管形成以及免疫调节等过程中均起着重要作用。本研究结果显示,沉默CXCR2基因表达后,sh-CXCR2组MMP-2、MMP-9表达均降低。提示CXCR2可通过调控MMP-2、MMP-9的表达促进细胞侵袭、转移。
综上所述,CXCR2在膀胱癌干细胞中呈高表达,沉默其表达可以降低膀胱癌干细胞的增殖、侵袭、转移能力,促进细胞凋亡,其机制可能是通过作用于凋亡相关蛋白FOXO1A、Bcl-2,调控凋亡通路进而促进肿瘤生长,通过调控侵袭转移相关蛋白MMP-2、MMP-9的表达进而调控细胞的侵袭转移。该研究为治疗膀胱癌提供了新的策略,CXCR2可能成为膀胱癌治疗的潜在靶点。
