miR-142-5p靶向调控TOP2A基因对前列腺癌细胞增殖和侵袭的影响
2020-06-05朱延杰尤平洪唐良友段晓波张姚代庆德吕东
朱延杰,尤平洪,唐良友,段晓波,张姚,代庆德,吕东
1德阳市人民医院,四川德阳618000;2四川省人民医院(东院)
前列腺癌是男性常见的恶性肿瘤之一。2018年的癌症统计数据显示,世界范围内有超过130万例新发前列腺癌病例和35.9万例相关死亡病例[1]。尽管在治疗效率方面取得了巨大进展,但前列腺癌患者的长期生存情况仍然不佳[2]。分子靶向治疗是肿瘤治疗的新型手段,在分子水平研究前列腺癌的发病机制有助于寻找对应的靶标,提高前列腺癌的治疗效果。已有研究证实,微小RNA(miRNA)在肿瘤的发生发展中发挥关键作用[3]。miR-142-5p对人体免疫调节具有重要作用,在乳腺癌、骨肉瘤和胰腺癌等恶性肿瘤中miR-142-5p呈异常表达,参与调控肿瘤细胞的增殖、凋亡、侵袭和转移等恶性生物学行为[4~6]。拓扑异构酶Ⅱα(TOP2A)在多种肿瘤中报道为癌基因,促进肿瘤的恶性进展[7,8]。Wnt/β-catenin信号通路与包括前列腺癌等肿瘤的恶进展密切相关,可作为抗肿瘤治疗的靶点[9]。本研究通过验证miR-142-5p与TOP2A的靶向关系,并观察miR-142-5p过表达对前列腺癌LNCaP细胞增殖和侵袭能力的影响,分析其潜在的作用机制,旨在获得miR-142-5p作为治疗前列腺癌候选靶点的证据。
1 材料与方法
1.1 材料来源 选择2017年1月~2018年6月在德阳市人民医院行手术切除的前列腺癌患者40例,年龄47~81(58.96±18.42)岁。本研究经本院医学伦理委员会审核通过,由患者或其家属签署知情同意书。
1.2 前列腺癌组织中miR-142-5p、TOP2A mRNA表达检测 收集手术切除的前列腺癌组织,加入TRIzol试剂提取总RNA,反转录合成cDNA。以其为扩增模板,按照SYBR Premix EX TaqTMⅡ试剂盒,采用7500 qPCR仪进行扩增。设计合成miR-142-5p引物上游5′-GGCCCATAAAGTAGAAAGC-3′,下游5′-TTTGGCACTAGCACATT-3′。U6引物上游5′-TGCGGGTGCTCGCTTCGGCA-3′,下游5′-CCAGTGCAGGGTCCGAGGT-3′。TOP2A引物上游5′-ACCATTGCAGCCTGTAAATGA-3′,下游5′-GGGCGGAGCAAAATATGTTCC-3′。GAPDH引物上游5′-CTGGGCTACACTGAGCACC-3′,下游5′-AAGTGGTCGTTGAGGGCAATG-3′。反应条件:95 ℃ 5 s,95 ℃ 5 s、70 ℃ 30 s,共40个循环。检测各样品的循环阈值(Ct),采用2-ΔΔCt法进行计算,以U6为内参计算miR-142-5p相对表达量,GAPDH为内参计算TOP2A mRNA相对表达量。
1.3 miR-142-5p靶向调控TOP2A的验证 前列腺癌LNCaP细胞复苏后,重悬至含有10% FBS的DMEM培养基中,置于37 ℃、5% CO2培养箱中培养。使用TargetScan7.1软件(http://www.targetscan.org/)预测miR-142-5p的靶基因。取生长状态良好的LNCaP细胞,以4×103/孔接种到96孔板中,分为NC wt、miR-142-5p wt和NC mut、miR-142-5p mut组。接种24 h后采用lipofectamine2000进行质粒转染,NC wt组转染TOP2A-wt和NC,miR-142-5p wt转染TOP2A-wt和miR-142-5p mimic,NC mut转染TOP2A-mut和NC,miR-142-5p mut组转染TOP2A-mut+miR-142-5p mimic,6 h后换液。收集转染48 h的各组细胞,根据双荧光素酶报道基因检测试剂盒检测各组细胞荧光素酶活性。
1.4 细胞分组与转染 取生长状态良好的LNCaP细胞,按2×105/孔接种至6孔板中,分为正常对照组、转染对照组和TOP2A过表达组。接种24 h后采用lipofectamine2000进行质粒转染,正常对照组转染NC质粒、转染对照组转染miR-142-5p mimic、TOP2A过表达组转染miR-142-5p mimic和TOP2A过表达质粒,6 h换液。转染48 h后,PBS洗3次,胰酶消化收集细胞斑块,加入TRIzol试剂提取细胞总RNA,采用qPCR方法检测正常对照组、转染对照组和TOP2A过表达组TOP2A表达,评价质粒转染效果达到实验所需要求。
1.5 细胞增殖能力观察 采用MTS实验。取三组细胞,按2×103/孔接种至96孔板中,分为正常对照组、转染对照组和TOP2A过表达组,每组设置6个复孔。接种24 h后采用lipofectamine2000进行各组质粒的转染,6 h换液。转染48 h时弃掉培养基,加入100 μL培养基和20 μL MTS,设置空白对照孔,37 ℃、5% CO2培养箱中孵育2 h。采用酶标仪于490 nm处检测吸光度(OD)值。细胞增殖率=(实验孔-空白孔)OD值/(对照孔-空白孔)OD值×100%。
1.6 细胞侵袭能力观察 采用Boyden实验。取三组细胞,PBS冲洗,加入无血清培养基,调整细胞密度为4×105/mL。取100 μL细胞悬液加到侵袭小室上室的Boyden基质胶上,下室加入500 μL含10% FBS培养基。培养12 h后,PBS洗去上室未穿膜的细胞,下室穿膜的细胞经甲醇固定15 min、结晶紫染色10 min,PBS冲洗后干燥,在显微镜下拍照,计数穿膜细胞数。
1.7 细胞Wnt/β-catenin信号通路蛋白表达检测 采用Western blotting法。取三组细胞,加入裂解液提取总蛋白,BCA法检测蛋白浓度。加入上样缓冲液煮沸变性,SDS-PAGE凝胶上样后80 V电泳2 h分离目的蛋白,350 mA湿转2 h将蛋白转至PVDF膜上,5% BSA室温孵育1 h,封闭PVDF膜上非特异性蛋白,加入Wnt3a、β-catenin一抗(稀释比例均为1∶500)和内参一抗(稀释比例为1∶1 000),4 ℃孵育过夜。洗膜,加入兔二抗(稀释比例为1∶8 000)室温孵育3 h,洗膜。用ECL试剂盒曝光蛋白条带。用Image J软件进行灰度值分析,以GAPDH为参照,计算Wnt3a、β-catenin目的蛋白的相对表达量。

2 结果
2.1 前列腺癌组织中miR-142-5p、TOP2A mRNA表达比较 前列腺癌组织中miR-142-5p表达水平为0.72±0.38,癌旁组织为1.00±0.36,前列腺癌组织中miR-142-5p表达下调(t=6.15,P=0.000)。前列腺癌组织中TOP2A mRNA表达水平为1.62±0.58,癌旁组织为1.00±0.31,前列腺癌组织中TOP2A mRNA表达上调(t=3.73,P=0.000)。Pearson相关分析显示,前列腺癌组织中miR-142-5p与TOP2A mRNA表达呈负相关(r=-0.601,P=0.024)。
2.2 miR-142-5p对TOP2A mRNA的靶向调控作用 TargetScan7.1软件在线预测显示,TOP2A基因启动子区与miR-142-5p具有结合位点,见表1。双荧光素酶报告基因试验结果显示,与NC wt组相比,miR-142-5p wt组荧光素酶活性降低(P<0.05);而NC mut组与miR-142-5p mut组比较差异无统计学意义(P>0.05),见表2。

表1 TOP2A mRNA与miR-142-5p结合位点预测结果
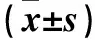
表2 各组细胞中荧光素酶活性比较
注:与NC wt组比较,*P<0.05。
2.3 三组细胞增殖能力比较 正常对照组、转染对照组和TOP2A过表达组的细胞增殖率分别为100%±1.00%、37.35%±6.35%、54.68%±3.06%。与正常对照组相比,转染对照组和TOP2A过表达组细胞增殖率降低;与转染对照组相比,TOP2A过表达组细胞增殖率升高(P均<0.05)。2.4 三组细胞侵袭能力比较 正常对照组、转染对照组和TOP2A过表达组的穿膜细胞数分别为(78.39±11.65)、(30.12±5.28)、(55.07±8.34)个。与正常对照组相比,转染对照组和TOP2A过表达组的细胞穿膜数减少;与转染对照组相比,TOP2A过表达组细胞穿膜数增加(P均<0.05)。
2.5 三组细胞Wnt3a、β-catenin蛋白表达比较 与正常对照组相比,转染对照组和TOP2A过表达组Wnt3a、β-catenin蛋白表达降低;与转染对照组相比,TOP2A过表达组Wnt3a、β-catenin蛋白表达增加(P均<0.05)。见表3。
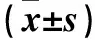
表3 三组Wnt3a、β-catenin蛋白表达比较
注:与正常对照组相比,*P<0.05;与转染对照组相比,#P<0.05。
3 讨论
目前前列腺癌的标准疗法是手术和放疗,但手术或放疗者仍有约8.4%的复发率[10]。由于前列腺癌症状具有隐匿性,患者确诊时多为晚期,雄激素剥夺治疗虽然可减轻70%~80%患者的症状,但大多数患者将在2年内复发至无法治愈的雄激素非依赖状态[11]。此外,晚期患者最常发生骨转移,严重影响患者的生存质量和预后。因此研究前列腺癌治疗的药物靶点至关重要。
前列腺癌的发生发展涉及癌基因和抑癌基因的失控及表观遗传学的改变。miRNA是内源性单链非编码RNA,长度为19~22个核苷酸,在转录后水平调控靶基因的表达。miRNA参与了干细胞发育、自噬、转化、增殖控制、细胞分化、细胞周期、细胞凋亡等多种细胞生理过程[12],同时miRNA的异常表达与肿瘤进展密切相关,使其成为肿瘤预后、诊断潜在标志物和治疗靶点[3]。miR-142是少数造血系统特异性miRNA之一,以miR-142-3p和miR-142-5p两种成熟同工型形式存在,miR-142-5p主要表达在胸腺来源的调节性T细胞中[13]。miR-142-5p在肿瘤的发生发展中也发挥重要作用,miR-142-5p在乳腺癌细胞中表达增加,具有促进肿瘤细胞增殖和侵袭的作用[4]。而miR-142-5p在骨肉瘤和胰腺癌中低表达,具有抑制肿瘤细胞增殖和促进细胞凋亡的作用[5,6]。这表明miR-142-5p依据不同的肿瘤类型,既可以发挥致癌又可以发挥抑癌作用。miRNA通过与靶基因mRNA的3′-UTR区部分互补结合来调节转录后的沉默,研究报道miR-142-5p确定的调控靶基因包括PTEN、PLA2G16和RAP1A等[4~6]。本研究采用生物学信息预测软件和双荧光素酶报道基因试验发现TOP2A基因启动子区与miR-142-5p有结合位点,是miR-142-5p的靶基因。
TOP2A是一种必需的核酶,在转录过程中调节DNA的拓扑状态,并参与染色体浓缩和染色单体分离[14]。研究报道,TOP2A高表达预示着各种人类癌症的不良预后[7,8]。我们推测,miR-142-5p和TOP2A在前列腺癌的发生发展过程中具有重要作用。本研究结果显示,前列腺癌组织中miR-142-5p低表达,TOP2A mRNA高表达,二者呈负相关;过表达miR-142-5p能够抑制前列腺癌细胞的增殖和侵袭能力。这表明miR-142-5p在前列腺癌中发挥抑癌作用,与其在骨肉瘤[5]和胰腺癌[6]中的作用相同。进一步研究显示,增加的TOP2A可显著减弱miR-142-5p对前列腺癌细胞增殖和侵袭的抑制作用,表明miR-142-5p通过靶向TOP2A抑制前列腺癌的恶性进展。
此外,Wnt/β-catenin信号通路与肿瘤增殖和侵袭密切相关,在前列腺癌中处于激活状态;Wnt3a和β-catenin是该通路的关键蛋白,在前列腺癌中高表达,促进肿瘤恶性进展[9]。本研究结果显示,miR-142-5p能够抑制前列腺癌细胞中Wnt3a、β-catenin蛋白表达,而TOP2A能够减弱miR-142-5p对前列腺癌细胞中Wnt3a、β-catenin蛋白的抑制作用。表明miR-142-5p靶向TOP2A抑制Wnt/β-catenin信号通路。
综上所述,前列腺癌组织中miR-142-5p表达降低,TOP2A表达降低增加,二者呈负相关;miR-142-5p靶向调控TOP2A基因抑制前列腺癌的进展,可能通过使Wnt/β-catenin信号通路失活。
