肺动脉高压发病机制及有氧运动干预对其改善的分子机制研究进展
2020-06-05滑艺杰王友华
滑艺杰,王友华
肺动脉高压(pulmonary arterial hypertension,PAH)作为心血管疾病中的“恶性肿瘤”,其典型病理发展特征为肺血管收缩/舒张功能障碍进而导致肺及肺血管压力增高,伴有肺实质纤维化和血管重构,首先是导致右心室代偿性肥大,而后进入失代偿期引起心壁应激性张力增大右心室超负荷,心腔扩大,继发左心室衰竭并诱导死亡(图 1)(Fayyaz et al.,2018)。目前PAH患者正在以每年10万左右的速度增长,美国国立卫生研究院(National Institutes of Health,NIH)报道PAH患者的自然生存期仅为2.8年。尽管在2018年第6次世界肺动脉高压会议上提出,利用蛋白组学等可转为精准治疗的治疗手段,并从遗传学、表观遗传学、DNA损伤、生长因子、代谢、炎症和免疫调节、雌激素信号、氧化和缺氧应激等方面总结了新型药物的作用方向,但依旧无法给出治疗PAH的特效药(Galiè et al.,2018;Morrell et al.,2018;Sitbon et al.,2019;Vonk Noordegraaf et al.,2018)。

图1 PAH及其并发症Figure 1. Pulmonary Arterial Hypertension and Complications
国内外学者对PAH进行了深入研究,采用转基因动物模型探讨PAH的机制并寻求有效干预靶点逆转PAH病理症状(Sitbon et al.,2015;Zhang et al.,2014)。研究表明,PAH对机体造成损伤的机理同肺动脉内质网应激(endoplasmic reticulum stress,ERS)水平增加、线粒体过度自噬及代谢紊乱密切相关(Koyama et al.,2014;Nogueira-Ferreira et al.,2018)。因此,寻找调节ERS、线粒体自噬、代谢紊乱的有效靶点,可在分子层面为PAH治疗提供重要的理论依据。
基础研究和临床研究已证实,有氧运动干预可降低PAH病理程度(Nogueira-Ferreira et al.,2018;Weinstein et al.,2013),有氧运动干预能显著改善患者的生活质量,一定程度上延缓患者的生存期。有研究表明,有氧运动可调节PAH下肺血管组织和心脏线粒体自噬、ERS和代谢水平改善PAH病理程度(Nogueira-Ferreira et al.,2018),但具体机制仍不完全清楚。有氧运动作为一种重要的非药物治疗手段,在疾病预防和治疗上均具有十分重要的临床意义,因此,深入研究有氧运动在PAH中的作用机理十分重要。
1 PAH的治疗进展
PAH的临床治疗手段十分丰富,但所带来的效益却十分有限,其中传统治疗方式运用较广泛,包括一般措施治疗、支持治疗、靶向药物治疗和手术治疗。支持治疗方式包括使用抗凝药物、利尿剂和吸氧等手段缓解症状。靶向性药物普遍应用的有前列环素、内皮素受体拮抗剂、5-磷酸二脂抑制剂和Rho激酶抑制物等。随着人们对PAH的进一步深入研究,新的治疗方式也随之出现——基因治疗、离子通道治疗、免疫调节治疗、细胞治疗和表观遗传学治疗。同时,在动物水平发现了一些全新的靶点有望成为治疗PAH的全新方向,如鸟苷酸环化酶激活剂、线粒体调节剂、抗炎和免疫调节剂、酪氨酸激酶抑制剂等(Cohen-Kaminsky et al.,2014;Dasgupta et al.,2015;Tuder et al.,2012)。新型治疗药物费用高,且应用对象有限,无法得到大众的广泛认可,而有氧运动具有普及性高、费用低、多样性强和副作用小等特点,因此,有氧运动是一种具有广泛适用性的临床干预手段。
有氧运动作为一种重要的非药物干预手段对PAH的改善作用十分显著,一方面,有氧运动通过提高机体的运动能力改善患者的生活质量,进一步延长PAH患者的生存期。另一方面,有氧运动可以抑制ERS,同时调节血管平滑肌线粒体自噬及代谢水平从而改善血管功能(Paulin et al.,2014),但由于运动本身的改善机制复杂,同时有关有氧运动调控PAH病理状态下ERS、线粒体自噬和代谢相关信号通路变化和它们之间的交互关系还有待系统的基础研究给予详细的解释。
2 内质网应激、线粒体自噬和代谢紊乱参与PAH病理发生、发展的生物学机制
由于在PAH病理发展过程中存在复杂的生理学机制,其发病机理仍有待界定,因此,PAH既可以作为独立的疾病也可以作为一种并发症。研究证实,ERS、线粒体自噬和代谢紊乱相关指标的变化密切参与调控PAH的病理发展,同时ERS同线粒体自噬和代谢紊乱相关指标也有着密切的联系,三者在功能之间存在交互作用。
2.1 内质网应激介导PAH发展的生物学机制
ERS作为一种细胞的系统性纠错程序,在调节合成蛋白稳定和维持细胞正常功能方面都具有十分重要的作用,研究表明,ERS密切参与PAH各个组织的病理发展过程,并随着疾病的恶化同细胞凋亡和抗凋亡有密切联系(Dromparis et al.,2013)。研究发现,由于ERS所引起的非折叠蛋白反应(unfolded protein response,UPR)在一定程度上促进了血管平滑肌的增殖,过度增殖将直接破坏血管稳态,导致血管重塑进而上调血压和剪切应力,进一步介导右心室病理进程加快,使其进入失代偿期(Koyama et al.,2014)。为了进一步证明ERS介导的细胞凋亡同PAH有着密切联系,Mao等(2014)研究发现,随着PAH的恶化,蛋白激酶RNA样内质网激酶(protein kinase RNA-like endoplasmic reticulum kinase,PERK)、转录激活因子6(activating transcription factor 6,ATF6)、葡萄糖调节蛋白(glucose regulated protein 78kda,GRP78)等ERS相关蛋白活化,这表明,ERS被显著激活,提示PAH下出现的血管重构可能与ERS紊乱有关。
GRP78作为调节ERS的关键蛋白,GRP78的上调介导ERS程度加深,GRP78所激活下游信号通路PERK/eIF2α/ATF4被证明是PAH病理条件下血管重构、炎症反应等的关键所在,同时该通路的激活可介导肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)中的Nogo蛋白表达上调。一方面,Nogo-B蛋白被证明参与PAH介导的血管重构、炎症、纤维化的发生;另一方面,Nogo蛋白表达的上调介导内质网形态发生改变,这种变化将直接扰乱特殊结构线粒体-内质网偶联(mitochondria-associated endoplasmic reticulum membrane,MAM)功能,MAM的损伤会减少从内质网流向线粒体的Ca2+,使得线粒体内Ca2+减少继而导致线粒体产能功能受损,进入糖酵解状态(Dromparis et al.,2013;Sutendra et al.,2011;Yu et al.,2009)。因此,ERS及其调节信号通路在PAH发生、发展过程中有重要作用。
2.2 线粒体自噬介导PAH发展的生物学机制
有研究表明,线粒体自噬对于健康和疾病状态中的心血管稳态有着至关重要的调节作用(Bravo-san et al.,2017)。动物研究和临床实践发现,线粒体自噬的增加参与PAH的病理发展(Goncharov et al.,2014;Nogueira-Ferreira et al.,2018)。低氧胁迫可诱导自噬增加进而介导细胞凋亡(Aggarwal et al.,2016)。而PAH作为一种低氧胁迫引发的心血管疾病,其病理发展可导致内皮细胞(endothelial cells,ECs)中的线粒体解偶联蛋白(mitochondrial uncoupling proteins-2,Ucp2)缺失,上调PINK1和Parkin蛋白表达,继而介导线粒体自噬的过度增加(Marycz et al.,2018;Ryan et al.,2015)。过度自噬导致线粒体质量减少,并削弱线粒体的产能效率,继发糖酵解水平升高(Haslip et al.,2015)。特别在严重PAH时,大量糖酵解的发生促进线粒体膜超极化,抑制促凋亡物质释放,导致在PAH病理发展后期表现为抗凋亡状态(Heiden et al.,2009)。ECs中线粒体自噬的增加会引起ECs分泌功能障碍,使得缩血管物质如内皮素1(endothelin 1,ET-1)分泌增加,而舒血管物质如一氧化氮(NO)和前列腺素I(prostag-landin-I,PGI)等分泌减少,进而导致整体的血管活性物质和细胞因子水平失衡,促使PASMCs和成纤维细胞增殖、迁移介导血管重塑的发生(Heiden et al.,2009;Sutendra et al.,2011)。因此,线粒体自噬是PAH病理发生、发展的重要因素之一。目前,自噬调控应用于治疗心血管疾病得到了认可,因此,从线粒体自噬入手探究其相关通路对PAH的影响作用将为PAH的治疗提供实验基础。
2.3 机体代谢紊乱参与PAH发病的相关生物学机制
代谢紊乱同大部分心血管疾病的发生和发展有着密不可分的联系,是由于多种代谢成分异常聚集所导致的病理状态(Cani,2019;Gluckman et al.,2009)。Stenmark等(2015)提出代谢重编参与PAH的发病机制。研究证实,有关PAH代谢变化的一个主要原则是从氧化磷酸化转变为糖酵解,而由于有氧氧化功能损伤,使得无氧酵解依赖性的增加继而加速了疾病恶化,这种效应称为Warburg效应。Warburg效应作为肿瘤病理发展的关键因素,在PAH中也有显现,且PAH所引起的Warburg代谢效应甚至超越了传统的Warburg效应。在PAH病理状态下观察到PASMCs显现出增殖现象,其中存在的PASMCs抗凋亡状态和糖酵解依赖增加的过程同癌细胞中观察到的细胞表型相似,提示,Warburg效应可能是介导PASMCs增殖的潜在因素(Gurtu et al.,2015;Wu et al.,2016;Yi et al.,2017)。
在PAH肺血管系统中,线粒体超极化可减少超氧化物歧化酶-2(superoxide dismutase-2,SOD2)表达,而SOD2缺乏会使氧化还原信号分子过氧化氢产生低于正常生理水平,进而诱导低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)活化,HIF作为一种转录因子和主要的缺氧调节因子,可控制代谢“重编程”进而介导低氧水平相关反应。因此,HIF有着深刻的描述PAH发病机制及缺氧诱导的PAH代谢相关病理学特征的功能。此外,活化的HIF-1α可在诱导丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDK)转录抑制丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)的同时也参与调控机体多种增殖和凋亡的相关信号通路,如p53、瘦素、caveolin-1和PTEN等(Archer et al.,2016;Chaudhary et al.,2017;Cottrill et al.,2013;Rehman et al.,2010;Shimoda et al.,2011)。
已知在PAH病理过程中涉及Warburg效应,而HIF作为Warburg效应的重要靶点,其首先介导的代谢相关物质PDK的表达增加,这将进一步介导磷酸化和酶促PDH的抑制,继而抑制线粒体氧化磷酸化的进行,从而上调Warburg效应的水平继而加速PAH的病理进程(Sutendra et al.,2011,2013)。
3 有氧运动干预改善PAH的生物学机制
有氧运动作为一种非药物干预手段已成为治疗心血管疾病的重要措施(Zanesco et al.,2007)。据报道,经常参加有氧运动可以改善心肺功能,提高身体活动能力,同时减轻疾病患者的疲劳程度,起到改善患者生活质量和延长生存期的作用(McDonough et al.,2011)。前期研究对有氧运动改善PAH的具体生理学机制进行了深入探究(表1)。表1总结了目前有关有氧运动影响PAH分子变化的研究结果,本综述采用Pubmed检索并筛选了其中7项有氧运动对PAH起到良性结果的相关研究。
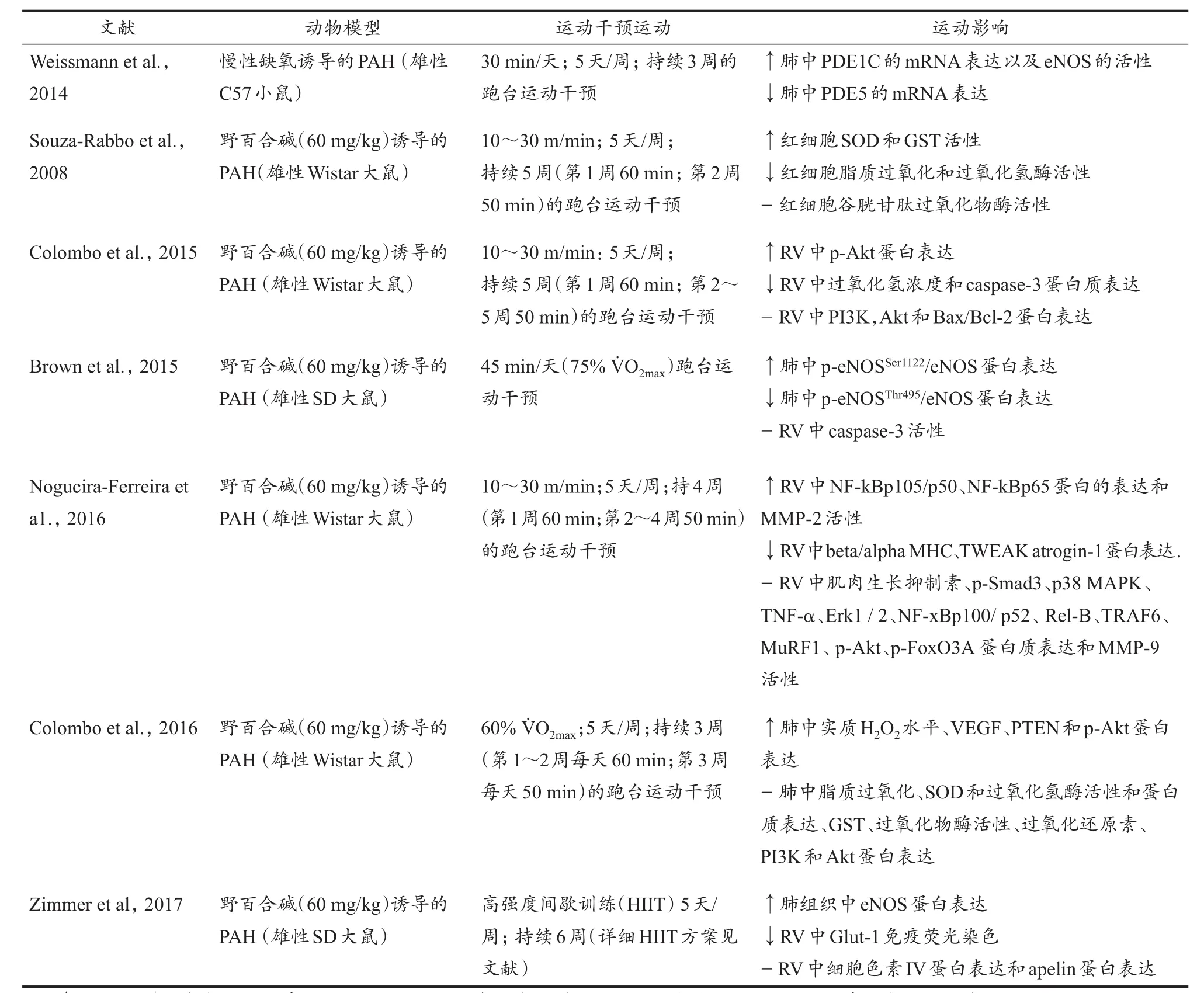
表1 有氧运动介导PAH病理状态下的分子水平变化Table 1 Aerobic Exercise Mediates Molecular Level Changes in PAH Pathology
研究分别探究了有氧运动对PAH动物模型下心脏和肺血管组织的相关分子水平变化。有研究表明,有氧运动在起到抗炎作用的同时显著改善了PAH下心脏重塑(Voelke et al.,2013;Vonk-Noordegraaf et al.,2013)。还有研究表明,有氧运动对PAH下大鼠右心室(right ventricle,RV)中H2O2浓度调节和凋亡信号调控起良性作用,下调RV中Caspase-3蛋白表达并活化Akt(p-Akt)(Colombo et al.,2015)。炎症是影响细胞存活的重要因素之一,研究表明,在野百合碱诱导的大鼠PAH中发现,有氧运动可以显著减少脂质过氧化并增加SOD和GST活性,继而减轻氧化应激,同时出现削弱糖酵解依赖现象,提示,这是预防RV肥大和增加存活率的良性现象(Brown et al.,2017;Souza-Rabbo et al.,2008)。适当的有氧运动被证明具有抗炎效应,新近研究表明,有氧运动降低促炎因子TWEAK的表达,继而调节NF-κB通路的下游细胞因子,阻止泛素连接酶Atrogin-1表达的增加,并诱导金属蛋白酶活性改变(Brown et al.,2015;Nogueira-Ferreira et al.,2016)。
基础研究和临床实践均证实,有氧运动可改善肺血管功能(Brown et al.,2015;Colombo et al.,2013,2015;Nogueira-Ferreira et al.,2016),其中有关有氧运动改善PAH肺血管的分子机制主要集中在运动提高eNOS的活性,增加NO的产生,继而激活可溶性鸟苷酸环化酶(soluble NO-activated guanylate cyclase,sGC)催化cGMP合成,cGMP进一步引起血管舒张并抑制血管平滑肌细胞增殖和血小板聚集(Brown et al.,2017;Dasgupta et al.,2015;Nogueira-Ferreira et al.,2014;Wang et al.,2014)。此外,新近研究表明,有氧运动通过调节肺血管中H2O2/VEGF/p-Akt信号通路,刺激肺血管新生,降低PAH下肺血管损伤(Colombo et al.,2016;Handoko et al.,2009)。
3.1 有氧运动减缓内质网应激改善PAH的生物学机制
前文已阐明PAH病理发展过程同ERS存在密切关联。研究表明,体育锻炼和有氧运动可调节病理状态下ERS水平,具体表现为增加内质网适应能力来提高处理未折叠或错误折叠的蛋白质的能力,从而提高机体适应ERS的水平阈值,调节慢性低度炎症,控制钙信号的传导等(Passos et al.,2015)。本研究团队的前期研究表明,在PAH介导的PASMCs过度增殖过程中伴随有密切的炎症和免疫活动。其中,NLRP3作为重要的炎症因子,在野百合碱诱导的PAH中表达明显提高,同时在NLRP3所介导的ERS相关蛋白GRP78和GRP94的上调,激活ATF4分支通路,这些充分证明了PAH介导的NLRP3表达上调继而使ERS水平提高。运动抗炎作为运动改善心血管疾病的关键靶点,4-PBA作为有效抑制ERS的药物,被证明在PAH病理条件下具有显著抑制ERS继而抑制NLRP3的作用。因此,有氧运动可通过影响机体炎症和免疫活动改善ERS压力继而抑制PAH的病理发展(Broderick et al.,2019;Zeng et al.,2017)。另有研究表明,有氧运动初始阶段的反应是诱导ERS和激活UPR信号,而长时间有氧运动后,这些增加的ERS得到缓解,这表明,激活的UPR信号被诱导适应于有氧运动以支持细胞存活(Hong et al.,2017)。由于PAH是一种低氧诱导的心血管疾病,因此,研究有氧运动对PAH下内质网功能及ERS的调节作用,将为阐明PAH病理发生及有氧运动治疗的提供实验基础。
3.2 有氧运动调节线粒体自噬改善PAH的生物学机制
适宜的有氧运动可提高线粒体功能,有氧运动对线粒体的改善作用不仅是线粒体数量增多、体积增大、嵴多而致密,有效的运动训练刺激后还发现,线粒体密度明显减少,基质电子密集,氧化磷酸化水平增强,膜电位升高,ROS水平降低和SOD水平增加,在长期有氧运动干预后发现,线粒体氧化呼吸链相关酶活性显著提高(Laker et al.,2017),提示,长期的有氧运动干预可以改善PAH患者线粒体氧化呼吸链功能。严重的PAH将诱发机体出现低氧血症继而诱导PASMCs线粒体中ROS的增加,使得线粒体功能紊乱,最终导致细胞凋亡。
线粒体作为机体能量供给的中心,其功能的完整直接关系着机体活动能力以及代谢水平。由于代谢紊乱密切参与PAH的发生、发展,所以线粒体的裂变和融合同PAH病理发生、发展密切相关,但线粒体自噬是否介导某些保护性或有害性的过程尚不清楚。研究表明,肺动脉EC中Ucp2作为调节线粒体自噬的重要蛋白,缺氧介导Ucp2的缺失是诱导PAH发生的关键机制,此外还发现肺中PINK1,Parkin和LC3B-II增加。而沉默PINK1后,进行缺氧诱导PAH后发现,Ucp2蛋白表达升高同时伴随有RV收缩压增加,而Ucp2敲除后用缺氧诱导PAH发现,RV收缩压和RV肥大显著减少(Aggarwal et al.,2016),提示,有氧运动可能下调Ucp2的表达继而抑制PAH的发展。有研究证实,适量的有氧运动可以显著降低细胞中衰老和破损的线粒体,一方面有氧运动有效控制线粒体中的ROS水平;另一方面,有氧运动可下调LC3-I、P26、Beclin-1等蛋白的表达,进而调控线粒体自噬水平(Golbid et al.,2011)。但有氧运动能否通过抑制线粒体自噬进而改善PAH及其具体分子机制尚不明确,目前缺乏系统的研究。因此,阐明有氧运动改善线粒体功能进而影响PAH病理发生、发展的生物学机制将为运动改善PAH提供理论依据和实验基础。
3.3 有氧运动调节机体代谢紊乱改善PAH的生物学机制
有研究表明,在PAH病理发展过程中,机体无氧酵解、脂肪酸氧化、氨基酸分解等代谢途径均发生不同程度的改变,如机体有氧氧化功能损伤以及Warburg效应的发生(Fessel et al.,2012)。有氧运动具有提高机体有氧氧化、无氧酵解等相关反应关键限速酶(PDK、PDH)的活性,从而改善整体代谢水平的能力。相关研究表明,有氧运动对高胆固醇血症、肥胖和糖尿病患者出现的机体代谢紊乱有一定的调控作用。具体表现为,在有氧运动干预后糖尿病患者的血糖值有显著改善,并且发现有关糖代谢和脂代谢的相关关键限速酶的活性提高,肌肉线粒体的有氧氧化能力增强,在一定程度上改善脂代谢和糖代谢紊乱。而在高胆固醇血症患者中,有氧运动干预后,出现体内LDH的减少,而HDL的含量相对提高(Alvarez et al.,2013)。由此可见,有氧运动对调节机体代谢水平也着重要的意义,所以,有氧运动可从调节机体糖酵解、脂肪酸氧化和氨基酸分解等方面调节PAH下代谢紊乱。而有关有氧运动改善PAH下代谢紊乱的文献报道比较稀少,但有氧运动从代谢层面改善PAH病理的发生和发展是毋庸置疑的,积极探索有氧运动对PAH诱导代谢紊乱的调控机制,将对阐明有氧运动干预PAH的分子机制及探寻干预靶点提供实验依据。
3.4 有氧运动联合药物干预协同治疗PAH的生物学机制
有氧运动虽是预防与治疗心血管疾病及代谢相关疾病的有效手段之一,但由于疾病晚期的患者机体活动能力严重下降,运动能力受限,因此无法进行治疗性运动训练。同时,单一有氧运动治疗的效果短期内无法超越药物干预,因此,有氧运动联合药物协同治疗将成为临床实践发展的新 方向(Scott et al.,2018;Nogueira-Ferreira et al.,2018)。
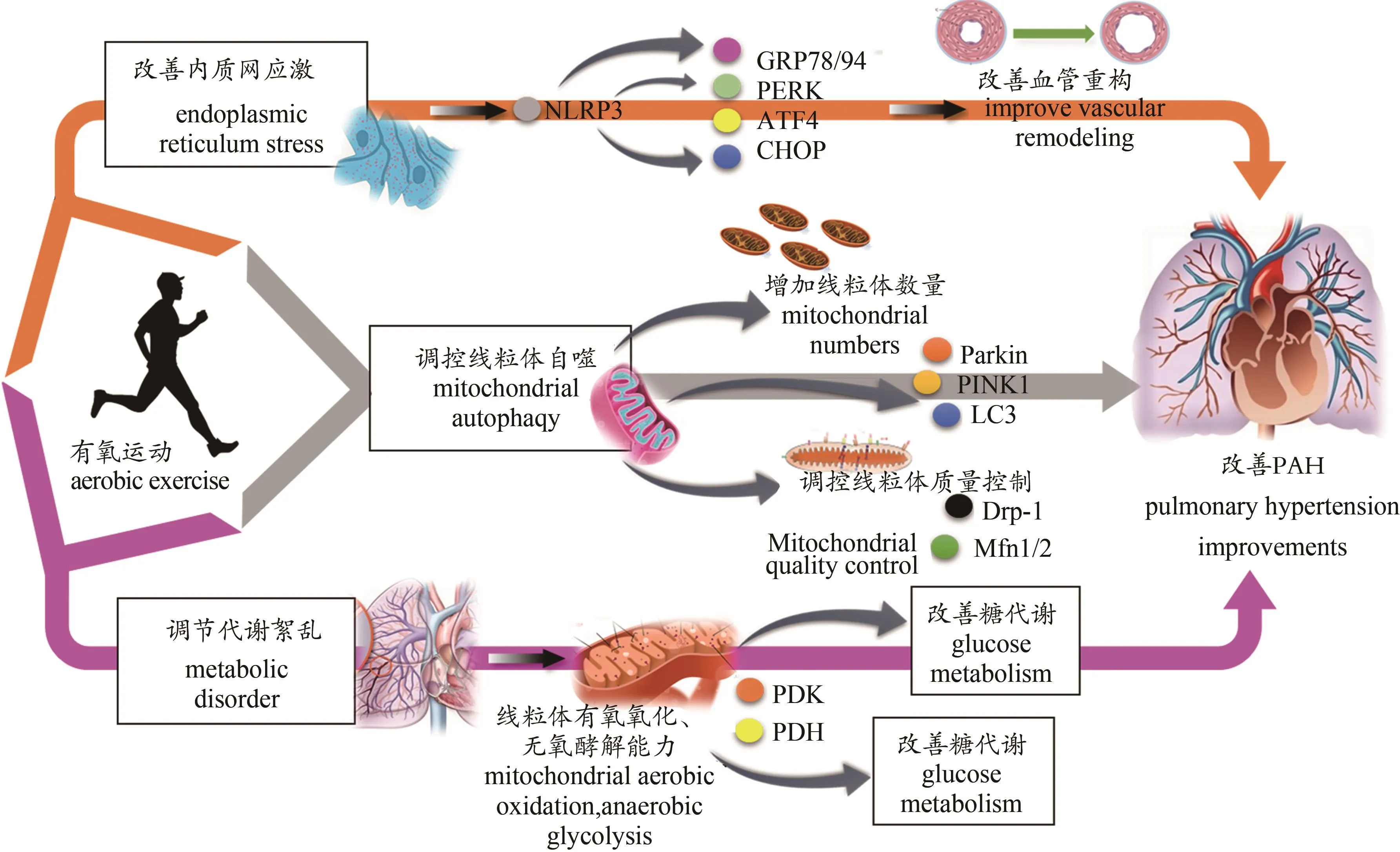
图2 有氧运动调节内质网应激、线粒体自噬和代谢紊乱改善PAH的分子信号变化Figure 2. Aerobic Exercise Regulation of Endoplasmic Reticulum Stress,Mitochondrial Autophagy and Metabolic Disorders Improve Molecular Signal Changes in Pulmonary Hypertension
基础研究与临床实践均已报道有关治疗PAH的有效手段,在基础研究中大多选择转基因动物模型,或具体靶点的抑制剂/激动剂干预,进一步探讨通过抑制ERS、调节氧化应激起到治疗或逆转PAH的分子机制(Zeng et al.,2017)。临床实践主要聚焦PAH介导血管内皮功能障碍的靶向性药物治疗,其中包括磷酸二酯酶抑制剂,内皮素受体拮抗剂、sGC刺激剂和选择性PG受体激动剂。这些靶向药物治疗的临床结果显示,PAH患者短期肺血流动力学和身体活动能力均有改善,且使用此类药物可将短期死亡率降低约40%(Galiè et al.,2013,2015)。但长期使用PAH特异性单一治疗手段后发现,患者的生存期未显著延长,随后临床上采用多种药物联合治疗PAH的方法,但由于多种药物的共同干预导致患者机体产生强烈副作用,因此,PAH晚期患者的生存率未显著提高(Gaine et al.,2017;Lajoie et al.,2016)。
有氧运动作为一种副作用小且成本低的非药物治疗手段,对于活动能力正常且处在中前期PAH的患者有着显著的改善作用(Nogueira-Ferreira et al.,2018)。有关有氧运动联合药物干预治疗冠状动脉粥样硬化、高血压、糖尿病、关节炎和癌症等已在临床方面得到证实和认可(Cheng et al.,2019;Sancier,1999;Yip et al.,2019),但由于PAH的病理机理复杂,因此,有关有氧运动联合药物干预治疗PAH的研究鲜有报道。相信随着有氧运动对PAH改善机制的阐明和具体运动方案的细化,有氧运动联合药物协同治疗PAH将成为未来临床实践与评估的新方向,此方面的深入研究将为PAH提供新的干预形式及改变治疗策略提供实验基础和理论依据。
4 结语与展望
现阶段有关寻找预防和治疗PAH的针对性有效作用靶点一直是亟待解决的关键问题(Dromparis et al.,2013;Fayyaz et al.,2018)。近些年,PAH作为心血管疾病中的“恶性肿瘤”早已影响国人健康,因此,有关PAH预防和治疗的相关研究是事关人民健康和生活质量的要事,同时也是积极响应“健康中国2030”的实际行动。有氧运动是预防和减轻心血管疾病的重要非药物干预手段,对PAH的改善作用越来越受到研究者的重视。
1)关于有氧运动抑制ERS、调节线粒体自噬和改善代谢紊乱进而改善PAH的具体机制,因相关基础研究匮乏,需要进一步探讨。同时,应考虑有氧运动对PAH的长期干预作用,有氧运动对机体的趋化和改善是一个长期的渐变过程,因此,长期的有氧运动干预与追踪可能是未来对非药物治疗领域研究的重要方向之一。
2)关于有氧运动降低心磷脂酰基转移酶1(acyl-CoA:lysocardiolipin acyltransferase-1,ALCAT1)的表达进而改善PAH的分子机制值得深入研究,本研究团队近些年致力于ALCAT1基因敲除改善PAH的机制研究,前期研究表明,在PAH的发生、发展过程中,ALCAT1的表达显著增加。相关研究发现,ALCAT1能够调节线粒体自噬和代谢,ALCAT1定向基因敲除具有改善线粒体功能,降低氧化应激和炎性反应等功能(Li et al.,2012)。然而有关有氧运动对PAH病理条件下ALCAT1的表达起到抑制作用,进而使MAM功能得到改善的相关机制目前尚不明确。近期研究发现,ALCTA1基因敲除小鼠削弱持续缺氧诱导的肺动脉压力升高,并改善肺动脉线粒体自噬和代谢。因此,ALCAT1是预防和治疗PAH的潜在有效靶点,而有关有氧运动对PAH下ALCAT1的调节作用缺乏系统性的基础研究。
3)关于有氧运动干预降低PAH的具体运动方案,需要进一步的研究和细化。不同的有氧运动方式和运动强度对机体的影响差异显著,运动方式将直接影响到PAH患者的线粒体功能、ERS水平及代谢能力,间接干预疾病的发展过程。因此,未来研究应细化有氧运动方案,以确定不同的有氧运动形式对PAH的影响。此方面的深入研究,对运动处方的制定和在临床实践中开展有氧运动干预和治疗PAH意义重大。同时,有氧运动联合药物干预可能是更有效的预防和治疗PAH的方法,此方面的深入研究及相关机制的阐述,将为攻克PAH这一复杂的心血管疾病奠定理论基础,对切实改善PAH患者的生活质量有重要意义。
