运动因子在心血管功能中的调控作用及相关机制研究进展
2020-06-05于凤至刘淑卉
于凤至 ,孙 朋 *,刘淑卉
心血管疾病已成为全球人类最主要的死亡原因。研究数据显示,全球每年约有1 730万人死于心血管疾病(Sacks et al.,2017)。目前,我国心血管疾病患者人数约为2.9亿,占疾病死亡构成的40%(胡盛寿等,2019)。Safdar等(2016)提出,运动可刺激机体某些内源性细胞因子、抗凝血肽和代谢物等释放进入血液循环,起到保护器官、修复组织损伤和延缓衰老等作用。由肌肉、脂肪和肝脏等内分泌器官分泌的肌肉因子(myokines)、脂肪因子(adipokines)和肝脏因子(hepatokines),统称为运动因子(exerkines),可作为心血管疾病的潜在作用靶点。
心血管疾病的发病机制是多因素的,多源于血管内皮细胞(vascular endothelial cell,VEC)、血管平滑肌细胞(vascular smooth muscle cell,VSMC)及心肌细胞功能紊乱(Kal-man et al.,2019)。动物模型和临床研究表明,多种运动因子如卵泡抑素样蛋白1(follistatin-like 1,Fstl1)、鸢尾素(Irisin)、肌肉生长抑制素(myostatin,MSTN)、网膜素(Omentin)、肿瘤坏死因子相关蛋白3(C1q/TNF-related protein 3,CTRP3)和CTRP9、爱帕琳肽(Apelin)、成纤维细胞生长因子 21(fibroblast growth factor 21,FGF21)、血管生成素样蛋白 3(angiopoietin-like protein 3,ANGPTL3)和ANGPTL 4等,可调节血管内皮细胞、血管平滑肌细胞和心肌细胞的生长、增殖、迁移等生理进程,对改善心血管疾病的病理进程发挥积极作用。
1 肌肉因子在运动调控心血管功能中的作用
肌肉因子是由骨骼肌细胞分泌、释放的细胞因子或肽类,可随血液循环作用于全身多个脏器,参与机体代谢等生理进程。研究表明,多种肌肉因子参与了系统代谢和心血管功能的调节。
1.1 卵泡抑素样蛋白1(Fstl1)
Fstl1,又称TSC36,属于卵泡抑素和Sparc(分泌蛋白,酸性且富含半胱氨酸)家族的分泌糖蛋白(Sylva et al.,2013)。据报道,Fstl1主要由骨骼肌C2C12细胞和心肌细胞分泌,可通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB/Akt)通路激活内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS),改善VEC功能,促进缺血组织的血运重建(Ouchi et al.,2008;Shimano et al.,2011)。Tania等(2017)研究表明,Fstl1的高表达与小鼠肌肉和弹性动脉中肌动蛋白的高含量相关。VSMC中的Fstl1可拮抗骨形态发生蛋白(bone morphogenetic protein,BMP)信号以促 进 转 化生 长 因 子 -β(transforming growth factor-β,TGF-β)诱导的α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达及抑制腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)通 路 ,诱 使 VSMC 增 殖(Dong et al.,2015)(图1实线箭头)。Fstl1还可抑制果蝇抗生物皮肤生长因子蛋白1(drosophila mothers against decapentaplegic protein 1,Smad1)、Smad5和Smad8磷酸化相关基因如Gata2、内切葡聚糖(一种III型TGF-β受体,主要在增殖的VEC中表达)以及Jagged1的表达,于血管成熟后期分别在血管特化和重塑进程中发挥重要作用(Yao et al.,2013)。另一实验研究发现,Fstl1还可通过BMP-4下调AMPK的活性,抑制细胞凋亡和炎症反应,从而预防心肌缺血后的再灌注损伤(Ogura et al.,2012)(图1虚线箭头)。

图1 肌肉因子调控心血管功能的机制Figure 1. The Mechanisms of Myokines Regulating Cardiovascular Function
急性运动和长期运动均可引起Fstl1水平升高。Kon等(2019)对8名健康男性进行4次高强度间歇性冲刺训练的研究结果发现,血浆中的Fstl1浓度显著提高。Gorgens等(2013)实验证明,Fstl1由人体肌管系统表达和分泌,对8名男性受试者进行60 min急性运动,可使其血清中的Fstl1浓度增加约22%。在动物研究中,4周间歇性有氧运动可促使左冠状动脉结扎诱导的心肌梗死大鼠骨骼肌Fstl1的分泌,以激活TGF-β/Smad2/3信号通路,延缓心肌纤维化,并诱导心肌血管生成(Xi et al.,2016)。由此,Fstl1可通过多重机制介导运动改善心肌功能,但其介导运动影响动脉功能的生理机制仍需进一步探索。
1.2 鸢尾素(Irisin)
Irisin是一种含有112个氨基酸的糖基化蛋白,分子量约为12 kDa,是一个由III型纤连蛋白组件包含蛋白5(type III fibronectin module contains protein 5,FNDC5)水解的N-末端纤连蛋白III样结构域组成的二聚体,被认为是运动后肌肉衍生的代谢调节因子(Fatouros et al.,2018)。研究表明,Irisin可启动Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/核糖体 S6 激酶 1(S6 kinase 1,S6K1)通路保护VEC免受oxLDL侵袭,通过上调PI3K/Akt信号通路诱导VEC增殖,促进血管生成,而Akt/mTOR抑制剂或shmTOR1/2/3可阻断其在VEC中的作用(Liao et al.,2019;Zhao et al.,2018)。Ye等(2018)研究发现,Irisin通过TRPV4通道刺激大鼠肠系膜动脉细胞外Ca2+内流,从而诱导内皮依赖性血管舒张。Hou等(2017)实验证实,Irisin可活化血管外脂肪组织中血红素氧合酶-1(oxygenase-1,HO-1)/脂联素(Adiponectin,ADPN)轴,进一步激活AMPK/eNOs通路来改善内皮功能障碍。Martinez等(2018)在人脐带内皮细胞(human umbilical cord endothelial cell,HUVEC)中施用20 nM Irisin可上调细胞外信号调节激酶(extracellular regulated protein kinases,ERK)表达,诱发VEC增殖(图1实线箭头)。另有研究发现,Irisin通过Nrf2介导的活性氧(reactive oxygen species,ROS)/TGF-β1/Smad2/3 信号轴抑制血管紧张素II(angiotensin II,AngⅡ)诱导的心肌纤维化,并通过AMPK/mTOR信号传导抑制心肌肥厚(Chen et al.,2019;Yu et al.,2019)(图1虚线箭头)。
长期运动可改善机体因衰老和久坐引起的循环Irisin浓度降低。12周自主跑轮运动,使得雌性大鼠心脏与血浆中 的 Irisin水平显 著提高(Belviranli et al.,2018)。Bashar等(2018)对雄性大鼠进行为期8周的游泳运动后发现,血清Irisin与心脏胶原沉积和胱天蛋白酶-3(caspase-3)表达水平呈负相关,表明定期运动或服用重组Irisin可预防急性心肌梗死。Kim等(2013)研究发现,超重或肥胖成年人进行8周65%~80%1RM的抗阻运动后,血浆Irisin浓度增加约17.5%。此外,运动能促使Irisin增强Nkx2.5+心脏祖细胞(cardiac progenitor cell,CPC)修复心肌细胞并促进缺血后增殖能力,以介导心脏再生和新生血管形成,抑制心脏纤维化(Zhou et al.,2019)。综上,慢性运动能显著提高机体Irisin浓度,改善心脏功能及血管再生能力,但急性运动能否系统性地改变Irisin水平以发挥良性心血管效益,目前尚不知晓。
1.3 肌生长抑制素(MSTN)
MSTN,又称GDF-8,属于TGF-β蛋白家族,主要由肌细胞表达(Dschietzig et al.,2014)。动物实验研究表明,MSTN基因特异性敲除可改善肥胖小鼠和老年小鼠超氧化物下调引起的血管舒张作用,降低心肌纤维化程度(Morissette et al.,2009;Qiu et al.,2014)。MSTN过表达可激活 TGF-β 活化激酶 1(TGF beta-Activated Kinase 1,TAK1)/丝裂原活化蛋白激酶3/6(mitogen-activated protein kinase kinase 3/6,MKK3/6)/P38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和单核细胞趋化蛋白(monocyte chemoattractant protein-1,MCP-1)/CC趋化因子受体 2(CC chdivokine receptor 2,CCR2)等通路,抑制A7r5平滑肌细胞增殖和VSMC分化特异性抗原(smoothelin)相关mRNA表达(图1实线箭头),促进细胞骨架重排并增加迁移率,导致心肌细胞间质纤维化(Biesemann et al.,2015;Verzola et al.,2017)。此外,MSTN 可激活 G 蛋白信号转导因子2(一种GTP酶激活蛋白),限制Gαq和Gαs信号转导以及p38/Akt信号通路,减弱苯肾上腺素诱导的新生大鼠心肌细胞肥大(Morissette et al.,2006),还可通过上调p21和降低细胞周期蛋白依赖型激酶-2表达,抑制Akt和活化T细核因子-3,以限制大鼠心肌细胞的增殖(Artaza et al.,2007;Bish et al.,2010)。体外研究发现,MSTN在新生大鼠心肌细胞培养过程中可增加LC3-II和多聚泛素化蛋白数量,降低P70核糖体蛋白S6K1磷酸化,抑制心肌细胞合成类蛋白的表达(Manfredil et al.,2017)(图1虚线箭头)。
运动可显著改变机体循环MSTN水平。Lenk等(2012)指出,慢性心力衰竭患者进行12周有氧运动后,其骨骼肌中的MSTN浓度显著降低。Kabak等(2018)对18~24岁成年男性进行4×30 s Wingate测试发现,急性高强度间歇运动(high intensity interval exercise,HIIT)后即刻以及恢复3 h、6 h血清MSTN水平均升高。对LAD结扎模型大鼠进行4周跑台运动的研究发现,与对照组相比,其骨骼肌和心肌中的MSTN表达量降低到基线水平。该途径可通过肿瘤坏死因子α(tumor necrosis factor α,TNF-α)相关核因子 κB(nuclear factor kappa-B,NF-κB)/MAPK通路调节(Lenk et al.,2009)。综上,有氧运动可显著减少机体MSTN水平,而急性抗阻运动会增加MSTN分泌,但MSTN与心血管相关的运动机制仍需进一步研究。
2 脂肪因子在运动调控心血管功能中的作用
脂肪因子由脂肪组织产生,在能量平衡、糖脂代谢、生殖和免疫等方面发挥作用,可通过内分泌或者旁分泌的方式作用于血管壁及心脏,影响心血管功能。
2.1 网膜素(Omentin)
脂肪因子Omentin,又称intelectin-1,是一种可溶性的呋喃半乳糖结合凝集素(Tan et al.,2015)。近年大量研究表明,AMPK及其下游信号作为心血管组分中Omentin的主要作用靶点,相关机制包括:1)Omentin可激活AMPK/eNOS通路,诱使VEC存活和网状结构形成,抑制其炎症反应,诱导血管舒张(Maruyama et al.,2012);2)Omentin能够启动AMPK/ERK轴,以抑制VSMC增殖和迁移(Maruyama et al.,2018)(图2实线箭头);3)AMPK介导的Ras/ERK信号级联反应失活部分参与Omentin对心肌缺血性损伤和心肌细胞病理性肥大的保护作用(Matsuo et al.,2015)(图2虚线箭头);4)Omentin-1可活化AMPK信号响应压力超负荷,刺激缺血诱导的血运重建,并通过AMPK和/或Akt/eNOS信号传导途径预防动脉损伤诱导的新内膜生成(Kazama et al.,2015)。体外实验研究显示,Omentin-1通过抑制H9c2大鼠心肌细胞中线粒体ROS的产生,以限制adriamycin诱导的细胞凋亡。此外,Omentin可阻断NF-κB信号,并抑制单核细胞对TNF-α活化内皮细胞的粘附性,以下调细胞间粘附分子-1(intercellular adhesion molecule 1,ICAM-1)和血管内皮细胞粘附分子-1(vascular endothelial cell adhesion molecule 1,VCAM-1)的表达,降低内皮细胞炎症反应(Zhong et al.,2012)(图2实线箭头)。
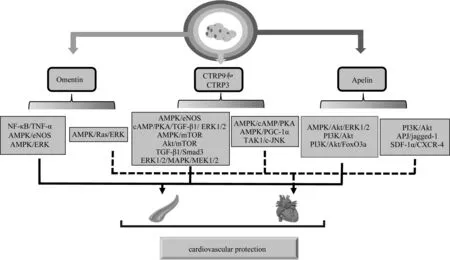
图2 脂肪因子调控心血管功能的机制Figure 2. The Mechanisms of Adipokines Regulating Cardiovascular Function
研究发现,血清Omentin-1浓度与机体胰岛素抵抗、总胆固醇和甘油三酯(triglyceride,TG)浓度以及动脉收缩压等指数呈负相关。每周5天,持续12周的渐进式有氧运动改善了肥胖或超重男性的心脏代谢危险因素,并伴随Omentin-1循环浓度增加(Saremi et al.,2010)。Nikseresht等(2016)报道,非线性阻力训练和有氧间歇训练后,受试者体内Omentin-1水平略有升高,但停止训练后其水平显著下降。此外,He等(2019)研究发现,14名健康成人参与从最大脂肪氧化速率递进至厌氧阈值的递增负荷运动,可增加Omentin循环水平,并有效调节心脏代谢。综上,有氧运动和抗阻运动均能引起循环Omentin水平升高,带来良好的心血管益处。
2.2 肿瘤坏死因子相关蛋白3和9(CTRP9和CTRP3)
CTRP是在脂肪组织中大量表达的ADPN旁系同源物,包含胶原样结构域和类似补体因子C1q的球形结构域(Schaffler et al.,2012)。近期,Huang等(2019)研究认为,CTRP9在早期动脉粥样硬化病变中发挥保护作用,与AMPK/mTOR信号通路的微管相关蛋白轻链3B转化和螯合物1降解引起的自噬水平显著升高相关。CTRP9可激活AMPK/eNOS依赖性途径和环腺苷酸(cyclic adenosine monophosphate,cAMP)/PKA通路,阻断TGF-β1/ERK1/2信号,调节VSMC生长,抑制血管损伤后的内皮化和VSMC过度增殖,改善VEC炎症反应(Jung et al.,2016;Li et al.,2017)(图2实线箭头)。此外,CTRP9能够通过AMPK/cAMP通路抑制心肌细胞凋亡,并减少毒胡萝卜素处理过的心肌细胞内质网应激,上调二硫键A氧化还原酶样蛋白表达,保护H9c2细胞免受模拟缺血后再灌注损伤(Bai et al.,2016;Sun et al.,2013)。Kambara等(2015)研究发现,CTRP9能降低AdipoR/AMPK相关下游信号引起的炎症反应,改善因受脂多糖等病理性刺激引起的左心室功能障碍(图2虚线箭头)。
CTRP3与CTRP9同属CTRP超家族的新成员,也参与调控心血管功能(Yang et al.,2016)。体内实验研究发现,CTRP3可通过激活Akt/mTOR通路,阻断高糖暴露后HUVEC中炎症因子的累积,还可抑制TGF-β1/Smad3通路诱导核易位,降低间质纤维化,减少成纤维细胞数量,从而影响VEC 迁移(Wang et al.,2019:Wu et al.,2015)。外源性CTRP3补充能够以剂量依赖方式活化ERK1/2和MAPK通路,促使p53LMAC01血管平滑肌细胞增殖,还可经MEK1/2相关途径和Akt/缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)/血管内皮生长因子(vascular endothelial growth factor,VEGF)轴促进血管生成(Maeda et al.,2010;Yi et al.,2012)(图 2 实线箭头)。此外,Yuan等(2018)研究表明,CTRP3可激活AMPK/过氧化物酶体增殖物激活受体γ共激活因子-α(peroxisome proliferatoractivated receptor γ coactivator-1,PGC-1α)途径和 TAK1/c-Jun氨基末端激酶(c-Jun amino terminal kinase,JNK)轴,并上调Sirt1表达,以改善心肌细胞生理功能,抑制心脏疾病发生(图2虚线箭头)。
Kon等(2019)实验发现,健康男性受试者进行单次HIIT后即刻与120 min后,CTRP9浓度均显著增加。8周运动强度为60%~70%O2peak的有氧运动,可增加中老年人血清CTRP3浓度,而颈动脉脉搏波速度与CTRP3水平变化趋势呈显著负相关,提示CTRP3可能是运动改善动脉功能的关键因素(Hasegawa et al.,2018)。Choi等(2013)实验发现,肥胖女性进行3个月有氧结合抗阻运动后,血清CTRP3水平显著降低,CTRP5水平略有上升,同时,心脏代谢危险因素包括代谢综合征、胰岛素抵抗和视黄醇(维生素A)结合蛋白 4(retinal binding protein 4,RBP4)水平显著降低。因此,在未来研究中,以CTRP9和CTRP3为代表的CTRP家族在运动调控心血管功能的相关研究中,将有望成为新的重要靶点。
2.3 爱帕琳肽(Apelin)
Apelin作为一种新型脂肪细胞因子,是AngII I型受体相关蛋白(APJ)的内源性配体(Huang et al.,2018)。目前,心血管系统针对Apelin的研究主要集中在Apelin13亚型,其可增强心肌微血管EC中的AMPK和Akt信号,诱发ERK1/2磷酸化,以促进VEC增殖,刺激血管生成。Wang等(2015)实验发现,叉形头转录因子的O亚型3a(forkhead box O3,FoxO3a)磷酸化在介导Apelin引起MMP-2活化和VSMC迁移中起重要作用,PI3K/Akt/FoxO3a信号通路可介导Apelin诱导VSMC迁移(图2实线箭头)。另有研究认为,Apelin可通过调节Sirt3和VEGF/VEGFR-2的表达,以增加糖尿病性心肌病的微血管密度,并改善心脏功能障碍;还可通过抑制心肌氧化应激和细胞凋亡,激活eNOS/PI3K/Akt通路,恢复心肌缺血再灌注损伤引起的心脏功能障碍(Zeng et al.,2009;2014)。Li等(2012)研究指出,Apelin13/APJ通过增加jagged-1和notch-3的表达及促进血管内皮祖细胞归巢入心肌梗死部位,增强心肌梗死后小鼠心脏血管生成。此外,Hou等(2015)发现,Apelin13可通过基质细胞衍生因子-1α(stromal cell derived factor-1,SDF-1)/趋化因子受体-4(chemokine receptor-4,CXCR-4)轴动员心肌梗死后糖尿病小鼠的VEC,并促进心脏修复(图2虚线箭头)。
Apelin/APJ系统在介导运动修复心血管病变中发挥关键作用。Ji等(2017)研究表明,8周龄小鼠进行4周低氧运动后,Apelin、APJ、雌激素相关受体α(estrogen-related receptor α,ERRα)以及HIF-1α mRNA和蛋白表达量升高。自发性高血压大鼠进行为期9周、每周6天的游泳训练,通过容积描记法和放射免疫测定法测得血管收缩压明显降低,血浆和心血管组织中的Apelin水平升高,表明运动对高血压的改善部分通过Apelin免疫反应水平变化来介导(Zhang et al.,2006)。Chen等(2012)研究证实,游泳运动对大鼠低氧性肺动脉高压的改善作用可能是通过调节肺Apelin/APJ系统来实现的。人体实验中,30名高血压患者进行为期6周HIIT后,血浆Apelin和NOx水平显著增加,血浆内皮素-1(endothelin,ET-1)水平显著降低,表明HIIT可能通过提高血浆Apelin和NOx水平,有效延缓血管异常收缩(Chen et al.,2012)。Jang等(2019)对24名肥胖中年女性进行4个月有氧运动和抗阻运动的研究显示,运动对降低肥胖个体血清Apelin12浓度具有显著效果,且与代谢综合征指标密切相关。Fujie等(2014)实验发现,8周有氧运动使得中老年人颈动脉僵硬度明显降低,并伴随血浆Apelin和NOx水平显著升高。综上,动物模型和人体实验指出,有氧运动与抗阻运动均可通过影响Apelin的水平,并对心血管功能产生积极影响。
3 肝脏因子在运动调控心血管功能中的作用
肝脏因子是一组来源于肝脏的蛋白质,可通过调节内皮功能障碍和炎细胞血管壁浸润过程直接或间接影响动脉功能。近期研究表明,Hepatokines在心脏疾病预防与转归中也发挥积极作用。
3.1 成纤维细胞生长因子21(FGF21)
FGF21作为一种新型代谢调节剂,在肝脏中的表达主要受过氧化物酶体增殖物激活受体α(peroxisome proliferators-activated receptor α,PPARα)调控,而 FGF21基因肝脏特异性敲除小鼠引起循环FGF21显著下降(Kokkinos et al.,2017;Markan et al.,2014)。体外实验研究发现,FGF21可诱导沉默信息调节因子2相关酶1蛋白水平降低以及VCAM-1、ICAM-1、P53和P21蛋白水平升高,保护VEC免受 H2O2引发的细胞早衰(Weis et al.,2018);通过活化eNOS/PI3K/Akt和PI3K/Akt/FoxO3a通路,保护HUVEC免受高糖诱导的氧化应激和凋亡,促进HUVEC的增殖和迁移(Guo et al.,2018;Li et al.,2017);经骨保护素(osteoprotegerin,OPG)/RANKL和FGFR1/3/β-Klotho/MAPK/Runt相关转录因子 2(runt-related transcription factor 2,Runx2)信号通路,在活化PPARγ的同时进一步下调FGFR1和β-Klotho表达,减弱VSMC钙化(Cao et al.,2017a;2017b)。动物模型研究发现,FGF21对VSMC增殖和迁移的保护作用与抑制FGFR1/脾酪氨酸激酶(splenic tyrosine kinase,Syk)/NOD样受体家族蛋白P3(NOD-like receptor family protein P3,NLRP3)炎性体有关,可改善新内膜的增生(Wei et al.,2019)(图3实线箭头)。FGF21还可激活CaMKK2/AMPKα和ERK/p38 MAPK/AMPK途径改善糖尿病小鼠主动脉内皮功能障碍和心肌细胞凋亡(Ying et al.,2019;Zhang et al.,2015)。小鼠心肌缺血后,肝脏细胞分泌的FGF21增多,进入循环系统后,在心肌细胞β-Klotho作用下上调PI3K、Akt和Bcl2细胞死亡拮抗剂等激酶和蛋白表达,从而调节caspase-3活性降低引发的心肌缺血性细胞凋亡(Liu et al.,2013)。FGF21通过激活ERK1/2/CREB/PGC-1α信号通路介导的脂质氧化来预防应激诱导的动脉粥样硬化和冠心病(Planavila et al.,2013)。FGF21还可通过Akt或AMPK途径调节脂质和葡萄糖代谢,预防心肌缺血和糖尿病性心肌病(图3虚线箭头)。
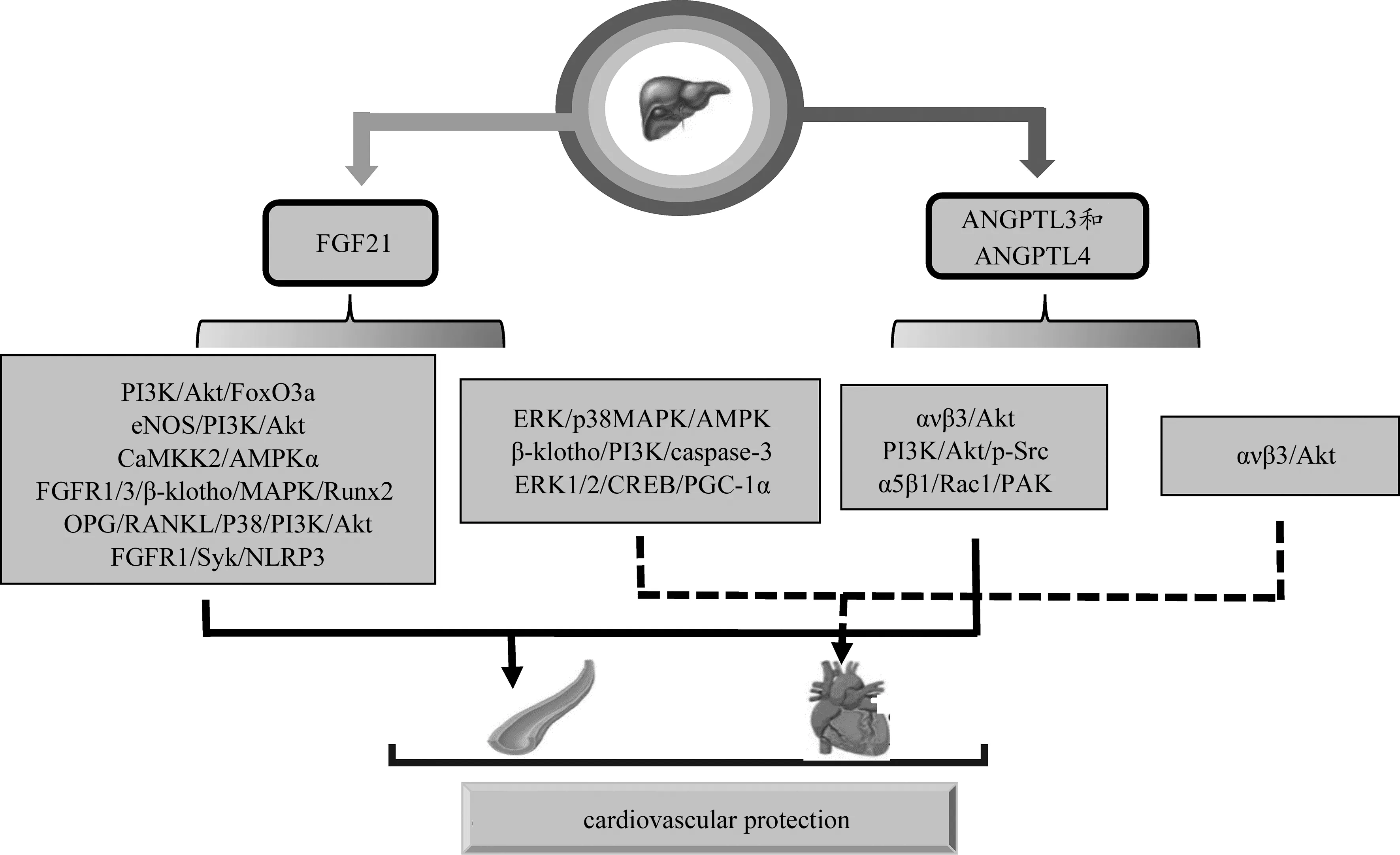
图3 肝脏因子调控心血管功能的机制Figure 3. The Mechanisms of Hepatokines Regulating Cardiovascular Function
Willis等(2019)指出,对10名健康青年男性进行低等强度(55%O2peak)和中等强度(75%O2peak)急性跑台运动,均可提高循环FGF21浓度,且FGF21变化幅度与运动强度呈正相关。田振军等(2018)实验研究表明,SD大鼠进行 4周的跑台运动后,FGF21、FGFR1、Bax/Bcl-2、PI3K和Akt蛋白表达显著升高,胶原纤维百分比下降,心功能改善,表明FGF21/FGFR1/PI3K/Akt信号通路在有氧运动抑制心肌细胞凋亡、降低心肌胶原化面积扩增和改善心功能方面发挥重要作用。Yang等(2019)研究发现,12周跑台运动可以防止成年小鼠高脂饮食诱导的ADPN分泌能力受损,引起FGF21共受体β-klotho以及受体FGFR1和FGFR2表达上调,以抑制脂肪组织炎症。长时间耐力运动可加重高脂饮食小鼠心脏纤维化,训练有素的自噬相关7基因敲除(Atg7h&mKO)小鼠可通过增加循环FGF21水平降低心脏纤维化程度,表明FGF21可参与自噬调节对心肌收缩发挥重要作用(Yan et al.,2017)。但是,Yang等(2011)研究发现,40名非糖尿病肥胖女性进行为期3个月有氧结合抗阻运动,能够降低肥胖女性的FGF21以及动脉僵硬度水平,其具体机制尚不清楚。综上所述,有氧运动、抗阻运动以及联合运动均能影响FGF21的分泌,并对心血管功能产生积极的影响。
3.2 血管生成素样蛋白3和4(ANGPTL3和4)
ANGPTL3与ANGPTL4为编码45~65 kDa的糖蛋白,都具有独特的~15 kDa N末端卷曲螺旋结构域和~35 kDa C末端纤维蛋白原样结构域,是一种新型的PPARγ靶标,在人和小鼠的肝脏中高表达(Lei et al.,2011)。Camenisch等(2002)研究发现,ANGPTL3是由肝脏特异性分泌的血管生成素样家族蛋白,与整合素ανβ3结合后可磷酸化Akt、MAPK和黏着斑激酶,刺激VEC粘附和迁移,与VEGF-A发挥同等的促血管生成作用(图3实线箭头)。Luo等(2018)研究证实,ANGPTL3结合整合素ανβ3受体后,可激活Akt并上调miR-126表达来改善内皮祖细胞功能,减轻心肌缺血并改善心脏功能(图3虚线箭头)。
研究发现,ANGPTL4可抑制肌球蛋白轻链激酶(myosin light chain kinase,MLCK)的活性和VEGF/Src信号传导,导致内皮通透性降低(Bouleti et al.,2013;Rigor et al.,2013)。Galaup等(2012)实验发现,ANGPTL4基因敲除小鼠缺血再灌注后,Src激酶可激活VEGFR-2下游信号,导致VEGFR-2/VE-cadherin复合物解离以及内皮细胞粘附连接破坏,增加血管通透性。ANGPTL4通过激活PI3K/Akt信号,抑制VEGF刺激磷酸化Src向VEGFR-2募集,从而保护VEGFR-2/VE-cadherin复合物的稳定性,并保持血管完整性(Rigor et al.,2013)。此外,ANGPTL4还可与整合素α5β1结合,激活其下游Rac1/PAK信号,从而破坏VEC间的连接(Huang et al.,2011)(图3实线箭头)。
遗传和临床研究表明,ANGPTL3基因缺失与血浆TG、LDL-C 水平升高相关(Lupo et al.,2018)。Smol等(2015)实验研究证实,规律性体育锻炼者的TG/HDL-C比值和AIP显著低于久坐人群,血清中肝脏来源的ANGPTL3水平显著增加,由此推论,ANGPTL3可能是运动改善血清脂质分布的关键介质。为期12周的力量和耐力训练,使得成年男性肝脏中的ANGPTL4 mRNA表达量显著升高(Norheim et al.,2014)。此外,研究发现,正常生理状态下,血浆中的ANGPTL4浓度相对保持稳定,但在长期禁食、慢性热量限制和耐力运动后显著升高(Kersten et al.,2009)。健康成年男性以50%1RM的强度进行2 h伸膝运动后,于0 h、2 h和5 h及次日进行股外侧针活检,用多普勒超声测量股动脉血流流动,结果显示,ANGPTL4水平升高源于肝脏分泌量增加,主要由机体胰高血糖素/cAMP/PKA途径介导(Ingerslev et al.,2017)。综上,运动可升高血清ANGPTLs水平,但其通过ANGPTLs对心血管功能影响的研究尚未形成定论,ANGPTLs在运动调控心血管功能机制方面的研究存在必要性和特殊性,需进一步补充完善。
4 结论与展望
运动因子作为各器官分泌的能量代谢特异性调控因子,已受到广泛关注。本文从肌肉因子、脂肪因子和肝脏因子三方面并结合运动的调控作用,详细论述运动因子在心血管功能调节中的作用(图4)。由此,通过梳理运动因子在心脏和动脉中的具体作用机制及相关信号,以肌肉、脂肪和肝脏为靶点,利用运动干预手段调节相应因子释放(表1),有效改善心血管功能,降低心血管疾病的发病率。然而,运动调控心脏和动脉的功能存在复杂性和系统性,内皮细胞、平滑肌细胞和心肌细胞间的串扰通路尚不明确。此外,尽管运动因子在心血管疾病中的生理病理作用成为当前研究热点,但调控相关因子最佳剂量反应的运动方案(强度、时间和频率等)仍待进一步探究。
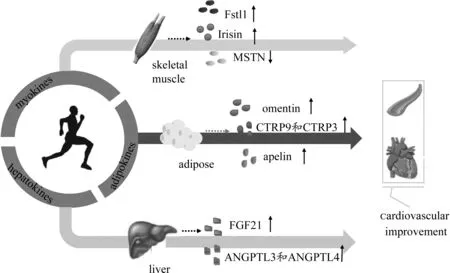
图4 运动因子在运动调控心血管功能中的作用Figure 4. The Role of Exercise in Regulating Cardiovascular Function Mediated by Exerkines

表1 运动对相关运动因子的调节作用Table 1 Regulating Effect of Exercise on Related Exerkines

续表1
