重楼根内生细菌的多样性分析及促生菌的筛选
2020-06-04宋发军甘喆裴婷苗莉云赵伟琼张鹏
宋发军,甘喆,裴婷,苗莉云,赵伟琼,张鹏*
(1 中南民族大学 生命科学学院,生物技术国家民委重点实验室,武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉 430074;2 山西中医药大学 基础医学院,晋中 030619)
重楼是我国珍稀药用植物.目前关于重楼内生菌的研究还处于初步阶段,主要集中在产重楼皂苷或皂苷元内生菌的分离和筛选[1,2],内生菌的多样性研究主要集中在云南[3-6]、福建[7]等地的重楼材料.而湖北地区种植重楼的内生细菌的多样性及其菌群特征研究尚无相关报道.
许多药用植物内生菌具有促进植物生长以及种子萌发的作用,例如,卢玉君等[8]发现砂生槐根瘤内生菌对青稞种子萌发及幼苗具有促生作用,本课题组前期发现一些重楼内生细菌可以促进冬小麦的种子萌发[9].本文通过对湖北地区种植重楼的根部内生细菌进行分离,并分析其多样性,初步揭示该地区重楼根组织的内生细菌的菌群结构,为深入分析不同产区重楼内生菌的差异奠定基础;并进一步通过与小麦幼苗的共培养,筛选促生菌,为后期利用促生菌改良重楼种植技术研究提供菌种资源.
1 材料与方法
1.1 实验材料及试剂
五年生重楼材料于2018年5月采集于湖北省恩施州鹤峰县五里乡柏榔村种质资源园.LA培养基和牛肉膏蛋白胨培养基用于内生细菌的分离,1/2 PDA培养基用于共培养实验.T5 Super Mix(Colony)购自北京擎科,2×Taq PCR Master Mix购自北京博迈德,细菌基因组DNA提取试剂盒购于南京翼飞雪.
1.2 实验方法
1.2.1 湖北种植重楼根中内生细菌的分离与纯化
参照本实验室前期报道[9]:(1)清洗根表面泥土后,无菌条件下削去外皮,称取0.1 g,0.8%~1.0% NaClO溶液浸泡5 min,无菌水清洗5 min,75%(v/v)乙醇浸泡1 min,无菌水清洗3 min;取最后一次表面消毒后的无菌水涂布培养基,观察是否有细菌长出,从而确定消毒是否彻底.(2)无菌条件下将组织块于2 mL生理盐水中轻柔研磨成悬浮液,适当稀释后涂布培养基,28±2 ℃培养7 d.(3)培养过程中不断挑取新长出的内生细菌至新的培养基,并采用划线法纯化获得单克隆.
1.2.2 内生细菌的16S rDNA的扩增与测序
分别将各个内生细菌接入LB培养基,28 ℃、180 r/min培养24 ~48 h.以0.5 μL培养物为模板,采用2×T5 Super Mix(Colony)以及27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTACGACTT-3′)引物进行其16S rDNA序列的扩增.以菌液为模板不能扩增其16S rDNA序列的菌株,则采用细菌基因组DNA提取试剂盒提取其基因组DNA做模板,采用2×Taq PCR Master Mix以及27F和1492R引物进行16S rDNA序列扩增.扩增产物由武汉奥科鼎盛测序.
1.2.3 内生细菌的多样性分析
内生细菌的16S rDNA测序结果,上传于NCBI上进行BLAST比对,确定内生菌的分类,并运用MEGA 7.0软件[10],选用邻接法(Neighbour-Joining)构建系统发育树.
1.2.4 促生菌的筛选
(1)取5 μL内生细菌的培养物涂布在50 mL 1/2 PDA培养基(350 mL组培瓶).(2)接入表面消毒处理的小麦(济麦22)种子5粒,共5个重复,并于人工气候培养箱中,28 ℃、39%湿度、4000 lux光照强度、14 h光照/10 h黑暗的光周期培养7 d;空白对照不接内生细菌.(3)通过检测小麦幼苗的存活情况以及根长、株高、鲜重、侧根数目(均为15株的平均值)筛选促生菌.
2 结果与分析
2.1 内生细菌的分离
采集湖北恩施州地区种植的重楼根并进行表面消毒,将表面消毒处理的最后一步溶液涂布在培养基上培养7 d,培养基上无细菌生长,说明重楼根的表面消毒彻底,后期实验所分离的菌株为内生细菌而不是来源于重楼根表面.本研究将0.1 g重楼根组织悬浮液,涂布于2种细菌培养基进行内生细菌的分离,最终共获得115株内生细菌的单克隆.
2.2 内生细菌的多样性分析
分别扩增各个内生细菌的16S rDNA序列并测序,根据序列比对结果发现,本研究分离的115株内生细菌(表1,图1)归属到3个门(变形杆菌门、放线菌门、厚壁菌门),其中变形菌门(Proteobacteria)为优势门(67.86%);5个纲(γ-变形杆菌纲、β-变形菌纲、α-蛋白细菌纲、放线菌纲、杆菌纲),其中γ-变形杆菌纲(Gammaproteobacteria)为优势纲(66.12%);7个目(假单胞菌目、黄色单胞菌目、肠杆菌目、伯克氏菌目、根瘤菌目、微球菌目、芽胞杆菌目),其中黄色单胞菌目(Xanthomonadales)为优势目(33.9%);11个科(假单胞菌科、黄色单胞菌科、肠杆菌科、莫氏菌科、伯克氏菌科、根瘤菌科、微杆菌科、短杆菌科、拟杆菌科、类芽孢杆菌科、芽孢杆菌科),其中黄色单胞菌科(Xanthomonadaceae)为优势科(33.9%);12个属,其中短食单胞菌属(Stenotrophomonas)包含39株内生细菌,为优势属(33.9%).而肠杆菌属(Enterobacteriaceae)、潘多拉菌属(Pandoraea)、克雷伯氏菌属(Klebsiella)、短杆菌属(Brevibacterium)、类芽孢杆菌属(Paenibacillus)、拟杆菌属(Bacteroides)和波氏菌属(Bosea)都仅包含1株内生细菌(0.87%),为劣势属.
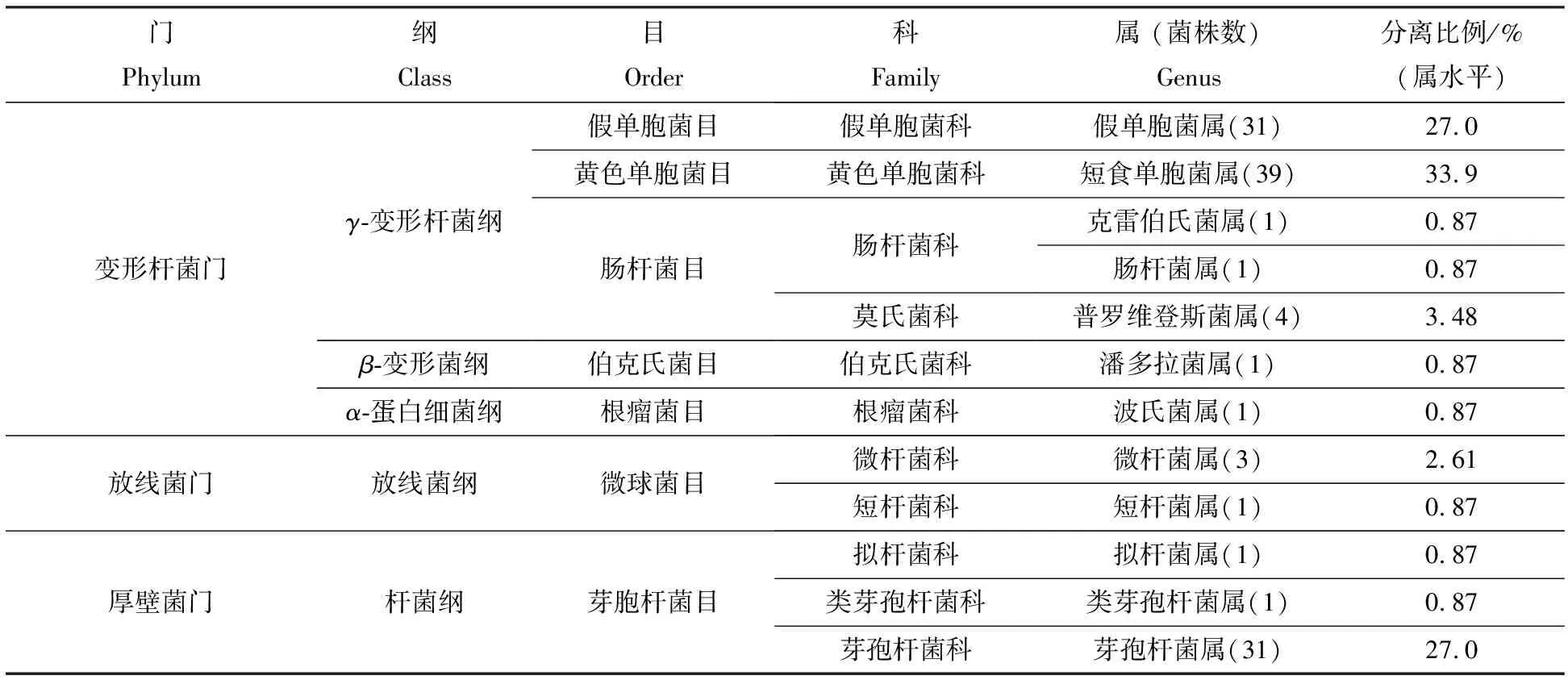
表1 湖北地区种植重楼根组织的内生细菌分类

图1 湖北地区种植重楼根的内生细菌多样性分析
2.3 促生菌的筛选
从包含10株及以上内生细菌的属分类中随机选择5株,小于10株内生细菌的属分类中则选择全部菌株,共计从12个属中选择了29株内生细菌用于共培养实验.根据共培养7 d小麦幼苗的生长情况,发现与其中17株内生细菌共培养的小麦幼苗可以正常生长.
通过测量小麦幼苗的株高、根长、侧根数和鲜重,发现4株内生细菌对小麦幼苗的生长有明显的促进作用(表2),其中HBR11015和 HBR11017菌株属于假单胞菌属,HBR11019菌株属于克雷伯氏菌属,HBR31040菌株属于芽孢杆菌属.HBR11019菌株的促生作用最强,与其共培养的小麦幼苗的株高、根长、鲜重、侧根数目分别是对照的2.6倍、2.1倍、5.7倍和1.0倍,促生作用主要表现在促进株高和鲜重的增加(表2,图2).与HBR31040菌株共培养的小麦幼苗的株高、根长、鲜重、侧根数目分别是对照的2.4倍、1.5倍、2.6倍、1.3倍.与HBR11015菌株共培养的小麦幼苗的株高、根长、鲜重、侧根数目分别是对照的2.1倍、1.6倍、2.0倍和1.0倍.而HBR11017菌株的主要促生作用表现在促进根长和侧根数目的增加,与其共培养小麦幼苗的根长和侧根数目分别是对照的2.2倍和1.7倍(表2,图2).

A)对照; B)、C)分别为与促生菌HBR11019和HBR11017共培养的小麦幼苗

表2 内生细菌对小麦幼苗的促生作用
注:“±”表示标准偏差,不同的字母代表不同的显著性差异(Duncan-test,P<0.05)
3 讨论
不同地理位置(种植区域)影响药用植物的内生菌的结构和分布[11,12],而内生菌的菌群组成又影响了宿主植物的药用物质的合成,这是导致不同种植地的同一品种中药材存在品质差异主要原因之一.周先治等[7]发现福建省南平市华重楼健康植株和茎腐病感病植株的根中分别以芽孢杆菌属和假单胞菌属为优势菌属.魏娟等[5]发现人工栽培的云南重楼根中内生细菌以芽孢杆菌属和肠杆菌属为优势属.本研究从湖北地区种植的5年生重楼的0.1 g根中共分离到115株内生细菌,短食单胞菌属为优势属;其次为假单胞菌属和芽孢杆菌属.另外,耿红、裴婷等[13]从云南地区种植的5年生重楼的0.1 g根中分离到228株内生细菌,优势属为假单胞菌属和芽孢杆菌属.这些结果说明不同地区种植的重楼根部内生细菌的多样性存在差异.本研究结果为深入分析不同产区重楼内生菌的差异以及不同产区(地理位置)对重楼内生菌的菌群结构的影响提供了基础.
Yaish等[14]从椰枣树幼苗的根中分离到的芽孢杆菌属菌株具有促进盐胁迫下枣椰树生长和发育的作用.徐婧等[15]从土壤根际微生物中筛选到一株高产IAA的克雷伯氏菌,具有促进水稻侧根生长作用.而本研究分离的假单胞菌属菌株HBR11017可以促进小麦根的伸长和侧根数目的增加;克雷伯氏菌属菌株HBR11019可以促进株高和鲜重的增加,而对侧根数量的促进作用并不明显.这表明同一属的促生菌可能具有不同的促生效果和机理,而不同属的菌株可能具有相同的促生效果.本研究所发现的促生菌,可为后期开展促生机制研究以及利用促生菌改良重楼种苗繁育技术的研究提供了菌种资源.
