具有抗稻瘟病菌活性的ⅡW1菌株的分离鉴定及其接合转移方法的建立
2020-06-04李晓华冯喆黄粤马婷婷姚家成夏珍珍
李晓华, 冯喆, 黄粤, 马婷婷, 姚家成, 夏珍珍
(中南民族大学 生命科学学院,微生物资源与利用湖北省工程技术研究中心/生物技术国家民委重点实验室,武汉 430074)
水稻是我国乃至世界最重要的粮食作物之一,由子囊真菌引起的水稻稻瘟病[1],严重影响着水稻等多种农作物的产量[2].目前我国农业生产上多采用化学农药对稻瘟病进行防治,但是长时间的使用化学农药不仅成本高,还会对生态环境造成一定的危害[3,4],并使稻瘟病菌产生一定的抗药性[5].利用微生物及其代谢产物来防治稻瘟病[6]成为一种经济环保方法[7].
放线菌次级代谢产物中80%的天然活性物质来源于链霉菌,在农业领域,链霉菌次级代谢产物可作为除草剂、抗菌剂、植物生长调节剂等[8,9],具有见效快、无污染、残留时间短等优点[10].attB位点是链霉菌染色体上的特异性重组位点,利用链霉菌噬菌体ΦC31构建的质粒pSET152,可通过质粒中的attP位点与链霉菌染色体上的attB位点进行特异性重组[11].研究发现,attB/attP位点特异性重组发生交换的核心序列是5′-TT-3′[12].
本文从土壤中分离得到一株具有抗稻瘟病菌的菌株,利用琼脂块法测定该菌株对稻瘟病的抑菌活性,通过形态结构、生理生化和16S rDNA 基因序列同源性比对对ⅡW1菌株进行鉴定;同时对链霉菌ⅡW1菌株attB序列进行克隆,并试图建立接合转移的方法.
1 材料和方法
1.1 材料与仪器
土壤采自湖北省神农架地区.指示菌稻瘟病菌NO-1菌株和168菌株由中南民族大学生命科学学院微生物实验室保藏.
总DNA提取试剂盒(TaKaRa);引物合成、基因测序(武汉天一辉远);参考文献[13]配制高氏Ι号培养基、G+Y培养基、菌丝体培养基、LB培养基、LA培养基、2×YT培养基.
恒温振荡器(THZ-C,太仓市科教器材厂);电热恒温培养箱(DHP-9162,上海齐欣);冷冻离心机(TGL-20bR,上海安亭);分析天平(ALC2100,北京赛多利斯);电子天平(JA1103N,上海民桥);PCR仪(C1000Touch,Bio-Rad);凝胶成像仪(TEL-40,Synoptics);凝胶成像分析仪(JS-2012,上海培清);高压灭菌锅(YXQG02,山东新华区医疗器械厂);超净工作台(SW-CJ-1BU,苏州安泰).
1.2 菌株分离纯化
取土壤样本10 g于三角瓶中,加入90 mL无菌水,30 ℃,180 r·min-1,恒温摇床震荡培养2 h,分别将上述溶液稀释成10-1、10-2、10-3、10-4、10-5不同浓度的土壤悬液,用涂布棒均匀涂布在高氏一号培养基上,30 ℃恒温箱倒置培养4 d,经多次挑单菌纯化后,收集生长良好的孢子,-20 ℃保存.
1.3 IIW1菌株抑菌活性检测
利用琼脂块法[14]测定ⅡW1 菌株的抑菌活性,十字测量法测量抑菌圈直径.
1.4 菌种鉴定
提取ⅡW1总DNA[15],以总DNA为模板,使用16S rDNA通用引物扩增16S rDNA片段.PCR反应条件为:95 ℃,5 min;56 ℃,30 s;72 ℃,30 s;30个循环.将扩增得到的16S rDNA片段测序,序列同源性比对分析,构建16S rDNA系统进化树.结合形态结构和生理生化进行鉴定[14].
1.5 ⅡW1菌株 attB 序列的PCR扩增
以ⅡW1菌株总DNA为模板,PCR反应条件[16]为:95 ℃,5 min;56 ℃,30 s;72 ℃,30 s;30个循环.将扩增链霉菌ⅡW1的attB位点序列测定,序列同源性比对分析.
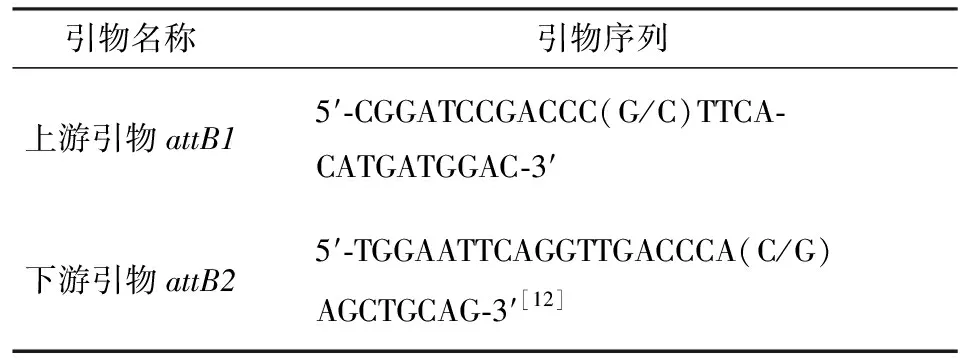
表1 PCR引物序列
1.6 ⅡW1菌株接合转移
质粒通过两亲接合转移法[17,18]从大肠杆菌ET12567/pUZ8002导入到ⅡW1菌株,30 ℃恒温培养4 d,观察接合转移子的数量.
2 结果和分析
2.1 ⅡW1菌株的分离
以稻瘟病菌NO-1菌株和168菌株为指示菌,以琼脂块检测ⅡW1菌株对稻瘟病菌NO-1菌株和168菌株的抑菌活性,结果由图1可见:ⅡW1菌株对稻瘟病菌NO-1菌株的抑菌圈平均直径为29.7 mm,对稻瘟病菌168菌株的抑菌圈平均直径为27.4 mm.表明ⅡW1菌株稻瘟病菌NO-1菌株和168菌株具有一定的抑菌活性.
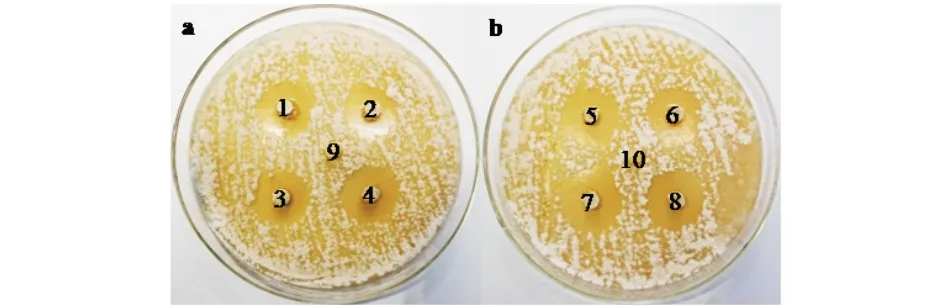
1~8)ⅡW1菌株菌块;9,10)琼脂块作为空白对照;a)稻瘟病菌NO-1菌株;b)稻瘟病菌168菌株
2.2 ⅡW1菌株的鉴定
将ⅡW1菌株接种到高氏Ⅰ号培养基上,30 ℃培养4 d,观察到ⅡW1菌株气生菌丝和基内菌丝均呈灰白色.经革兰氏染色、甲基红试验等测定,发现ⅡW1菌株为革兰氏阳性菌株,具有水解淀粉的能力,ⅡW1菌株甲基红检测为阳性.
提取ⅡW1菌株的总DNA,PCR扩增其16S rDNA片段,测序发现该片段长度为1385 bp.在NCBI数据库中对ⅡW1菌株16S rDNA序列进行同源性分析显示,ⅡW1株菌的16S rDNA序列与链霉菌属菌种的16S rDNA序列具有高度的同源性.在MEGA软件中进行多序列比对构建系统进化树,结果发现ⅡW1菌株与Streptomycespseudogriseolusstrain YR-37(KY753277.1)同源性相似度达到98%,初步鉴定ⅡW1株菌属假灰色链霉菌,如图2所示.

图2 ⅡW1株菌16S rDNA序列系统进化树
2.3 假灰色链霉菌ⅡW1菌株的 attB 位点的克隆与分析
以假灰色链霉菌ⅡW1菌株的总DNA为模板,以一对引物attB1/attB2扩增attB位点序列,结果见图3.
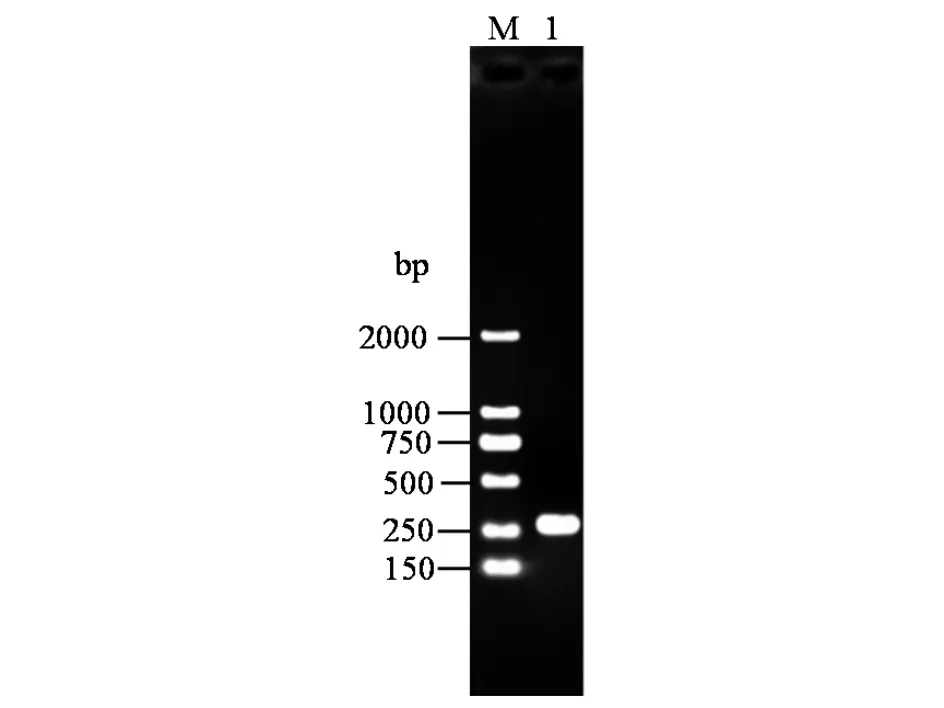
)DL2000 Maker;1)假灰色链霉菌ⅡW1菌株attB PCR扩增产物
如图3所示:获得到一条DNA片段,大小为270 bp.测序结果表明,假灰色链霉菌ⅡW1菌株的attB位点序列长度为245 bp.
将假灰色链霉菌ⅡW1菌株的attB位点序列放入NCBI数据库中,比对结果如图4所示,多个小单孢菌和链霉菌的attB位点序列与假灰色链霉菌ⅡW1菌株的attB位点核心序列相似性较高,整个序列核心区高度保守,假灰色链霉菌ⅡW1菌株的attB位点核心序列中有发生位点特异性重组的5′-TT-3′序列,表明假灰色链霉菌ⅡW1菌株染色体上含有attB位点.
2.4 假灰色链霉菌ⅡW1菌株与大肠杆菌的接合转移
为确定可用于假灰色链霉菌ⅡW1菌株进行遗传操作的筛选标记,检测了ⅡW1菌株对氯霉素、卡那霉素、阿泊拉霉素和萘啶酮酸几种抗生素的抗性水平,结果显示:在1~30 μg·mL-1氯霉素范围内,ⅡW1菌株正常生长;当氯霉素浓度达到 40 μg·mL-1时,ⅡW1菌株不生长;卡那霉素、阿泊拉霉素浓度为1 μg·mL-1时,ⅡW1菌株就不能生长;浓度为40 μg·mL-1的萘啶酮酸对ⅡW1菌株的生长无影响.表明链霉菌ⅡW1菌株对卡那霉素、阿泊拉霉素敏感,对萘啶酮酸不敏感.
根据质粒pSET152具有阿泊拉霉素抗性基因的特性,将供体大肠杆菌ET12567(pUZ8002)菌株与假灰色链霉菌ⅡW1菌株菌丝体混合,涂布在平板上,30 ℃恒温培养14 h,以阿泊拉霉素覆盖作为抗性筛选标记覆盖于平板上,在30 ℃恒温培养箱中培养5 d,可得到对阿泊拉霉素具有稳定抗性的假灰色链霉菌ⅡW1菌株的接合转移子.以接合转移子总DNA为模板,使用引物attL-F,attL-R扩增,结果如图5所示,得到一段大小为353 bp的片段,以假灰色链霉菌ⅡW1菌株原始菌株总DNA为模板,PCR扩增无法得到相同片段,则表明质粒pSET152可以通过接合转移整合至假灰色链霉菌ⅡW1菌株的染色体上.

图4 假灰色链霉菌IIW1菌株attB位点序列比对
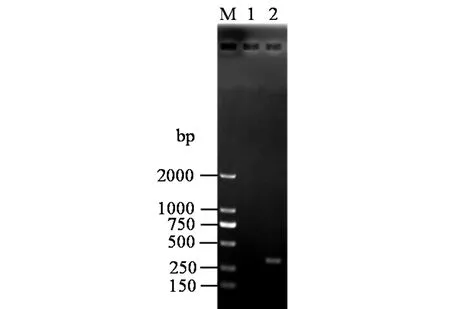
M)DL2000 Marker;1)假灰色链霉菌ⅡW1菌株PCR产物;2)假灰色链霉菌ⅡW1菌株的接合转移子PCR产物
3 讨论
链霉菌的次级代谢产物是一类非常重要的微生物资源,在稻瘟病的生物防治方面具有很大潜力.本文从湖北省神农架地区土壤中筛选出一株抗稻瘟病菌的ⅡW1菌株,研究表明,ⅡW1菌株对稻瘟病NO-1菌株及稻瘟病168菌株具有较强的抑菌作用,抑菌圈直径分别为29.7 mm和27.4 mm.文献报道S.vinaceusdrappus、S.philanthiRM-1-138、S.griseofuscus、S.hygroscopicus、Streptomycessp.339、S.flavotricini、S.sysdeneusis263[19]、S.globisporusJK-1[20]都表现出一定的抗稻瘟病活性.但目前具有抗稻瘟病活性的假灰色链霉菌尚未发现有文献报道.PCR扩增得到ⅡW1菌株16S rDNA片段大小为1385 bp,对序列进行生物信息学分析,发现ⅡW1菌株的16S rDNA基因与假灰色链霉菌的同源性在98%以上,初步鉴定ⅡW1属于假灰色链霉菌.链霉菌ⅡW1菌株的attB位点序列长度为245 bp,对序列分析发现假灰色链霉菌ⅡW1菌株的attB位点中核心序列是5′-TT-3′,位点的序列比对结果表明,假灰色链霉菌ⅡW1菌株的attB位点与多个小单孢菌和链霉菌的attB位点同一性较高,其中与StreptomycesrimosusR7的位点同一性高达96%以上.
选用阿泊拉霉素为假灰色链霉菌ⅡW1菌株接合转移的抗性筛选标记,根据pSET152质粒的特性,将假灰色链霉菌ⅡW1菌株与大肠杆菌进行属间接合转移,获得接合转移子,该转移子是具有阿泊拉霉素稳定抗性的假灰色链霉菌ⅡW1菌株.结果表明,通过接合转移可以将质粒pSET152整合到假灰色链霉菌ⅡW1菌株的染色体上.
