Flavaglines类化合物对人白血病HEL细胞的作用及机制*
2020-06-03龙群肖潇宋晶睿饶青苑春茂何志旭李艳梅
龙群, 肖潇, 宋晶睿, 饶青, 苑春茂, 何志旭, 李艳梅**
(1.贵州医科大学 基础医学院 免疫教研室 & 组织工程与干细胞实验中心, 贵州 贵阳 550004; 2.贵州医科大学 省部共建药用植物功效与利用国家重点实验室, 贵州 贵阳 550014; 3.贵州省中国科学院天然产物化学重点实验室, 贵州 贵阳 550014)
白血病是由于基因突变导致造血干细胞或造血祖细胞恶性克隆增生的一种血液肿瘤,全世界每年至少有54 000人被诊断为白血病,5年存活率低于60%;据2018年全球数据表明,960万癌症相关死亡病例中白血病死亡病例占比3.2%[1-2]。白血病对人类健康的威胁主要是因为恶性增殖、凋亡受阻和分化障碍等因素可形成白血病细胞,而后在骨髓和肝脾等组织器官中大量增殖、广泛浸润,最终导致白血病患者出现贫血、出血、发热、易感染、肝脾淋巴结肿大及疼痛等临床表现[3]。目前白血病主要有化学治疗、放射治疗、靶向治疗、免疫治疗及干细胞移植等治疗方法[4-5],部分白血病患者的预后可以得到极大的改善,相当多的患者可获得治愈或者长期稳定缓解;但也有部分病人在临床治疗过程中会复发、药物抗性和发生其它副作用[6],因此白血病的治疗仍然是大家关注的重点之一。科学家正不断探索新的针对白血病的化疗药物,其中靶向猫肉瘤病毒麦克唐纳株[Feline sarcoma virus (strain McDonough),FMS]样的酪氨酸激酶3(Fms-like tyrosine kinase 3,Flt3)的米哚妥林(protein kinase C 412,PKC412)已于2017年获得批准上市[7],另外靶向丝裂原活化蛋白激酶(MAPK/Erk kinase , MEK)、B淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2)基因、肿瘤蛋白53(tumour protein 53, TP53)、信号转导及转录激活蛋白(signal transducer and activator of transcription,STAT)等抑制剂药物也正在研究中[8-9]。Flavaglines是一类具有环戊烷苯并呋喃骨架的复杂天然产物[10],在肿瘤细胞中具有良好活性,但是对非肿瘤细胞却几乎没有毒性或是毒性很小[11-12],因此受到了化学家和生物学家的广泛关注。虽然Flavaglines在肿瘤细胞中的活性报道已经很多,但其对白血病中的作用机制研究并不多,尤其是在人白血病细胞系(human erythroleukemia,HEL)细胞中的研究更少,因此本研究主要对Flavaglines类化合物(M8、M9)在白血病HEL细胞中抑制增殖的作用及机制进行初步研究,以扩大抗白血病药物研究的药库。
1 材料和方法
1.1 材料
1.1.1化合物及细胞株 Flavaglines(M8和M9)由贵州省中国科学院天然产物化学重点实验室苑春茂老师课题组合成,阿霉素(10 mg/支)购于中国碧云天公司;HEL细胞由加拿大多伦多大学惠赠。
1.1.2主要试剂和仪器 胎牛血清购于美国VACCA公司,RPMI1640培养基购于美国Giboc公司,二甲基亚砜(dimethyl sulfoxide,DMSO)购于上海Sangon公司,四唑盐(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)试剂、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、细胞裂解液(immunol precipitation, IP)及蛋白酶抑制剂(phenylmethylsulfonyl fluoride, PMSF)购于北京索莱宝公司,Annexin V-FITC凋亡检测试剂盒购于美国BD公司,Bcl-2及c-Myc抗体购于美国Abcam公司,Caspase 3和磷酸化信号传导与活化转录因子3(phosphorylated signal transducer and activator of transcription 3,p-Stat3)购于美国CST公司,GAPDH(glyceraldehyde-3-phosphate dehydrogenase)购于中国正能;3111细胞培养箱和1384型A2型超净工作台购于美国Thermo公司,Axio Vert A1倒置显微镜购于美国ZEISS公司,Synergy 2Multi-ModeReader多功能酶标仪购于美国BioTek公司,NovoCyte 2040R流式细胞仪购于美国ACEA公司。
1.2 方法
1.2.1HEL细胞培养 HEL细胞使用含5%血清的培养基于37 ℃、5%CO2的培养箱中培养。
1.2.2MTT法检测化合物活性 取处于对数生长期的HEL细胞计数均匀铺板于96孔板中,细胞浓度为6 000个/孔;阳性对照药阿霉素(0.100、0.050、0.030、0.010及0.006 μmol/L)、化合物M8(0.20、0.10、0.05、0.03及0.01 μmol/L)和M9(2.50、1.25、0.63、0.30及0.16 μmol/L),分别对HEL细胞作用72 h后,加入MTT试剂10 μL,培养箱中反应4 h,3 000 r/min离心30 min,吸尽多余液体后再加入二甲基亚砜溶解结晶160 μL;用多功能酶标仪在490 nm吸收光处读取吸光度值(optical delnsity,OD),计算各浓度药物对HEL细胞的抑制率[抑制率(%)=(对照组OD-治疗组OD)/对照组OD×100%],运用Forecast通过抑制率计算半抑制浓度(50% inhibiting concentration,IC50)。
1.2.3流式细胞仪检测细胞凋亡 取处于对数生长期的HEL细胞计数铺板于6孔板中,细胞浓度为20×107个/L;根据1.2.2项下IC50分别设置化合物M8为0.20、0.05及0.02 μmol/L,化合物M9为1.00、0.50及0.25 μmol/L,均以DMSO组为对照,分别培养24、48及72 h;收集细胞,预冷PBS洗2次,采用Annexin V-FITC/PI 双染法在流式细胞仪上检测HEL细胞的凋亡率。
1.2.4Western blot检测HEL细胞相关蛋白的表达 在HEL细胞生长到对数生长期时,收集细胞计数铺板于60 mm×60 mm的小皿中,细胞浓度为50×107个/L。药物组设置M8(0.20 μmol/L)和M9(1.00 μmol/L),以DMSO为对照组,处理HEL细胞24 h后收集细胞,预冷PBS充分洗掉培养基;加蛋白酶抑制剂的IP裂解液(IP ∶PMSF=100 ∶1)冰上裂解30 min,12 000 r/min离心10 min,去除絮状沉淀;BCA蛋白定量试剂盒测定提取的蛋白浓度,确定上样量;用5×SDS buffer,95 ℃变性5 min;按蛋白质分子量进行100 V SDS-PAGE电泳120 min,胶上的蛋白质用220 mA的恒流,120 min 转到PVDF 膜,3%BSA室温封闭1 h,孵育一抗Bcl-2、Caspase3、p-Stat3、c-Myc及GAPDH(4℃过夜);孵育一抗完成后用1×TBS洗3次,室温敷二抗2 h(慢摇),用1×TBS洗3次后用Odyssey 红外成像仪上扫膜分析蛋白表达情况。
1.3 统计学分析

2 结果
2.1 化合物M8和M9的活性
化合物M8、M9的结构如图1所示,以环戊烷苯啶呋喃为基本骨架,R1=OH为化合物M8,R1=CL为化合物M9;MTT法检测结果显示,化合物M8(0.20、0.10、0.05、0.03及0.01 μmol/L)、M9(2.50、1.25、0.63、0.30及0.16 μmol/L)及阿霉素(0.100、0.050、0.030、0.010及0.006 μmol/L)对HEL细胞作用72 h后,对HEL细胞的抑制率均随浓度的增加而增高(P<0.05或P<0.01);通过计算,化合物M8、M9及阿霉素的IC50值分别为(0.02±0.010)μmol/L、(0.21±0.060)μmol/L及(0.06±0.001)μmol/L,与阿霉素和化合物M9比较,化合物M8在HEL细胞中的IC50值较小(P<0.01)。见图2。
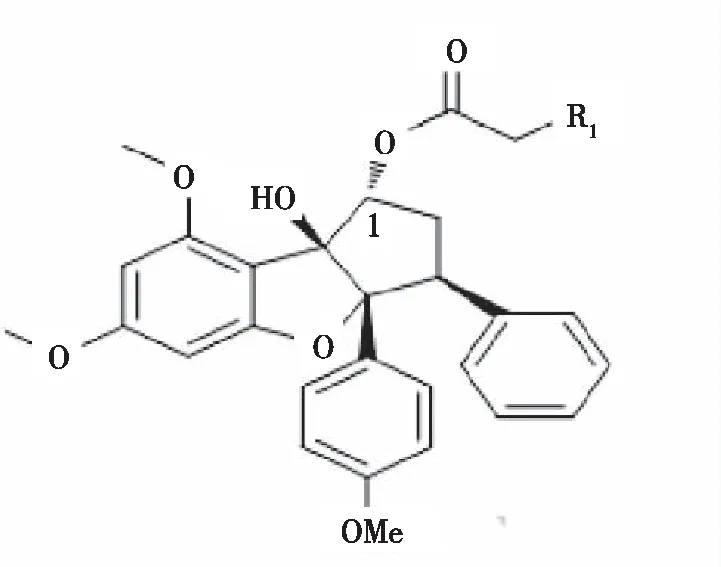
注:R1=OH,为M8;R1=Cl,为M9。
图1 化合物M8和M9的结构
Fig.1 Structure of compounds M8 and M9

注:与DMSO组比较,(1)P<0.05,(2)P<0.01。
图2 阿霉素、化合物M8、M9对HEL细胞作用72 h后的抑制率
Fig.2 Cell growth inhibition rates of doxorubicin, compounds M8 and M9 on HEL cells after 72 h of treatment
2.2 化合物M8和M9对HEL细胞凋亡的影响
流式细胞检测结果显示,与各时间点DMSO组比较,化合物M8和M9组HEL细胞的凋亡率均随浓度的增加而增高(P<0.05或P<0.01)。见图3和图4。
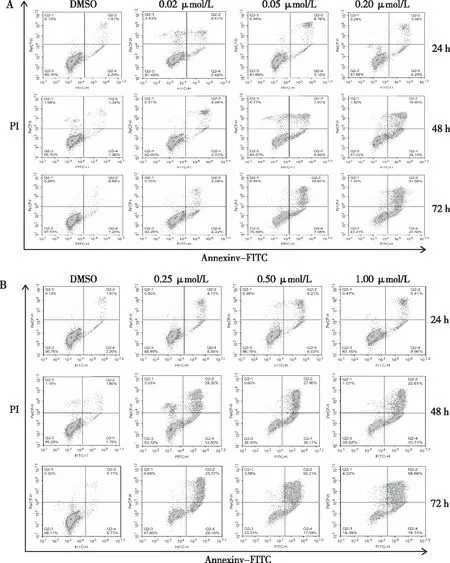
注:A为M8,B为M9。
图3 化合物M8和M9对HEL细胞作用24、48及72 h时的流式细胞仪凋亡检测结果
Fig.3 Apoptosis rates of compounds M8 and M9 on HEL cells after 24,48 and 72 h of treatment
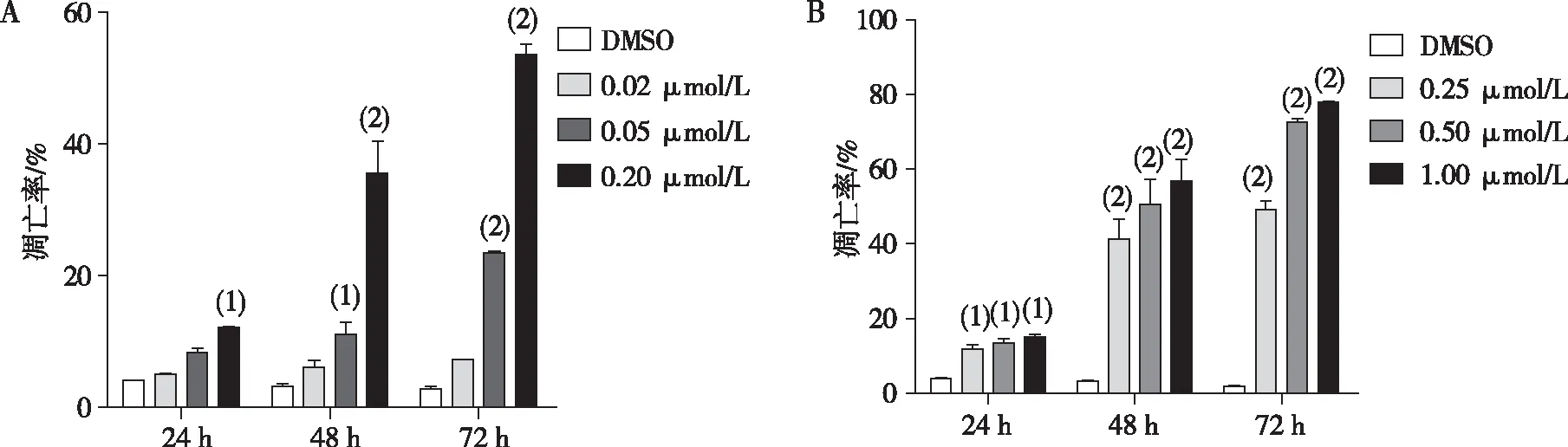
注:A为M8,B为M9;与DMSO组比较,(1)P<0.05,(2)P<0.01。
图4 化合物M8和M9对HEL细胞作用24、48及72 h的细胞凋亡
Fig.4 Apoptosis rates of compounds M8 and M9 on HEL cells after 24,48 and 72 h of treatment
2.3 化合物M8和M9对HEL细胞相关蛋白的影响
Western blot结果显示,与DMSO组比较,化合物M8(0.20 μmol/L)和M9(1.00 μmol/L)组HEL细胞中Bcl-2、Caspase3、p-Stat3及c-Myc蛋白的表达减少(P<0.05或P<0.01),Cleave-Caspase3蛋白明显增加(P<0.01)。见图5。
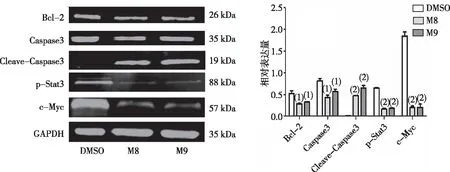
注:A为Western blot检测结果;B为蛋白相对表达量直条图;与DMSO组比较,(1)P<0.05,(2)P<0.01。
图5 化合物M8和M9作用24 h后HEL细胞相关蛋白的表达
Fig.5 Expression levels of related proteins of compounds M8 and M9 on the on HEL cells after 24 h of treatment
3 讨论
本研究结果显示,化合物M8、M9及阳性对照药阿霉素对HEL细胞作用72 h后,抑制HEL细胞增殖的抑制率均随浓度的增加而增高,与DMSO组比较,差异有统计学意义(P<0.05 或P<0.01),72 h的IC50值分别为(0.02±0.010)μmol/L、(0.21±0.060)μmol/L及(0.06±0.001)μmol/L,与阿霉素和M9比较,化合物M8在HEL细胞中的IC50值较小(P<0.01),提示化合物M8在HEL细胞中的活性优于阳性对照药阿霉素及化合物M9;流式细胞仪结果显示,化合物M8、M9对HEL细胞分别作用24、48及72 h后均能促进HEL细胞发生凋亡,凋亡率也随浓度的增加而增高,与各时间点DMSO组比较,差异有统计学意义(P<0.05或P<0.01),提示化合物M8、M9可以通过促进HEL细胞凋亡发挥抗白血病作用。在蛋白水平上,化合物M8、M9能够抑制Bcl-2、Caspase3、p-Stat3及c-Myc蛋白的表达(P<0.05或P<0.01),并使Cleave-Caspase3明显增多(P<0.01),说明化合物M8、M9可通过调控Stat3/c-Myc信号通路来促进白血病HEL细胞凋亡。
已知,Bcl-2蛋白是细胞内源性凋亡的主要调节因子,与线粒体损伤的细胞凋亡密切相关[13]。事实上,Bcl-2已经成为刺激各种癌细胞凋亡的最有价值的靶点之一[14-15]。如靶向Bcl-2的ABT-737、Navitoclax和Venetoclax等小分子抑制剂在体内和体外都显示了良好的疗效[16-17]。而Caspase3的激活则是启动凋亡程序的必经之路[18]。由此可见,Flavaglines(M8和M9)可通过下调抗凋亡蛋白Bcl-2来激活Caspase3蛋白,从而促进白血病HEL细胞凋亡,而不是细胞坏死。凋亡是细胞的一种程序性死亡,与细胞坏死不同,凋亡细胞发生形态学变化,如细胞皱缩、核凝结、DNA断裂及膜泡形成等,但不破坏细胞膜的完整性,对细胞周围产生的炎症反应很轻[19],这在肿瘤的治疗上具有重要意义,因此目前很多抗肿瘤药物的研究都是从诱导肿瘤细胞凋亡的机制入手[20-22]。
在前期的研究中,Flavaglines主要是通过抑制翻译起始因子eIF4A调控MAPK信号通路,从而诱导肿瘤细胞凋亡[23-24],但本研究结果显示化合物M8和M9可以使p-Stat3明显减少(P<0.01)。已知,Stat3是一种信号传导活化转录因子,在细胞中起到传递信号和启动基因转录的双重作用[25],Stat3信号异常可通过抑制细胞凋亡,诱导细胞增殖、血管生成、侵袭和转移,诱发炎症等促进肿瘤的发生和进展,更关键的是在肿瘤耐药方面中扮演了重要角色[26]。许多研究已证明Stat3在白血病、乳腺癌、胃癌及肺癌等多种人类肿瘤中过度激活,并与预后相关[25-28]。因此,鉴定和开发靶向抑制Stat3激活的新型药物已经成为一个肿瘤治疗的方向[29]。本研究结果还显示,M8和M9可以明显抑制c-Myc蛋白的表达(P<0.01)。c-Myc蛋白是一种经典的原癌蛋白,在造血干细胞的自我更新、增殖、分化中起重要调控作用,但在大多数肿瘤中过度表达[30];同时c-Myc蛋白又是由Stat3下游靶点基因c-myc编码表达的蛋白质,因此抑制p-Stat3/c-Myc的表达,对肿瘤的治疗尤其是白血病的治疗具有重要意义[31]。
综上所述,Flavaglines化合物M8、M9对白血病HEL细胞均具有良好的活性,且M8活性优于阳性药阿霉素和M9;初步探讨了Flavaglines化合物M8、M9作用于Stat3/c-Myc信号通路促进白血病HEL细胞凋亡的机制,提示化合物M8、M9在抗白血病治疗中具有潜在的应用价值,其具体的抗白血病分子机制值得进一步研究。
