乳腺癌微钙化与ER、PR及HER-2表达相关性研究
2020-06-03李冬芹陈伟志
李冬芹,陈伟志
(锦州医科大学附属第一医院放射科,辽宁 锦州 121000)
乳腺癌是我国女性恶性肿瘤发病率最高的肿瘤,且逐年增加,是女性癌症死亡的主要原因。有文献[1]报道,我国女性乳腺癌的发病率和死亡率分别居女性恶性肿瘤发病第1位、死亡第6位。近年来,随着乳腺癌患者治疗方案的改善以及检出率的提高,患者的死亡率在逐步下降。微钙化是乳腺癌钼靶特征性表现,大约 30%~70%的乳腺癌患者发现钙化灶,钙化的高发生率、乳腺X线的筛查及对钙化的灵敏性提高了乳腺癌患者的检出率[2]。乳腺癌的发生、发展和转移是一个极其复杂的生物学过程,是多因素、多基因、多步骤突变的结果。雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人类皮生长因子受体-2(human epidermal growth factor recepto-r 2,HER-2)是目前最常用的乳腺癌生物学标记物,它们的表达对乳腺癌患者行内分泌治疗、化疗或靶向治疗的选择至关作用,而且可以预测预后[3],但这些因子的检测是有创的,结果是滞后的,因此本文通过分析乳腺癌微钙化特征与ER、PR及HER-2表达关系,以期寻找一种无创方法预测乳腺癌预后因子的表达。
1 资料与方法
1.1 临床资料 收集本院2017年9月至2018年12月经穿刺或手术病理证实的乳腺癌患者152例,其中浸润性导管癌133例,导管原位癌8例,其它类型癌11例。年龄29~80岁,中位年龄53岁。纳入标准:(1)均为女性;(2)术前均行乳腺X线检查;(3)术前均未行放、化疗、内分泌或靶向治疗;(4)病灶单侧单发;(5)术后均经病理证实为乳腺癌;(6)未发生远处转移及无其它肿瘤病史;(7)术后均行免疫组织化学(immunohistochemistry,IHC)染色,并检测ER、PR及HER-2的表达水平。
1.2 检查方法 应用Planmed nuance 全数字化乳腺X光机,对患者常规行内外斜位(medial lateral oblique,MLO)和头足位(cranio caudul,CC)投照,如果病灶显示不清,行点压或放大摄影。
1.3 影像诊断标准及分组 参照2017年版本BI-RADS[4]的诊断标准,在放射科(picture archiving and communication system,PACS)系统搜索,并记录微钙化征象。分组:(1)按是否有微钙化分为有和无2组;(2)微钙化组按分布分为集群、区域状和线样或段样3组;(3)微钙化组按形态分为不定形、粗糙不均质、细小多形性、细线或细线分支状和混合5组。由两位影像科高年资医师在PACS上进行双盲法阅片,当诊断结果不一致时,由第三人参与共同协商后做出结论。
1.4 免疫组化 所有患者的穿刺或手术标本均通过10%的甲醛固定,行石蜡包埋,4 μm连续切片,贴在载玻片上,采用链霉菌抗生物蛋白-过氧化物酶法(streptomyces antibioprotein-peroxidase method,SP),采用磷酸缓冲盐溶液(phosphate buffer salin,PBS)代替一抗作为阴性对照。ER及PR判读参照李世超等[5]发布的检测指南,ER/PR结果判定:≥1%的肿瘤细胞核染色为阳性表达;<1%为阴性表达。HER-2判读参照Wolff AC等[6]发布的HER-2检测指南,其中HER-2:0、1+为阴性,3+为阳性,2+需行荧光原位杂交技术(fluorescence in situ hybridization,FISH)检测基因是否扩增,扩增者并入HER-2阳性组,未扩增者并入HER-2阴性组。
1.5 统计学方法 采用 IBM SPSS 22.0软件进行统计分析,采用χ2检验,如果有频数小于5,则用Fisher确切概率法,以P0.05为差异有统计学意义。
2 结 果
2.1 乳腺癌X线资料 本组152例,微钙化集群分布45例(48.91%),区域状分布32例(34.78%),线样或段样分布15例(16.30%);不定形24例(26.09%),细小多形性30例(32.61%),粗糙不均质9例(9.78%),细线样或细线分支状4例(4.35%)和混合25例 (27.17%),见图1、图2及图3。
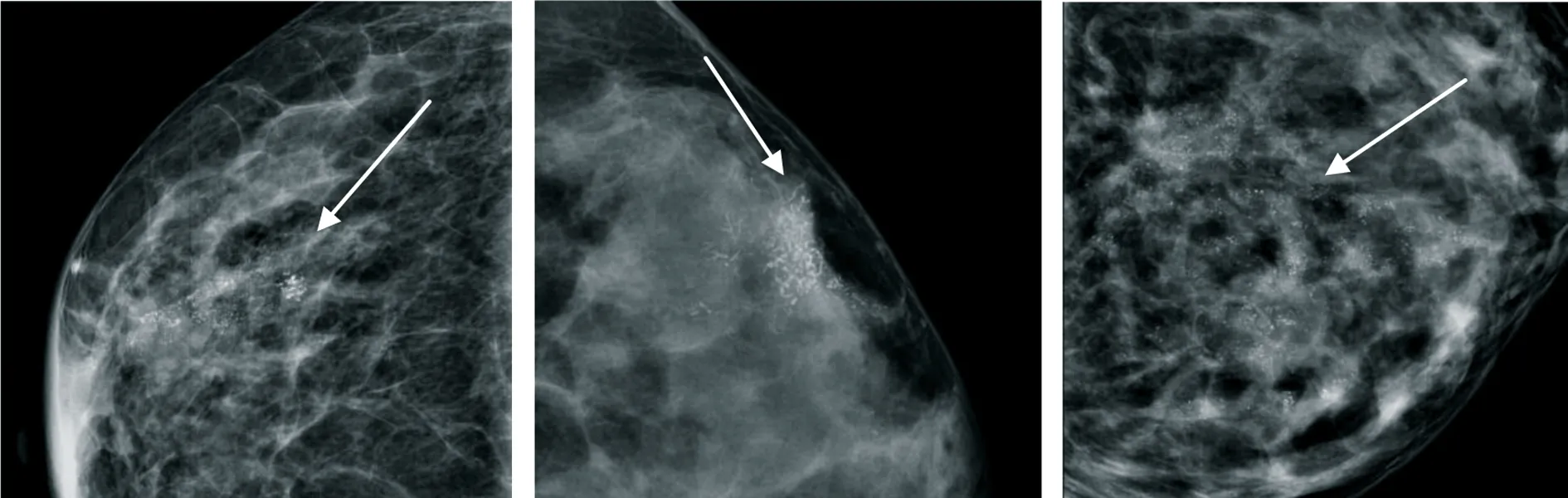
图1右乳外象限段样分布混合钙化
图2左乳外象限区域分布细线或细线分支状钙化
图3左乳内象限区域分布细小多行性钙化
2.2 乳腺癌ER、PR及HER-2表达 本组152例,ER阳性104例(68.42%),见图4;ER阴性48例(31.58%)。PR阳性99例 (65.13%),见图5;PR阴性53例 (34.87%)。 HER-2阳性62例(40.79%),HER-2阴性90(59.21%),其中HER-2为0的43例(28.29%),1+22例(14.47%),2+无扩增25例(16.45%),2+有扩增11例(7.24%),3+51例(33.55%),见图6。
2.3 乳腺癌微钙化与ER、PR及HER-2表达相关性 乳腺癌微钙化的存在、分布及形态与ER和PR表达无关,差异无统计学意义(P>0.05),见表1。

图4 ER(阳性,IHC200)肿瘤细胞核呈棕黄色
图5 PR(阳性,IHC200)肿瘤细胞核呈棕黄色
图6 HER-2(阳性,IHC200)肿瘤细胞膜呈强、完整棕黄色
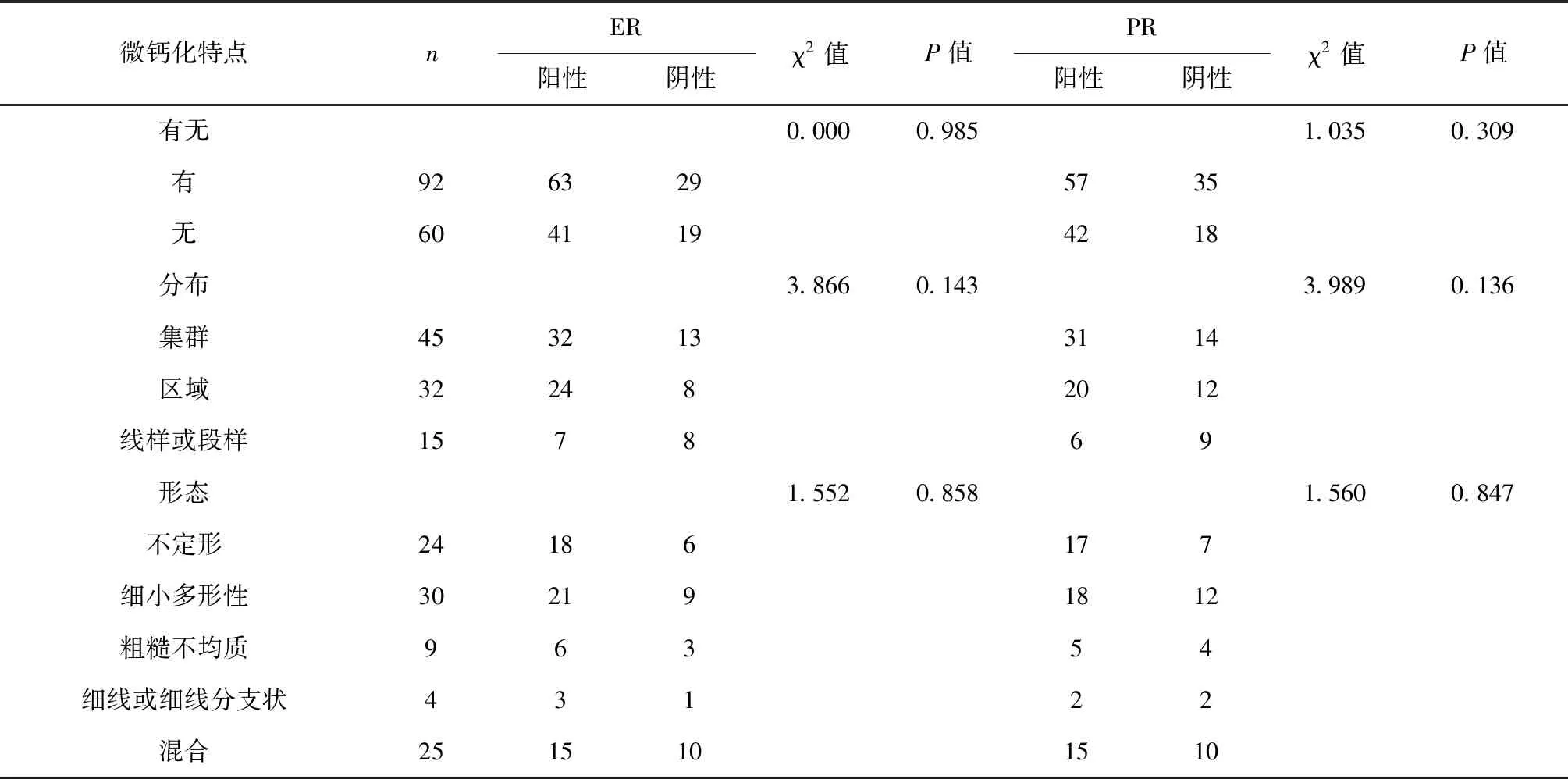
表1 乳腺癌微钙化与ER、PR表达关系
注:P<0.05,差异有统计学意义
微钙化的存在、分布及形态与HER-2表达有关,差异有统计学意义(P<0.05)。微钙化组HER-2阳性表达率48.9%(45/92)高于无微钙化组28.3%(17/60),差异有统计学意义(P<0.05);线样或段样分布组HER-2阳性表达率80.0%(12/15)高于集群分布组37.8%(17/45)及区域状分布组50.0%(16/32),集群分布组HER-2阴性表达率62.2%(28/45)高于区域状分布组50.0%(16/32)及线样或段样分布组20.0%(3/15),差异有统计学意义(P<0.05);不定型及粗糙不均质钙化组HER-2阴性表达率较高,分别为75%(18/24)和 77.8%(7/9),细线或细线分支状组HER-2阳性表达率100%,差异有统计学意义(P<0.01),见表2。
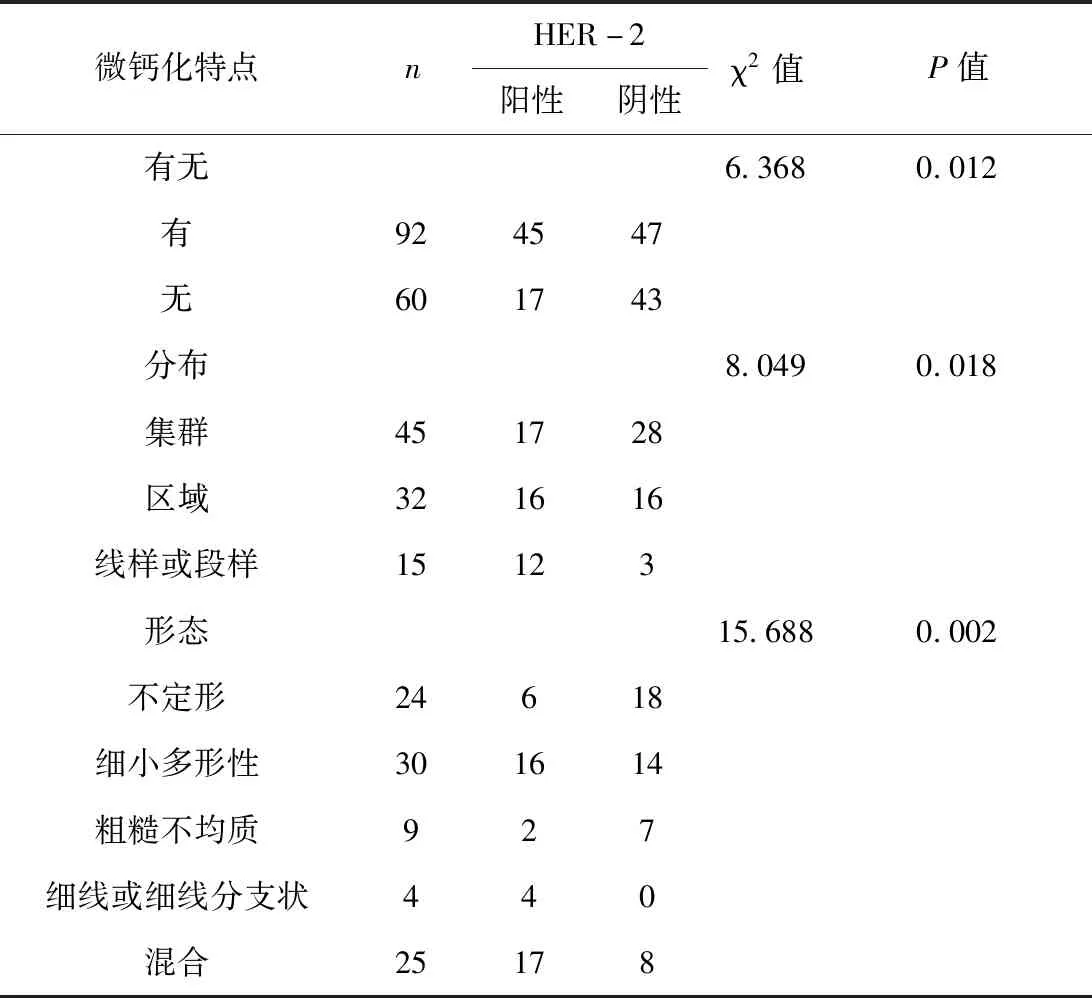
表2 乳腺癌微钙化与HER-2表达关系
3 讨 论
乳腺X线摄影因其操作简单、方便、无创、价格低廉、诊断准确率高等优点,成为乳腺癌患者首选的检查方法,特别是对钙化敏感,使得微钙化成为乳腺癌极为重要的X线征象,甚至是唯一的恶性征象。乳腺钙化分为两种类型,I型草酸钙,II型磷酸钙,主要成分是羟基磷灰石钙化(hydroxylapatite,HA),I型多见于乳腺良性病变内,很少见于恶性肿瘤,II型于良性和恶性病变均可见。乳腺癌发生钙化的原因尚不清楚,传统认为是肿瘤细胞迅速生长,导致局部的细胞缺血坏死后,使磷酸增高,并与血清中的钙沉积形成磷酸钙。近年来多认为与肿瘤细胞自身分泌钙导致钙盐沉积有关,也有研究表明骨基质蛋白参与乳腺癌微钙化的形成[7]。越来越多的研究表明,乳腺癌表现出钼靶钙化比不表现出钙化在生物学上更具侵袭性。Qi X等[8]报道,含有钙化的乳腺癌患者局部复发率高,容易发生远处转移及淋巴结转移,从而导致较高的死亡率。
乳腺是性激素的靶器官,ER、PR参与调节乳腺上皮细胞的生长和发育。ER在乳腺癌转移中起保护作用,ER阴性的乳腺癌易转移,PR的表达标志着ER功能的完整,PR阳性患者内分泌治疗更敏感。当细胞发生癌变时,ER、PR出现部分或全部缺失,当细胞仍然保留ER、PR,说明乳腺癌细胞的生长及增殖仍受内分泌调控,对内分泌治疗反应较好。研究表明ER、PR阳性者对内分泌治疗的效果更敏感,其总体有效率可达60%~70%,而 ER、PR均为阴性时有效率不足10%[9]。有文献表明乳腺癌组织中ER表达阳性率为50%~60%,PR为40%~50%[10]。本文中ER阳性104例,占68.42%,PR阳性99例,占65.13%,均高于这一结果,分析原因可能与本文多为浸润性导管癌、样本量少或乳腺癌本身的异质性有关。
HER-2是表皮生长因子受体家族的一员,又称c-erB-2或neu,属原癌基因,位于17q12-21.32号染色体上。HER-2是判断乳腺癌预后的重要指标,其阳性表达者肿瘤恶性程度较高,容易转移及复发,与患者预后不良密切相关,其发生机制为HER-2的表达触发下游信号通路,引起下游蛋白磷酸化,进而调节肿瘤细胞增殖、凋亡、侵袭、转移及血管生成[11]。HER-2阳性的乳腺癌对内分泌治疗反应差,对化疗药物耐药,临床上首推化疗及抗HER-2靶向治疗。研究也表明靶向治疗(曲妥珠单抗)联合化疗对 HER-2阳性的乳腺癌有较好的治疗效果,显著提高患者的无病生存期,成为现在标准的辅助治疗模式[12]。Dawood S等[13]报道乳腺癌HER-2 阳性率为20%~30%,本研究中乳腺癌的HER-2阳性率为40.79%(62/152),高于文献报道的原因可能与本文样本量少、HER-2判断标准不一致或乳腺癌本身的异质性有关。
本研究结果显示乳腺癌微钙化的存在与HER-2表达有关,提示含有钙化的乳腺癌恶性程度高,预后不良。近年SPCA2-Orai1作为一种钙库非依赖型的钙内流通道被发现,分泌途径衍生钙离子转运ATP酶(secretory pathway Ca2+ATPases,SPCA),将Ca2+和Mn2+转运至高尔基体并进行蛋白质分类、加工和糖基化,其亚型SPCA2具有相似的转运特性,主要在乳腺上皮细胞表达,并在乳腺癌的肿瘤细胞中呈高表达,异常升高的SPCA2可以使HER-2开放Orai1通道使Ca2+被储存[14],这可能是微钙化与HER-2阳性表达有关的发生机制。大多数研究[15]报道乳腺癌钙化的显示与HER-2过表达相关。但也有学者认为乳腺癌微钙化的显示与HER-2表达无关[16]。本研究结果显示微钙化分布与HER-2表达相关,微钙化呈线样或段样分布组多见于HER-2阳性表达,集群分布组多见于HER-2阴性表达。有研究表明微钙化表现为线样或段样被认为具有高度风险,并且与集群分布的钙化相比更可能表现为恶性[17],这可能是它们HER-2表达不同的原因。关于乳腺微钙化分布与HER-2表达的关系研究报道并不一致,刘小庆等[18]报道集群分布多出现在 ER +、PR +、HER-2-患者中,段样分布的钙化更容易出现于三阳性乳腺癌中,与本文研究结果一致。而王文超等[15]815-817报道微钙化分布与HER-2表达无关。本研究中微钙化形态与HER-2表达有关,细线或细线分支状钙化的HER-2阳性表达率为100%,提示此形态钙化的乳腺癌恶性程度高,预后差。不定形、粗糙不均质与HER-2阴性表达相关,提示此形态钙化的乳腺癌恶性程度较低,预后较好。文献报道[4]695-759细线或细线分支状钙化具有高度恶性的可能,不定形及粗糙不均质具有低度恶性的可能,这可能是它们HER-2表达不同的原因。多数研究也报道细线或细线分支状钙化与HER-2阳性表达相关[19],与本文结果一致。胡春艳[20]报道粗糙不均质与HER-2阳性表达相关,不定形与HER-2阴性表达相关,与本文结果部分一致。分析上述结果不一致的因素可能与乳腺癌的病理类型不同、样本量的多少、分组不同或乳腺癌本身的异质性有关。
本研究中乳腺癌微钙化的存在与ER、PR表达无关,多数研究[21]也报道乳腺癌微钙化的存在与ER、PR表达没有明确的相关性,与本文结果一致。本研究中乳腺癌微钙化的分布与ER、PR表达无关。多数文献报道并不一致,杨鹏等[22]报道微钙化分布与ER、PR表达差异不具有统计学意义,与本文结果一致。而曹洁莹等[23]报道微钙化呈段样分布与PR表达可能存在一定相关性,与ER表达无关,与本文结果部分一致。本研究中乳腺癌微钙化的形态与ER、PR表达无关。而胡春艳[20]1-52报道不定形与ER阳性表达相关,粗糙不均质与ER阴性表达相关。文婵娟等[19]945-947报道细线或细线分支状钙化与ER低表达有关,均与本文结果不一致。分析上述结果不一致的因素可能与本文样本量少、分组不同、ER及PR判断标准不一致或乳腺癌本身的异质性有关。
综上所述,本文结果显示乳腺癌微钙化特征与ER、PR表达无关,与HER-2表达相关,因此乳腺X线微钙化特征可以预测预后因子的表达,为临床治疗提供一定的参考价值。
