太赫兹成像技术在肿瘤检测中的应用
2020-06-02施辰君
施辰君,吴 旭,彭 滟
太赫兹成像技术在肿瘤检测中的应用
施辰君,吴 旭,彭 滟*
上海理工大学光电信息与计算机工程学院,上海市现代光学系统重点实验室,上海 200093
太赫兹(THz)波是频率位于0.1 THz~10 THz的电磁波。因其具有非电离性,以及可与多数生物分子产生共振响应等特性,在生物医学领域有着巨大应用潜力,尤其在肿瘤检测方面。太赫兹成像技术作为生物医学领域一种新的成像技术,吸引国内外多个研究小组对其开展深入研究。本文列举分析了多种太赫兹成像技术在肿瘤检测的应用,其中可分为太赫兹扫描成像、太赫兹层析成像、太赫兹全息成像以及太赫兹近场成像,介绍了这些成像方式的基本原理以及国内外研究现状,最后对太赫兹成像技术在生物领域的未来做出展望。
太赫兹脉冲成像;连续波太赫兹成像;太赫兹层析成像;太赫兹全息成像;太赫兹近场成像
1 引 言
太赫兹(Terahertz,THz)波是指频率位于0.1 THz至10 THz范围内的电磁波。由于其非电离性、高穿透性、高分辨率、可与多数生物分子产生共振响应获得分子指纹谱等特性,在多个领域均具有重大的应用潜力[1-8]。在生物医学领域,太赫兹成像技术作为一种新的成像技术,相比传统方法中的核磁共振和X射线方法,可有效避免活体检查时的辐射损伤,且常用的远场太赫兹光斑的空间分辨率最高可达50 μm[9],有望实现癌症早期诊断中病理组织的无损快速成像,因此国内外多个研究小组对其开展了深入研究。
由于癌症等病变组织的结构、密度、含水量等生理学参数与正常组织不同,导致太赫兹波透过这些样本后,其产生的光学参数变化也不同。因此通过对光学参数构建图像,即可对生物样本成像。目前的研究主要利用两种太赫兹波源来获取样品的光学参数:太赫兹脉冲源和连续波太赫兹源。以太赫兹脉冲为辐射源的成像技术通过透过样本的太赫兹脉冲复介电函数的空间分布信息建立图像,因此可以获得样本的多光谱成像[10],而利用连续波太赫兹源的成像技术则通过透过样本的单频太赫兹波建立图像,与太赫兹脉冲源相比,其系统简单,太赫兹波强度更高,数据处理速度更快,但图像信息只与太赫兹波强度、相位相关[11]。目前的研究中,基于这两种太赫兹源的成像技术主要包含太赫兹远场扫描成像、太赫兹层析成像、太赫兹全息成像以及太赫兹近场成像这四大类。太赫兹远场扫描成像通过逐点扫描获取样本每一个点的光学参数来建立太赫兹图像,其分辨率取决于系统的光斑直径和扫描步长,因此对于获取高分辨率的成像,其耗时较久。太赫兹层析成像主要将太赫兹成像技术与层析重构算法相结合,通过收集透过样本不同方向的太赫兹波来构建三维太赫兹图像,以显现物体的内部结构,因此可以实现样本的三维成像[12]。太赫兹全息成像则使用面阵测量器件收集样品被照明区域的太赫兹波信号,因此相比其他成像方式的逐点扫描,其成像速度被大幅度提升[13]。其中,脉冲太赫兹全息成像通常利用电荷耦合器件(CCD)获得被照明区域的THz时域图形,而连续太赫兹数字全息使用热释电探测器或微测热辐射计等被照明区域的光波前信息数字全息图。太赫兹近场成像基于近场太赫兹倏逝波对样品近场区域扫描成像,该方法能突破光学衍射极限,获得低至纳米级空间分辨率的精细图像[14-15]。
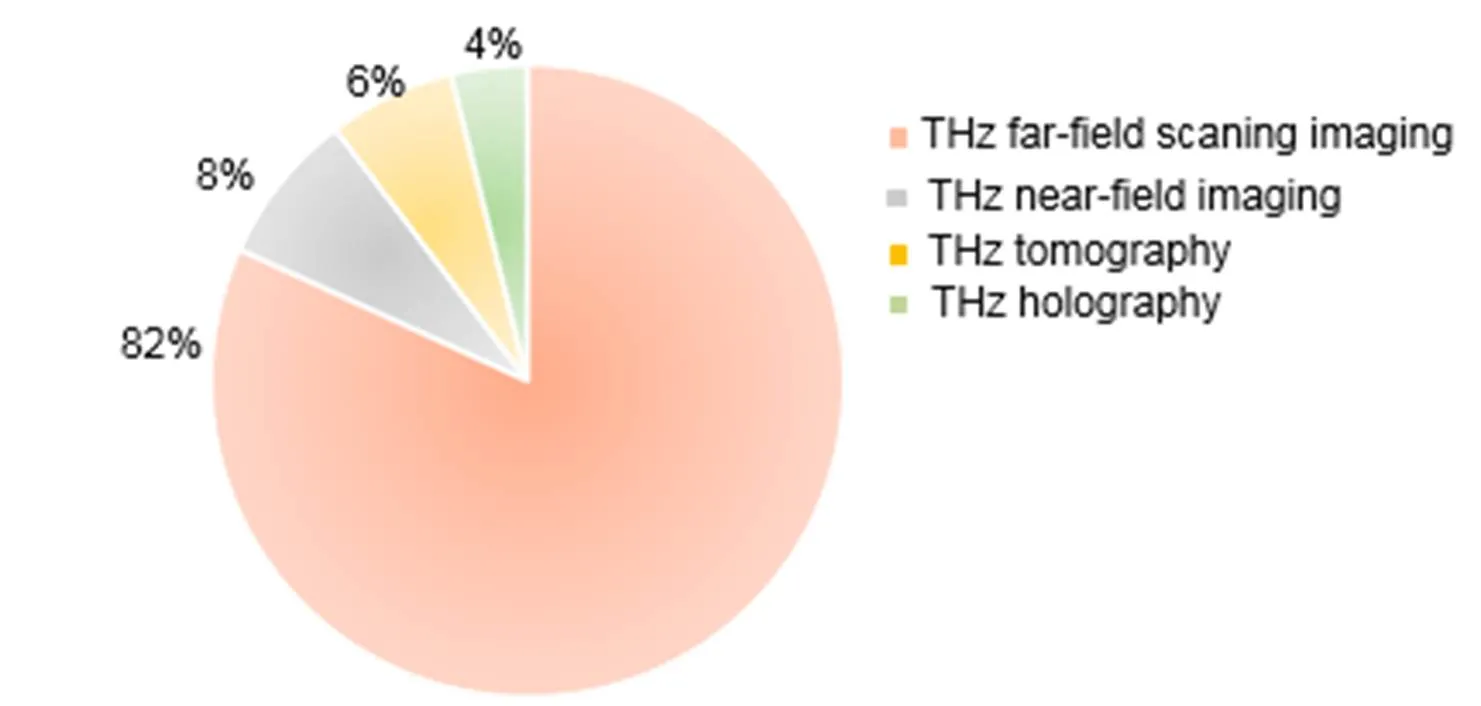
目前,在生物医学领域中,国内外各个课题组基于这四种技术进行了生物组织或癌症等生物样本的成像研究,如图1所示,根据Web of Science 检索结果,近五年来(2015.1-2019.12),国际上基于太赫兹成像技术的癌症研究有154项,其中,太赫兹远场扫描成像占主导地位,共有相关工作126项(82%),其他成像中,层析成像的相关工作10项(6%),全息成像的相关工作6项(4%),近场成像相关工作12项(8%)。
2 太赫兹远场扫描成像
太赫兹远场扫描成像是一种传统的远场太赫兹成像技术,通过逐点扫描透过样本的太赫兹波,获取样本每个点的太赫兹波光学参数,并以此构建太赫兹图像。其中,以太赫兹脉冲作为辐射源能获取的参数有时域上的光学延迟、最小脉冲函数min、脉冲后时间(time post pulse,TPP)等,也有频域上的吸收系数、折射率、反射率等;以连续太赫兹波作为辐射源的成像系统使用的是单频连续波源,其单频点辐射强度要远高于脉冲太赫兹源[11],但同时也限定了其只能对单个频率的特征识别,且获取的光学参数仅与太赫兹波的强度和相位相关。
2.1 基于脉冲太赫兹源的太赫兹远场扫描成像
在以太赫兹脉冲的时域信息为主的生物医学成像研究方面,2001年,英国Toshiba Research Europe Ltd.的Cole等人[16]基于时域峰值对人体皮肤进行了活体成像。根据所得太赫兹数据绘制了皮肤角质层的厚度和水合度,给出了横截面图像。2002年到2004年间,英国剑桥大学的Woodward等人[17-19]基于TPP、太赫兹吸收系数和最小脉冲函数min等技术对人体皮肤癌、离体基底细胞癌进行了成像,分辨率可达350 μm。2004年,英国TeraView公司的Wallace等人[20]基于最大脉冲函数max和TPP对体外和体内基底细胞癌进行了成像,在太赫兹图像中确定的疾病区域与病理组织学相关性很好,面积误差约10%。2006年,英国TeraView公司的Fitzgerald等人[21]基于最大脉冲函数max和最小脉冲函数min对人体乳腺肿瘤切片进行了成像,图像上的肿瘤区域与所有22个样品的显微结果的相关系数大于0.82。2009年,中国香港中文大学的Huang等人[22]基于最大脉冲函数max对老鼠心脏进行了成像,图像能清晰区分心脏部分,图像分辨率约为125 μm。2010年,中国香港中文大学的Kan等人[23]基于时域峰峰值和峰谷值对切除的兔股骨进行成像,并证明反射之间的光学延迟可以对软骨内特定组织的厚度进行定量测量,THz光学延迟与组织学厚度之间的相关性达0.81。2012年,西澳大利亚大学的Fitzgerald等人[24]对乳腺组织切片的时域太赫兹信号进行主成分分析降维,以此进行成像,图像分辨率约266 μm。2013年,韩国延世大学的Oh等人[25]基于时域峰峰值,通过加入甘油作为增强剂,对人造肿瘤组织进行成像,图像分辨率达250 μm。该团队于2014年又基于时域峰-峰值计算了样本的反射率[26],以此进行脑组织切片样本的成像,图像分辨率为250 μm。其脑组织的可视图、太赫兹反射图和核磁共振图如图2所示,通过THz的反射率,肿瘤的情况能清晰地反映出来。
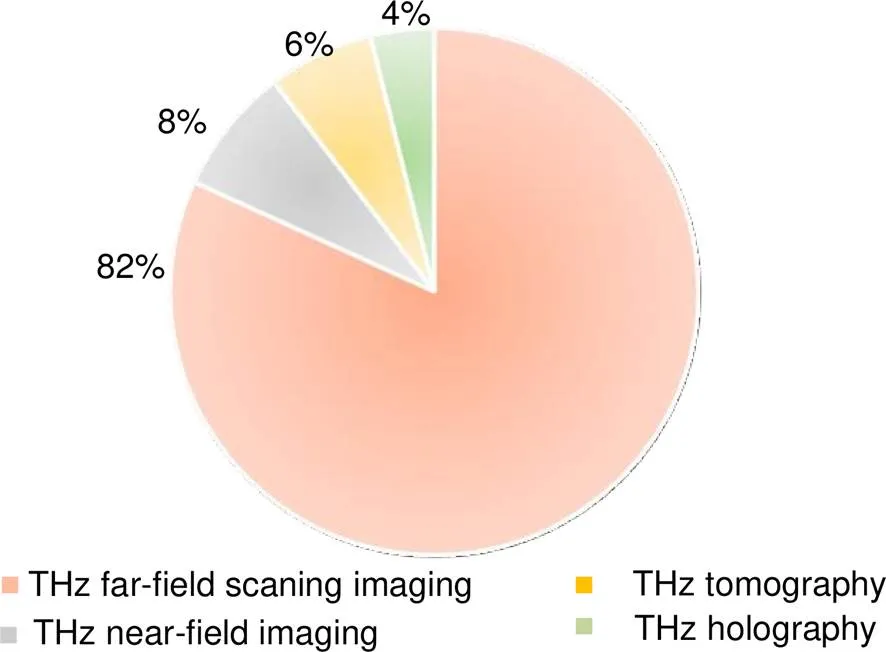
图1 四种太赫兹成像技术研究的占比分布情况
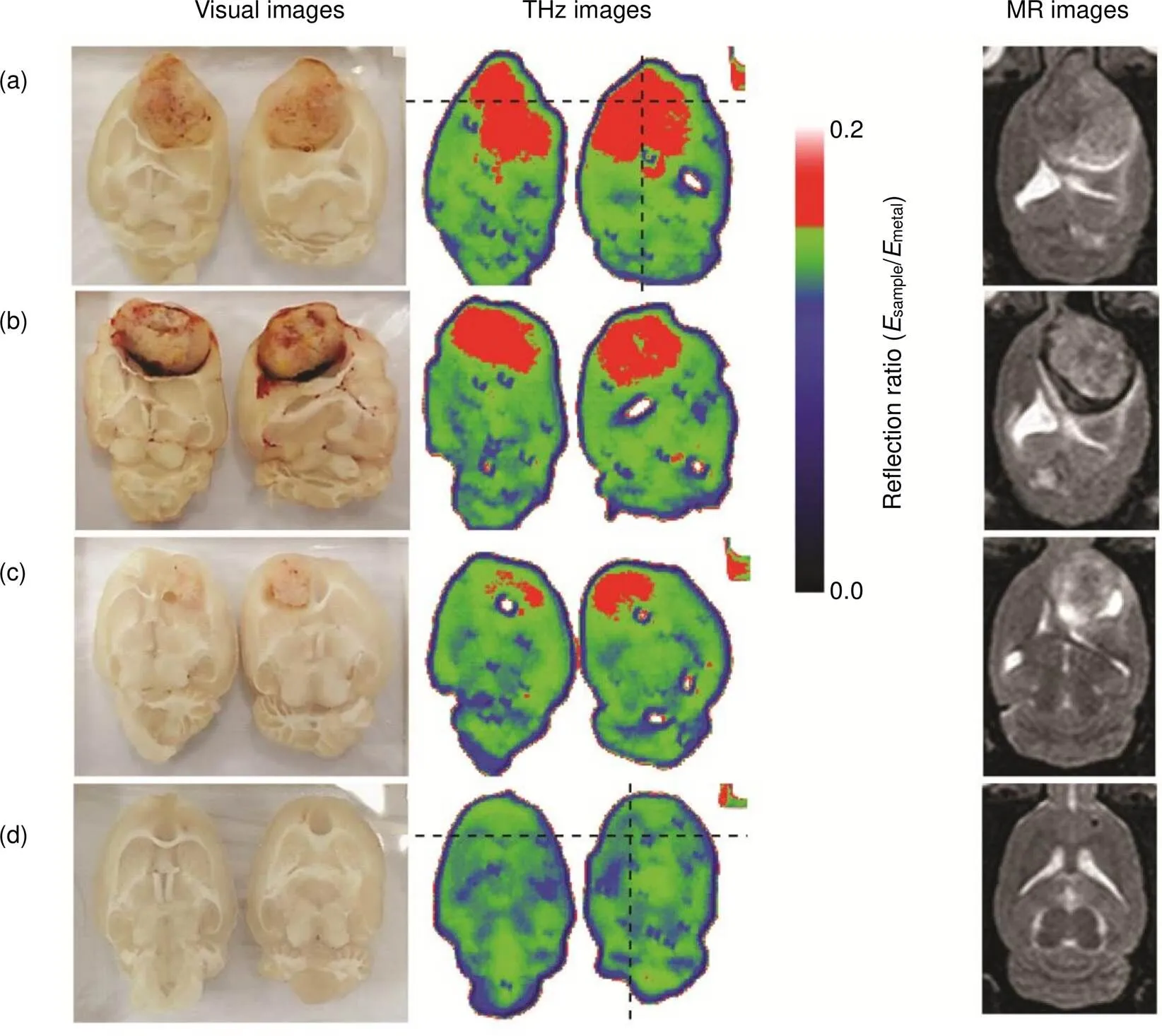
图2 不同肿瘤程度的脑组织成像结果[26]
同时,也有将脉冲的时域信号进行傅里叶变化转为频域信号,以频域信息为主的生物医学成像研究。2007年,新西兰奥塔哥大学的Ho等人[27]基于折射率进行了缓释片成像以研究胞衣厚度,其图像分辨率达200 μm。同年,日本大阪大学的Enatsu等人[28]基于折射率和消光系数对石蜡包裹的肝癌组织进行了成像,分辨率为1 mm。2008年,英国利物浦大学的Shen等人[29]基于吸收系数进行了片剂成像,以研究片剂包衣层厚度和界面均匀性,其分辨率最高可达150 μm。同年,美国加州大学-圣塔芭芭拉的Taylor等人[30]基于折射率进行了烧伤猪皮的成像,其分辨率为1.5 mm。2009年,日本理化学研究所的Hoshina等人[31]基于吸光度进行了冰冻生物组织成像,同时也通过时域脉冲的时间延迟进行成像,图像分辨率达200 μm。2010年,日本东京医科齿科大学的Brun等人[32]采集了癌症组织的折射率数据,通过使用聚类方法对提取的折射率数据进行分割来生成光谱图像,其图像分辨率达50 μm。2013年,英国剑桥大学的May等人[33]基于表面折射率进行药物片剂成像,以研究片剂的硬度和表面密度分布,其图像分辨率为200 μm。
同年,美国普林斯顿大学的Sim等人[34]基于折射率对口腔癌组织进行了成像,他们在-20 ℃以及室温条件下,提取了0.5 THz处的折射率进行成像,成像结果如图3所示,从-20 ℃时的成像可以看出,患病区域具有较低折射率,且与组织学诊断的患病区域对应,其图像分辨率为250 μm。2015年,美国阿肯色大学的Bowman等人[35]基于反射系数对石蜡包裹的乳腺肿瘤组织进行了高分辨率成像,分辨率最高达50 μm。2016年,日本佳能R&D研发中心的Yamaguchi等人[36]基于复折射率对老鼠脑肿瘤进行成像,分辨率为500 μm。2018年,中国河南工业大学的蒋玉英等人[37]基于THz功率谱进行了小麦麦芽糖成像,图像分辨率达100 μm。

图3 六个口腔样品的(a) 光学图像;(b) -20 ℃的THz图像;(c) 室温THz图像;(d) 组织病理学图像。THz图像反映样本在0.5 THz的折射率,在组织学图像中癌变区域用蓝色环标记[34]
2.2 基于连续波太赫兹源的太赫兹远场扫描成像
目前,也有较多利用连续波源进行太赫兹扫描成像的生物医学研究。2011年,葡萄牙波尔图大学的Wahaia等人[38]使用了基于太赫兹量子级联激光器的透射式连续波太赫兹系统,收集了人体正常结肠组织和结肠癌组织在0.76 THz处的信号进行成像,其系统的光斑直径为1 mm。同年,美国马萨诸塞州洛厄尔大学的Joseph等人[39]使用了透射式连续波太赫兹系统对非黑色素瘤皮肤癌进行成像,其使用了CO2光泵浦远红外气体激光器在1.39 THz和1.63 THz处产生的连续波源,分辨率分辨为390 μm和490 μm。韩国食品研究所的Lee等人[40]以固态振荡器(0.1 THz Gunn二极管)和倍频器搭建了工作频率为0.2 THz的透射式连续波太赫兹系统对食品中的异物进行成像,图像分辨率为400 μm。2012年,美国马萨诸塞州洛厄尔大学的Joseph等人[41]使用CO2光泵浦远红外气体激光器搭建了工作频率在0.58 THz的反射式连续波太赫兹系统,收集了非黑色素瘤皮肤癌的共偏振和交叉偏振信号进行成像,图像分辨率为100 μm。2013年,美国马萨诸塞州洛厄尔大学的Doradla等人[42]基于CO2光泵浦远红外气体激光器搭建反射式连续太赫兹波系统,收集了人体结肠组织在0.584 THz处的共偏振和交叉偏振信号进行成像,图像分辨率为100 μm。2016年,美国马萨诸塞州洛厄尔大学的Martin等人[43]也使用了工作频率为0.58 THz的CO2光泵浦远红外气体激光器搭建反射式连续波太赫兹系统,收集了非黑素瘤皮肤癌组织的共偏振和交叉偏振信号,图像分辨率达150 μm。2018年,中国第三军医大学的Yang等人[44]使用工作频率为2.52 THz的光泵浦连续波THz气体激光器(FIRL100, Edinburgh Instruments Ltd, UK)搭建透射式连续波太赫兹系统,通过THz吸收的差异对4种细菌的菌落进行区分成像,图像分辨率达100 μm。2019年,中国天津大学的Wu等人[45]也使用2.52 THz的光泵浦连续波THz气体激光器(FIRL100, Edinburgh Instruments Ltd, UK)搭建反射式连续波太赫兹系统对老鼠模型的脑胶质瘤组织成像,如图4所示,太赫兹图像中显示的肿瘤区域的体积和位置与相应的核磁共振,视觉和病理学图像相似,图像分辨率为200 μm。
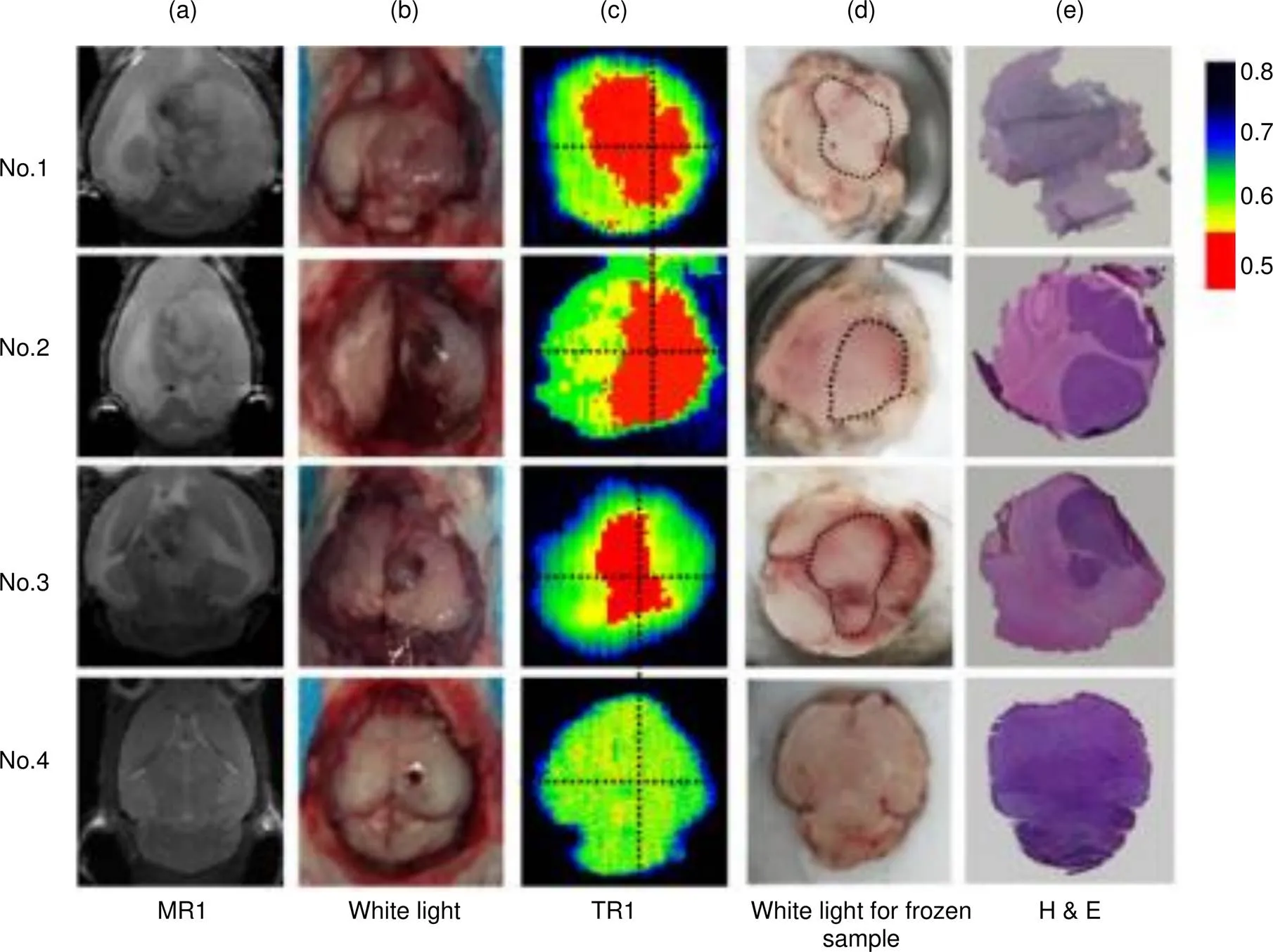
图4 脑组织的(a) 核磁共振图像;(b) 体内视觉图像;(c) THz反射图像;(d) 新鲜切片视觉图像;(e) 病理学染色图像。其中样本1~3号患有肿瘤,4号没有肿瘤[45]
3 太赫兹层析成像
太赫兹层析成像是在传统的远场太赫兹成像基础上,通过从不同角度采集样本的太赫兹信号,然后使用层析算法重构出样本信息空间分布的三维太赫兹成像,以此研究样本的内部结构。
在生物医学方面,基于太赫兹层析成像的研究还处在起步阶段,目前仅有少数成像研究报道。比如,2012年,法国波尔多大学的Bessou等人[46]将工作频率在0.110 THz的连续波太赫兹系统与三维断层扫描结合,用于研究干燥的人类骨骼。通过太赫兹吸收可以清晰地分辨出海绵状骨中的致密骨,但与X射线相比,其分辨率较低,仅为2.7 mm。2018年,中国北京科技大学的Li等人[47]将工作频率在0.279 THz的连续太赫兹波系统与计算机断层扫描(CT)相结合,对鸡的骨结构进行了二维断面成像,结果表明,鸡尺骨内的致密骨头和海绵状骨头能通过太赫兹吸收清晰区分,系统的光斑直径为0.94 mm。
由于厚生物样本含有大量水分或其他物质影响,太赫兹波能量较低,无法穿透这些样品,因此生物医学相关的层析成像还在起步阶段,仅有上述少量研究。
4 太赫兹全息成像
太赫兹全息成像是在传统的远场太赫兹成像基础上,将太赫兹波的探测器替换为不同面阵式探测工具进行探测,其中,对于脉冲太赫兹源,面阵式探测器通常采用CCD,而对于连续波太赫兹源,面阵式探测器通常采用热释电探测器或微测热辐射计等工具。因此相比传统的远场太赫兹成像的逐点扫描,太赫兹全息成像可以一次性获得整个样本的二维电场分布,成像时间大幅缩短。
目前也有一部分基于太赫兹全息成像的生物医学成像研究。比如,2015年,中国北京科技大学的Rong等人[48]使用工作频率在2.52 THz的连续波太赫兹系统,通过热电阵列检测器收集样本光束与非散射参考波之间的干涉,形成全息图,观察淡水藻类脱水过程,分辨率为100 μm。同年,中国北京科技大学的Rong等人[49]使用连续太赫兹波同轴数字全息进行了人类肝细胞癌组织的吸收和相移分布的成像,其采用了工作频率为2.52 THz的连续波太赫兹系统,并使用热电阵列探测器收集太赫兹信号,通过亚像素移位和外推增强了重建的分辨率,如图5所示,其分辨率最高达158 μm。2016年至2017年,中国首都师范大学的Guo等人[50-51]应用太赫兹数字全息成像系统对牛、羊和猪肉组织进行了成像,可分辨脂肪和瘦肉组织,并通过多次成像观察组织的脱水过程。他们使用脉冲太赫兹波源并用CCD探测太赫兹信号,同时应用图像重建算法消除太赫兹波的衍射影响,进一步提高太赫兹图像的清晰度,使分辨率达到32 μm。
5 太赫兹近场成像
太赫兹远场成像的空间分辨率受制于衍射极限(/2),而太赫兹近场成像则通过检测样本表面附近区域的近场太赫兹倏逝波,因此其分辨率不受衍射限制,而取决于所用微型探针大小。太赫兹近场成像具体可分为两种模式:近场照明和近场收集。前者是THz波经过微型探针针尖后产生近场太赫兹波再照射样本,然后远场收集信号;后者则是通过微型探针直接近场探测远场THz波照射在样品表面产生的倏逝场或将倏逝场通过微型探针转化为传播场再远场探测[12]。
目前也有部分生物医学成像研究是基于太赫兹近场成像的,由于目前近场照明模式无法提供足够强度的光源,因此近场成像在生物医学领域主要使用近场收集模式。2004年,德国BESSY研究中心的Schade等人[52]演示了一种太赫兹扫描近场红外显微镜,其使用脉冲太赫兹系统作为太赫兹源,通过InSb晶体检测穿透样品的THz信号,通过透射率对植物叶片和牙齿样本进行了成像,其分辨率为130 μm。2013年,中国东南大学的陈华等人[53]使用太赫兹光纤扫描近场成像系统,对人体肝癌组织使用吸收系数进行成像研究,其太赫兹源为频率在0.300 THz的连续太赫兹波源,使用肖特基探测器检测太赫兹信号。其成像结果与病理学结果一致,图像分辨率为100 μm。2015年,该课题组基于太赫兹管的近场成像系统对人体结肠组织进行了成像[54],同样使用0.300 THz的连续太赫兹波系统并使用肖特基探测器检测太赫兹信号,通过近场扫描吸光度能清晰区分癌症组织与正常组织,且通过病理染色检查在大小和形状上的识别非常吻合,如图6所示,图像分辨率达100 μm。同年,中国台湾大学的Tseng等人[55]使用太赫兹近场透射成像系统进行了裸鼠体内的耳朵内血管成像,其使用了0.340 THz的连续太赫兹波源,并使用肖特基探测器检测太赫兹信号,得到的图像分辨率为100 μm。2016年,美国犹他大学的Fawole等人[56]使用太赫兹向量网络分析仪(terahertz vector network analyzer,TVNA),其配备的Virginia二极管扩频器提供了0.75 THz至1.10 THz的太赫兹信号,通过金属、特氟龙和石英三种探针分别连接号角天线以检测太赫兹信号,对老鼠的大脑切片、伞形树小叶和黄粉虫翅膀成像。结果表明,太赫兹近场成像对不同区域能做出清晰区分,这项工作的分辨率最高可达75 μm。2018年,中国长春理工大学的孙卫东等人[15]搭建了基于光电导微探针的近场太赫兹系统,使用了脉冲太赫兹源并用光电导微探针采集信号,通过时间延迟分辨猪肉组织的不同区域,分辨率达到了16.5 μm。
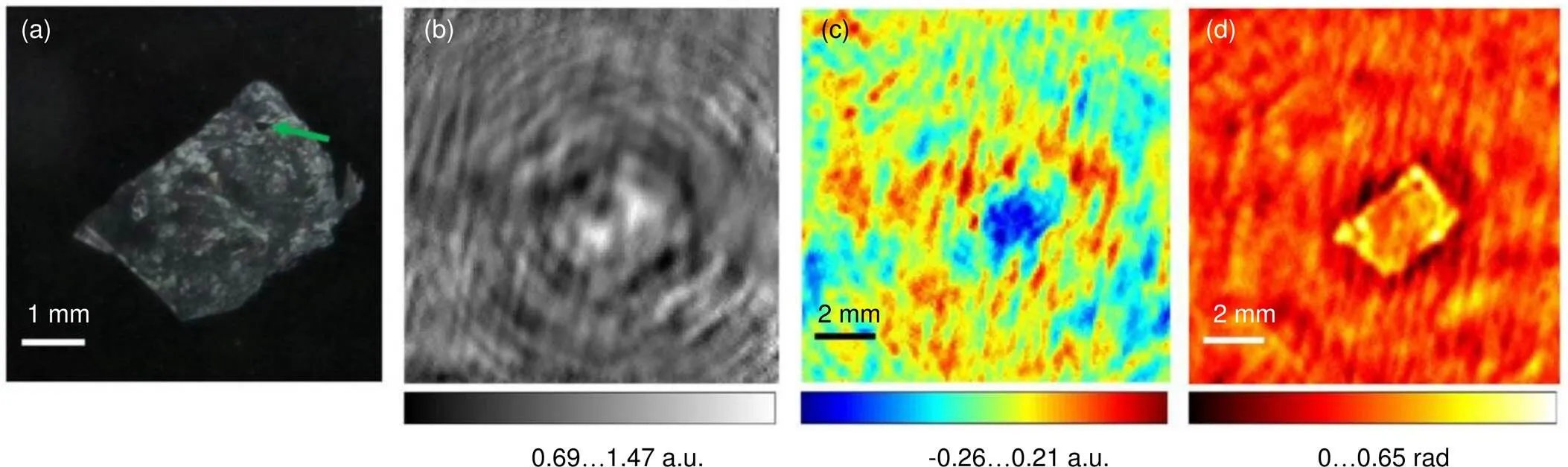
图5 人类肝细胞癌组织的(a) 全息数据采集后的样品照片;(b) 在选定探测器位置获得的归一化全息图;(c) 重构吸收分布a(x,y);(d) 重构相移分布φ(x,y)[49]
6 总结与展望
在生物医学领域,由于太赫兹波的诸多特性,基于太赫兹波的各种成像方式正被不同课题组不断深入研究。大部分研究使用传统的远场太赫兹扫描成像,也有研究从对远场太赫兹成像进行改进的角度出发,比如结合层析算法而产生的太赫兹层析成像,以此进行三维太赫兹成像和断层太赫兹成像;同时也有更换探测方式,通过面阵测量样本的太赫兹波而产生的太赫兹全息成像,来大幅减少测量所需要的时间。另外,部分研究使用太赫兹近场成像,从而突破衍射限制获得更高空间分辨率。这些研究发展出不同的成像方法,对生物医学领域的不同种类样本进行了成像研究。
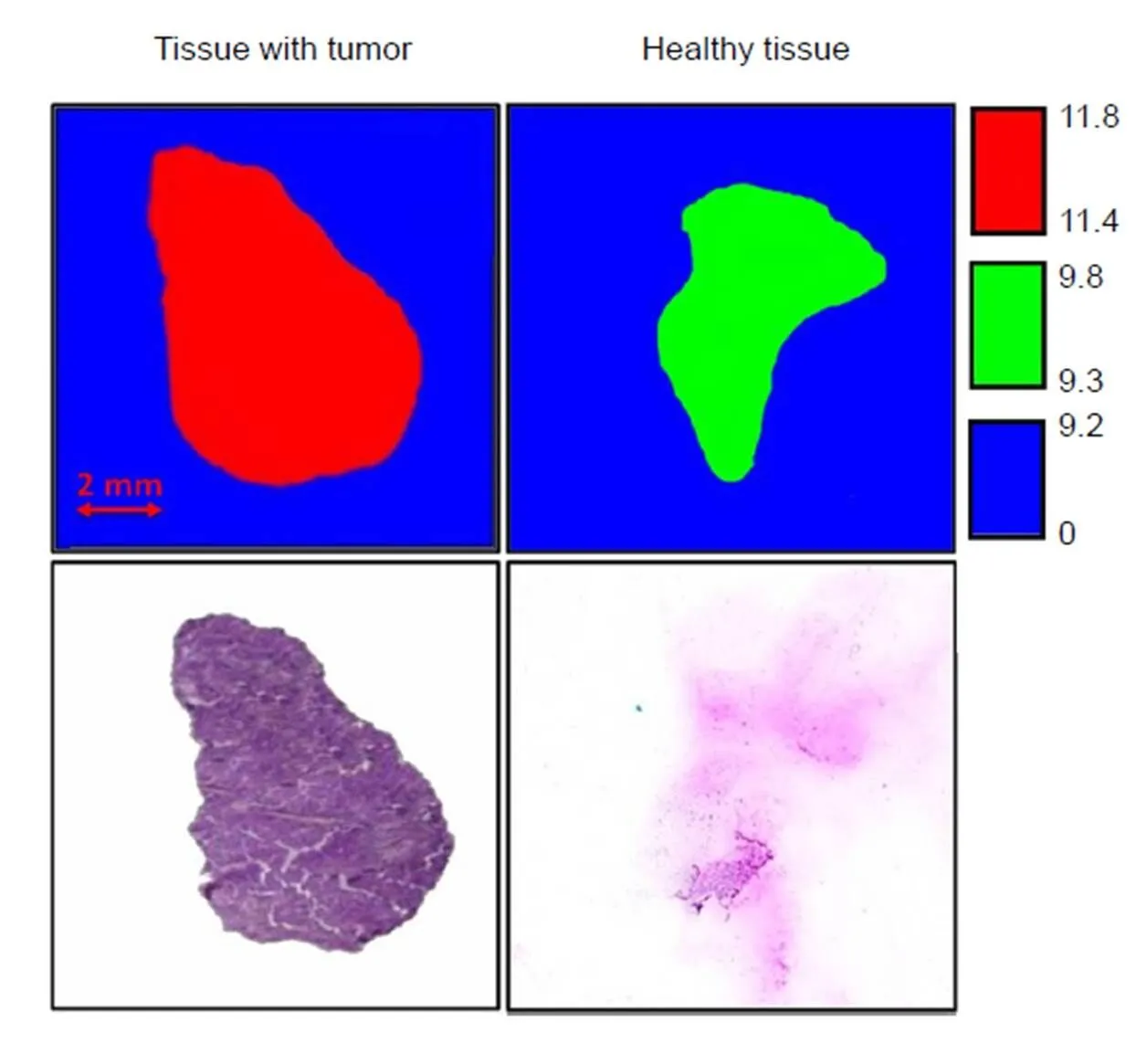
图6 结肠组织的THz近场图像以及病理染色切片的相应显微照片[55]
目前,太赫兹成像技术在生物医学上的成像研究主要集中在对癌组织的研究,已证明了太赫兹成像技术在癌症诊断上的可行性。但是,这些研究主要都是基于癌组织与正常组织之间由于水分因素产生的吸收、折射等差异,所以无法准确识别癌症类别。目前已有研究证实部分癌症标识物在太赫兹波段存在特征吸收[57-58],因此未来通过对标识物的太赫兹成像来实现对癌症的诊断,将具有更大的潜力。
[1] Zhang X N, Chen J, Zhou Z K. THz time-domain spectroscopy technology[J]., 2005, 42(7): 35–38.
张兴宁, 陈稷, 周泽魁. 太赫兹时域光谱技术[J]. 激光与光电子学进展, 2005, 42(7): 35–38.
[2] Zhou L, Chen L G, Ren G H,. Monitoring cis-to-trans isomerization of azobenzene using terahertz time-domain spectroscopy[J]., 2018, 20(42): 27205–27213.
[3] Li T, Ma H Y, Peng Y,. Gaussian numerical analysis and terahertz spectroscopic measurement of homocysteine[J]., 2018, 9(11): 5467–5476.
[4] Shen Y C, Upadhya P C, Linfield E H,. Temperature-dependent low-frequency vibrational spectra of purine and adenine[J]., 2003, 82(14): 2350–2352.
[5] Peng Y, Shi C J, Xu M Q,. Qualitative and quantitative identification of components in mixture by terahertz spectroscopy[J]., 2018, 8(6): 696–701.
[6] Pickwell E, Wallace V P. Biomedical applications of terahertz technology[J]., 2006, 39(17): R301–R310.
[7] Kawase K, Ogawa Y, Watanabe Y,. Non-destructive terahertz imaging of illicit drugs using spectral fingerprints[J]., 2003, 11(20): 2549–2554.
[8] Danciu M, Alexa-Stratulat T, Stefanescu C,. Terahertz spectroscopy and imaging: a cutting-edge method for diagnosing digestive cancers[J]., 2019, 12(9): 1519.
[9] Kasban H, El-Bendary M A M, Salama D H. A comparative study of medical imaging techniques[J]., 2015, 4(2): 37–58.
[10] Zhang L, Xu X L, Li F L. Review of the progress of T-ray imaging[J]., 2005, 22(2): 129–134.
张蕾, 徐新龙, 李福利. 太赫兹(THz)成像的进展概况[J]. 量子电子学报, 2005, 22(2): 129–134.
[11] Yang K, Zhao G Z, Liang C S,. Comparison between pulsed terahertz imaging and continuous-wave terahertz imaging[J]., 2009, 36(11): 2853–2858.
杨昆, 赵国忠, 梁承森, 等. 脉冲太赫兹波成像与连续波太赫兹成像特性的比较[J]. 中国激光, 2009, 36(11): 2853–2858.
[12] Pan Z L, Chen L, Shen Y H. Terahertz tomography[J]., 2013(12): 29–30.
潘中良, 陈翎, 谌贻会. 太赫兹波的层析成像[J]. 数字技术与应用, 2013(12): 29–30.
[13] Shi J, Wang X K, Zheng X H,. Recent advances in terahertz digital holography[J]., 2017, 10(1): 131–147.
石敬, 王新柯, 郑显华, 等. 太赫兹数字全息术的研究进展[J]. 中国光学, 2017, 10(1): 131–147.
[14] Liu H X, Yao J Q, Wang Y Y,. Review of THz near-field imaging[J]., 2016, 35(3): 300–309, 376.
刘宏翔, 姚建铨, 王与烨, 等. 太赫兹波近场成像综述[J]. 红外与毫米波学报, 2016, 35(3): 300–309, 376.
[15] Sun W D, Geng G S, Yang Z B,. Imaging porcine tissue using a near-field terahertz microscopy technique[J]., 2018, 37(6): 769–774.
孙卫东, 耿国帅, 杨忠波, 等. 猪肉组织的近场太赫兹成像检测研究[J]. 红外与毫米波学报, 2018, 37(6): 769–774.
[16] Cole B E, Woodward R M, Crawley D A,. Terahertz imaging and spectroscopy of human skin in vivo[J]., 2001, 4276: 1–10.
[17] Woodward R M, Cole B E, Wallace V P,. Terahertz pulse imaging in reflection geometry of human skin cancer and skin tissue[J]., 2002, 47(21): 3853–3863.
[18] Woodward R M, Wallace V P, Pye R J,. Terahertz pulse imaging ofbasal cell carcinoma[J]., 2003, 120(1): 72–78.
[19] Woodward R M, Wallace V P, Arnone D D,. Terahertz pulsed imaging of skin cancer in the time and frequency domain[J]., 2003, 29(2–3): 257–259.
[20] Wallace V P, Fitzgerald A J, Shankar S,. Terahertz pulsed imaging of basal cell carcinomaand[J]., 2004, 151(2): 424–432.
[21] Fitzgerald A J, Wallace V P, Jimenez-Linan M,. Terahertz pulsed imaging of human breast tumors[J]., 2006, 239(2): 533–540.
[22] Huang S Y, Wang Y X J, Yeung D K W,. Tissue characterization using terahertz pulsed imaging in reflection geometry[J]., 2008, 54(1): 149–160.
[23] Kan W C, Lee W S, Cheung W H,. Terahertz pulsed imaging of knee cartilage[J]., 2010, 1(3): 967–974.
[24] Fitzgerald A J, Wallace V P, Pinder S E,. Classification of terahertz-pulsed imaging data from excised breast tissue[J]., 2012, 17(1): 016005.
[25] Oh S J, Kim S H, Jeong K,. Measurement depth enhancement in terahertz imaging of biological tissues[J]., 2013, 21(18): 21299–21305.
[26] Oh S J, Kim S H, Ji Y B,. Study of freshly excised brain tissues using terahertz imaging[J]., 2014, 5(8): 2837–2842.
[27] Ho L, Müller R, Römer M,. Analysis of sustained-release tablet film coats using terahertz pulsed imaging[J]., 2007, 119(3): 253–261.
[28] Enatsu T, Kitahara H, Takano K,. Terahertz spectroscopic imaging of paraffin-embedded liver cancer samples[C]//, Cardiff, UK, 2007: 557–558.
[29] Shen Y C, Taday P F. Development and application of terahertz pulsed imaging for nondestructive inspection of pharmaceutical tablet[J]., 2008, 14(2): 407–415.
[30] Taylor Z D, Singh R S, Culjat M O,. Reflective terahertz imaging of porcine skin burns[J]., 2008, 33(11): 1258–1260.
[31] Hoshina H, Hayashi A, Miyoshi N,. Terahertz pulsed imaging of frozen biological tissues[J]., 2009, 94(12): 123901.
[32] Brun M A, Formanek F, Yasuda A,. Terahertz imaging applied to cancer diagnosis[J]., 2010, 55(16): 4615–4623.
[33] May R K, Su K, Han L H,. Hardness and density distributions of pharmaceutical tablets measured by terahertz pulsed imaging[J]., 2013, 102(7): 2179–2186.
[34] Sim Y C, Park J Y, Ahn K M,. Terahertz imaging of excised oral cancer at frozen temperature[J]., 2013, 4(8): 1413–1421.
[35] Bowman T C, El-Shenawee M, Campbell L K. Terahertz imaging of excised breast tumor tissue on paraffin sections[J]., 2015, 63(5): 2088–2097.
[36] Yamaguchi S, Fukushi Y, Kubota O,. Brain tumor imaging of rat fresh tissue using terahertz spectroscopy[J]., 2016, 6(1): 30124.
[37] Jiang Y Y, Ge H Y, Zhang Y. Quantitative determination of maltose concentration in wheat by using terahertz imaging[J]., 2018, 38(10): 3017–3022.
蒋玉英, 葛宏义, 张元. 基于太赫兹成像技术的小麦麦芽糖定量检测研究[J]. 光谱学与光谱分析, 2018, 38(10): 3017–3022.
[38] Wahaia F, Valusis G, Bernardo L M,. Detection of colon cancer by terahertz techniques[J]., 2011, 1006(1–3): 77–82.
[39] Joseph C S, Yaroslavsky A N, Neel V A,. Continuous wave terahertz transmission imaging of nonmelanoma skin cancers[J]., 2011, 43(6): 457–462.
[40] Lee Y K, Choi S W, Han S T,. Detection of foreign bodies in foods using continuous wave terahertz imaging[J]., 2012, 75(1): 179–183.
[41] Joseph C S, Patel R, Neel V A,. Imaging ofnonmelanoma skin cancers in the optical and terahertz spectral regions optical and terahertz skin cancers imaging[J]., 2014, 7(5): 295–303.
[42] Doradla P, Alavi K, Joseph C S,. Detection of colon cancer by continuous-wave terahertz polarization imaging technique[J]., 2013, 18(9): 090504.
[43] Martin J P, Joseph C S, Giles R H. Continuous-wave circular polarization terahertz imaging[J]., 2016, 21(7): 070502.
[44] Yang X, Shi J, Wang Y Y,. Label‐free bacterial colony detection and viability assessment by continuous‐wave terahertz transmission imaging[J]., 2018, 11(8): e201700386.
[45] Wu L M, Xu D G, Wang Y Y,. Study ofbrain glioma in a mouse model using continuous-wave terahertz reflection imaging[J]., 2019, 10(8): 3953–3962.
[46] Bessou M, Chassagne B, Caumes J P,. Three-dimensional terahertz computed tomography of human bones[J]., 2012, 51(28): 6738–6744.
[47] Li B, Wang D Y, Rong L,. Application of continuous-wave terahertz computed tomography for the analysis of chicken bone structure[J]., 2018, 57(2): 023105.
[48] Rong L, Latychevskaia T, Zhou X,. Dynamic dehydration observation based on terahertz in-line digital holography[C]//, Shanghai, China, 2015: DTh1A.2.
[49] Rong L, Latychevskaia T, Chen C H,. Terahertz in-line digital holography of human hepatocellular carcinoma tissue[J]., 2015, 5(1): 8445.
[50] Guo L H, Wang X K, Zhang Y. Terahertz digital holographic imaging of biological tissues[C]//, Chongqing, China, 2016: IW4B.3.
[51] Guo L H, Wang X K, Han P,. Observation of dehydration dynamics in biological tissues with terahertz digital holography[J]., 2017, 56(13): F173–F178.
[52] Schade U, Holldack K, Martin M C,. THz near-field imaging of biological tissues employing synchrotron radiation[J]., 2005, 5725: 46–52.
[53] Chen H, Ma S H, Yang W X,. The diagnosis of human liver cancer by using THz fiber-scanning near-field imaging[J]., 2013, 30(3): 030702.
[54] Chen H, Ma S H, Wu X,. Diagnose human colonic tissues by terahertz near-field imaging[J]., 2015, 20(3): 036017.
[55] Tseng T F, Yang S C, Shih Y T,. Near-field sub-THz transmission-type image system for vessel imaging-[J]., 2015, 23(19): 25058–25071.
[56] Fawole O C, Tabib-Azar M. Terahertz near-field imaging of biological samples with horn antenna-excited probes[J]., 2016, 16(24): 8752–8760.
[57] Peng Y, Yuan X R, Zou X,. Terahertz identification and quantification of neurotransmitter and neurotrophy mixture[J]., 2016, 7(11): 4472–4479.
[58] Chen W Q, Peng Y, Jiang X K,. Isomers identification of 2-hydroxyglutarate acid disodium salt (2HG) by terahertz time-domain spectroscopy[J]., 2017, 7(1): 12166.
Applications of terahertz imaging technology in tumor detection
Shi Chenjun, Wu Xu, Peng Yan*
Shanghai Key Lab of Modern Optical System, School of Optical-Electrical and Computer Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China
The proportion of current research on different terahertz imaging technologies
Overview:Terahertz (THz) wave exhibits many features including non-ionizing, non-invasive, phase-sensitive to polar substances, spectral fingerprinting, relatively good resolution, coherent detection properties, and penetration capabilities. For tumor detection, traditional imaging methods such as magnetic resonance imaging and computerized tomography will cause radiation damage to biotissue, while THz imaging can provide quick, non-destructive, and accurate imaging of biotissue. Two kinds of terahertz sources are mainly used: pulse THz wave source and continuous THz wave source. Pulse THz wave source provides multi-dimensional information for the analysis of sample, while continuous THz wave source can only provide amplitude or phase images for delineation different areas. But imaging system using continuous THz source are more concise compared to that using pulse THz source. Currently, based on these two THz sources, there are four kinds of imaging technologies:
1) THz far-field scanning imaging is the most commonly used, where THz signal is collected by scanning the sample point by point and then images are constructed by these data. The resolution depends on the spot diameter and step size of the scanning, therefore, long measuring time are required for high-resolution imaging.
2) THz tomography combined THz far-field imaging system with tomography algorithm. By collecting the THz signal from different angle of sample, and then using the algorithm for analysis, 3D images of sample can be obtained. Internal structure of the sample can be observed by THz tomography. However, it will take much more time to measure the signal from different angle.
3) For THz holography, different array detectors, such as charge coupled device, pyroelectric detector, and microbolometer, are used in THz far-field imaging system. Instead of point-by-point measurement of common far-field THz imaging system, THz digital holography collects the THz signal of the whole sample at once, which greatly reduce the measurement time.
4) THz near-field imaging method collects the signal of evanescent field near the sample surface and uses these data to calculate images. So, THz near-field imaging can break the diffraction limit (/2) and provides the resolution three magnitudes higher than THz far-field imaging.
In the paper, we introduced the studies of these four THz imaging technologies done by different groups worldwide. At last, we presented the prospect of terahertz imaging technology applied in biomedical field.
Citation: Shi C J, Wu X, Peng Y. Applications of terahertz imaging technology in tumor detection[J]., 2020,47(5): 190638
Applications of terahertz imaging technology in tumor detection
Shi Chenjun, Wu Xu, Peng Yan*
Shanghai Key Lab of Modern Optical System, School of Optical-Electrical and Computer Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China
Terahertz radiation is an electromagnetic wave whose frequency is in the range of 0.1 THz~10 THz. With its many features such as non-ionizing and resonance to many biomolecules, THz wave has great potential applications in biomedical field, especially in tumor detection. Terahertz imaging technology, as a new imaging technology in biomedical field, is studied by many research groups around the world. In this paper, we listed and analyzed many terahertz imaging methods in tumor detection, including terahertz scanning imaging, terahertz tomography, terahertz holography, and terahertz near-field imaging. We introduced the basic principle of these imaging methods and the works done by different groups worldwide. At last, we presented the prospect of terahertz imaging technology applied in biomedical field.
terahertz pulse imaging; continuous-wave terahertz imaging; terahertz tomography imaging; terahertz holography imaging; terahertz near-field imaging
National Key R & D Plan "Development of Major Scientific Instruments and Equipment" (2017YFF0106300), National Natural Science Foundation--Outstanding Youth Foundation (61922059), Youth Top Talent Development Plan, and Shanghai Rising-Star Program (17QA1402500)
TN29;R318.6
A
施辰君,吴旭,彭滟. 太赫兹成像技术在肿瘤检测中的应用[J]. 光电工程,2020,47(5): 190638
10.12086/oee.2020.190638
: Shi C J, Wu X, Peng YApplications of terahertz imaging technology in tumor detection[J]., 2020, 47(5): 190638
* E-mail: py@usst.edu.cn
2019-10-24;
2020-03-20
国家重点研发计划“重大科学仪器设备开发”重点专项(2017YFF0106300);国家自然科学基金优秀青年科学基金(61922059);上海市青年拔尖人才开发计划;上海市启明星人才计划(17QA1402500)
施辰君(1996-),男,硕士研究生,主要从事太赫兹技术在生物医学方面的应用。E-mail:scj0117@outlook.com
彭滟(1982-),女,教授,主要从事太赫兹波的产生和调控,以及太赫兹波在生物医学中的应用。E-mail:py@usst.edu.cn
版权所有©2020中国科学院光电技术研究所
