太赫兹医学成像研究进展
2020-06-02严芷瑶黄婉霞黄青青朱礼国施奇武
严芷瑶,黄婉霞,黄青青,邹 逸,朱礼国,施奇武*
太赫兹医学成像研究进展
严芷瑶1,黄婉霞1,黄青青1,邹 逸2,朱礼国2,施奇武1*
1四川大学材料科学与工程学院,四川 成都 610064;2中国工程物理研究院流体物理研究所,四川 绵阳 621900
太赫兹波所具有的无损性以及大量生物分子在太赫兹频段的指纹特性,使其在医学成像领域有着良好的应用前景。本文首先简要概述了太赫兹的医学成像技术手段,其次分别介绍了太赫兹在离体、活体组织中成像的研究现状。生物组织中的水会对太赫兹波产生强吸收,使得成像对比度受限。目前,为了减少组织中的水对成像的影响,针对离体组织的太赫兹成像大多需要进行切片、脱水等预处理,活体中的成像则主要应用在浅表组织。文章重点介绍了活体成像中有望提高太赫兹成像对比度的纳米粒子造影剂,最后对太赫兹医学成像的发展进行了展望。
太赫兹;医学成像;对比度;造影剂
1 引 言
太赫兹波(Terahertz, THz)是指频率在0.1 THz~10 THz(1 THz=1012Hz),波长介于30 μm~3000 μm的电磁波,其位于微波与红外波之间,是电子学向光学的过渡区。太赫兹波具有许多优点,让它在医学成像领域有着广阔的应用前景[1-2]。首先,由于大量生物分子的转动和振动跃迁能级位于太赫兹频段,并且表现出强烈的吸收和色散,使得具有“指纹”特性的物质便于鉴别[3]。其次,太赫兹的光子能量很低(1 THz为4.1 meV),没有像X射线一样的电离性质,对生物组织不会造成明显的电离危害,且太赫兹波对许多非金属、非极性材料具有较强的穿透能力。
但是水会强烈吸收太赫兹波,从而造成活体太赫兹成像对比度严重下降,这限制了太赫兹成像在活体中的应用。目前主要的解决方法有几类:一是对离体组织进行冷冻、干燥、切片或脱水来减少水的影响[4-7];二是在活体组织中通过一些手段来增强太赫兹波在体内的成像对比度和深度,如在生物体内使用内窥镜[8]、吸收率低的生物相容材料[9]以及成像造影剂[10-13]等。
本文针对太赫兹医学成像领域的研究现状,分别介绍了目前太赫兹波用于离体组织和活体组织成像的研究进展,特别是近年来发展的太赫兹医学成像造影剂,最后对太赫兹医学成像未来的发展进行了展望。
2 太赫兹成像技术手段
自Hu等[14]首次提出基于太赫兹时域光谱的成像方式以来,太赫兹成像技术得到了飞速的发展。一般来说,根据使用的激光光源不同,太赫兹成像系统可以分为太赫兹时域光谱(脉冲)成像系统和连续波太赫兹成像系统。
太赫兹时域光谱系统是基于太赫兹脉冲的产生和检测,脉冲拥有较宽的频带且持续时间非常短,能够直接测量经过样品的太赫兹波的振幅和相位信息,通过一定变换后得到样品的各项特性。太赫兹成像的探测方式有反射与透射两种,一般的医学成像由于组织含水量较多限制了穿透深度,更多使用的是反射式系统的浅表目标成像。如图1(a)所示[4],飞秒激光器产生的激光脉冲经过分光系统后,一束作为产生光经过太赫兹发射元件产生太赫兹辐射,由样品表面反射后得到样品信息;另一束则作为探测光通过探测元件获得相应的太赫兹时域波形,经过傅里叶变换得到太赫兹波幅值与相位信息后就可以获得该点处样品的特定参数,再通过控制二维平移台获得样品各个点的信息从而得到扫描图像。连续波太赫兹成像系统则通常在较窄的频段工作,是利用了组织内部缺陷的边缘对太赫兹波的散射效应,通过影响其强度的分布来进行成像。如图1(b)所示[15],连续太赫兹波光源经过斩波器后再经过透镜聚焦,经过样品后再被聚焦到探测器上获取样品的强度信息,同样通过控制二维平移台最终得到扫描图像。

图1 太赫兹成像系统示意图。(a) 太赫兹反射成像系统[4];(b) 连续波太赫兹成像系统[15];(c) 太赫兹数字全息成像系统[16]
以上所述常用的两种成像系统都采用了逐点扫描的成像方式,通常是在二维移动的平台上进行的,有时存在采集时间较长的问题。所以目前还发展了许多新的成像技术,比如太赫兹数字全息术就是将太赫兹成像与数字全息术相结合,通过CCD相机等光敏电子成像器件代替传统的记录介质提取全息图像的信息,再通过计算机模拟再现。图1(c)所示为典型的实验装置图[16],太赫兹波首先通过十字定向耦合器得到物光和参考光,参考光通过抛物面镜聚焦后与物光发生干涉,得到样品的全息图像并由CCD相机记录,再通过计算机对参考光进行模拟再现,从而能够快速获取全息成像图。
除此之外,近年来还有一些新的成像技术如太赫兹近场成像、计算机辅助断层等在医学成像领域得到了应用。太赫兹成像系统在医学领域的一些典型应用如表1所示。
3 太赫兹离体组织成像
由于太赫兹波会被水强烈吸收,导致太赫兹在活体中的成像对比度严重恶化。所以许多研究选择含水量较少的成像目标,或通过对离体组织进行预处理去除水分,得到成像对比度较高的太赫兹成像效果。
牙齿是人体内含水量较少的组织[17],经过研究发现太赫兹波能够有效检测龋齿。传统的龋齿检测一般直接观察目标颜色、透明度等信息,以至于很难发现早期的龋齿,太赫兹成像有利于早期龋齿的发现与治疗。例如,2003年,剑桥大学的David等[18]使用太赫兹脉冲成像系统成功构造了牙齿组织的三维图像,并且可以准确直接地测量牙釉质厚度。
同样,太赫兹成像技术还可以应用于眼科领域。加州大学洛杉矶分校的Bennett等[19]通过分辨率为1.2 mm的太赫兹反射成像系统在0.2、0.4、0.6、0.8和1太赫兹频率处对离体猪角膜组织的水分流失过程进行了监测,实验发现太赫兹波的反射率与水含量浓度呈近似线性关系(图2),且斜率随频率的增加单调递减,该实验结果有助于判断角膜是否病变的临床诊断。

表1 太赫兹医学成像的应用

图2 (a) 体外含水角膜的光学图像和太赫兹图像;(b) 体外猪角膜图像,含水量分别为(左上至右下):84.74%、78.64%、75.27%、70.25%和66.06%[19]
此外由于癌症细胞结构相对于正常细胞会发生变化,太赫兹波能够有效检测出离体组织中的癌症细胞。2015年,Rong等[5]利用太赫兹数字全息技术对健康和癌变的冷冻肝脏切片进行了成像,该系统的分辨率为158 μm。由太赫兹全息图像(图3)可以明显看到肝细胞的纤维化,也就是即将产生肝硬化的迹象,说明通过太赫兹医学成像能够进行早期的癌症诊断,并达到及时治疗的目的。

图3 (a) 人体肝癌组织的光学照片;(b) 经过处理的太赫兹全息图[5]
阿肯色大学的Tyler等[4, 6]则使用分辨率为50 μm的太赫兹反射成像系统在0.1 THz~4 THz范围内对脱水的乳腺癌细胞进行了成像实验,发现太赫兹成像可以成功区分正常的乳腺组织与癌变组织(图4)。研究还在太赫兹脉冲成像系统上比较了太赫兹反射与透射成像模式,结果显示组织黏附、厚度偏差等引起的相位变化对组织特性的计算影响较小,相比之下,反射成像显示出更高的成像分辨率和灵敏度,并且能够显示不同密度癌细胞之间的对比。
虽然太赫兹离体组织成像能够对生物组织进行有效诊断,但这些处理的手段的缺点是显而易见的,首先适用于活体成像研究,存在很大的局限性;其次脱水和冷冻等手段可能会改变组织的生物结构,不利于精确诊断[23]。

图4 浸润导管癌的(a) 病理图像;(b) 太赫兹时域图像;(c) 1.5 THz频域图像;(d) 2.0 THz频域图像[4]
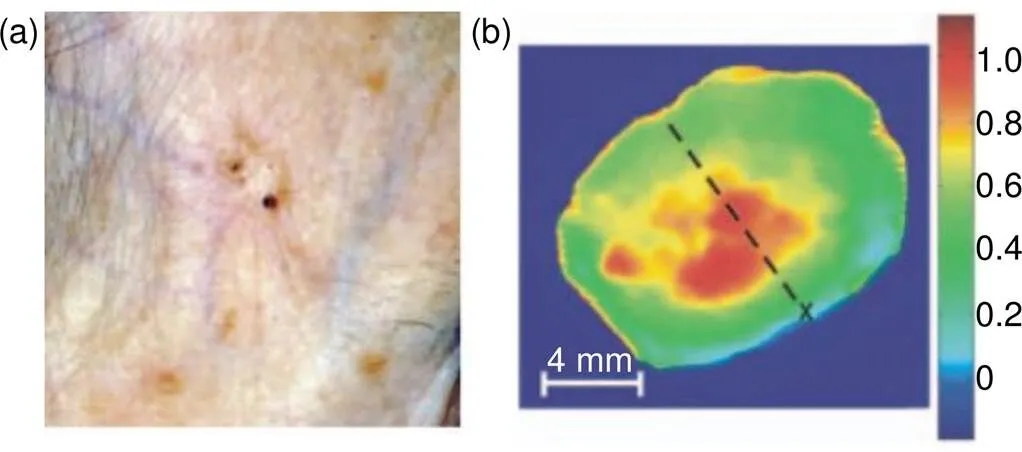
图5 (a) 新鲜切除的肿瘤组织;(b) 相应的太赫兹图像[26]
4 太赫兹活体组织成像
基于异常组织和正常组织在水分含量和组织结构上可能存在差异,太赫兹波能够通过成像方式进行分辨。例如,癌变或其他病变组织由于血管增多或水肿会导致组织含水量较高,太赫兹波能够将活体或新鲜组织中的癌症组织区分开来。但是大多生物组织都存在于水环境或含有水的环境中,太赫兹波在透射过程中会不断衰减,导致其很难穿透一定厚度的生物样品,所以相关研究主要针对数百微米以内的浅表组织,例如烧伤、皮肤病诊断等领域[24-25]。
目前,在神经外科手术中,使用常规的术中诊断工具,如MRI或荧光光谱成像等传统成像技术很难清晰地识别肿瘤边界,而太赫兹成像在肿瘤边缘的识别中则具有很大的潜力。Wallace课题组[26]分别在体内外用便携式太赫兹脉冲成像系统在0.1 THz~3 THz对基底细胞癌的多个样本进行了成像,发现癌变组织与正常组织的差异明显(图5),且所得到的成像对比度足以判断癌变组织的边界。增加系统的频率可以提高分辨率,但会降低穿透深度,当频率为3 THz时,系统的横向分辨率为150 μm。这项研究也首次证明太赫兹成像可以在体内检测癌症。
通过太赫兹脉冲成像系统在0.15 THz~2.0 THz频率范围内进行成像,太赫兹检测肿瘤边缘的可行性也在新鲜切离的乳房组织中得到了检验[27-28],研究结果表明,太赫兹脉冲成像可以应用于乳腺肿瘤的术前和术中定位,能够最大限度地保护正常组织不被切除。图6显示了新鲜切除乳腺肿瘤体外太赫兹脉冲成像结果。同样,太赫兹图像中观察到的对比度的来源主要与异常组织中水分含量的增加有关。波尔多大学的Quentin等人[22]还在0.3 THz~0.6 THz频段用分辨率为1 mm的太赫兹反射成像系统对新鲜的乳腺肿瘤进行了成像实验,结果表明这个频段的太赫兹波也能够较好地区分组织,为在这个波段的太赫兹近场成像打下基础。
太赫兹对术中恶性脑肿瘤的诊断同样取得了显著的进展。韩国首尔延世大学的Oh等[29]通过分辨率为250 μm的太赫兹反射成像系统在0.3 THz~1.3 THz频段对新鲜的大鼠全脑组织(正常大脑与脑胶质瘤)进行成像,并与MRI结果进行比较(图7),发现二者吻合度较好,肿瘤区域的反射强度均大于正常组织。其次,研究还发现太赫兹成像还对大脑的灰质区与白质区有较好的区分,能够用于研究大脑的定性结构。2016年,该课题组通过该系统对新鲜小鼠和人体的脑胶质瘤组织样本,以及活体小鼠进行了成像[30],证明太赫兹反射成像对脑组织肿瘤的边缘的识别和描绘具有较高的灵敏度,从而能够在手术中划定肿瘤边界,进行全切除手术。
天津大学的Wu等[15]同样用横向分辨率为600 μm的连续波太赫兹反射成像系统,以2.52 THz的频率在活体小鼠脑内进行了太赫兹成像,发现太赫兹成像除了与其它成像方式吻合较好以外,由于能够反映周围的水肿区域,太赫兹波显示的区域要更大。此外他们还利用分辨率为2 mm的太赫兹时域光谱成像系统对新鲜切除的小鼠脑组织,在0.6 THz~2.8 THz频率处成像,结果表明,随着太赫兹波频率的增大,癌症组织与正常组织的差值也随之增大,因此能够为肿瘤的切除提供良好依据。
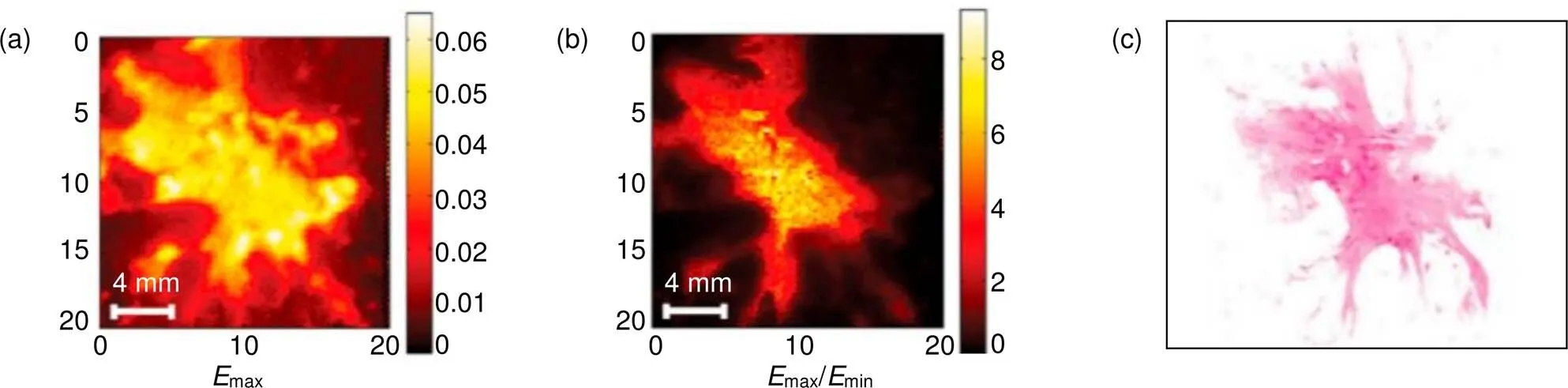
图6 (a),(b) 通过两种不同的太赫兹波形处理方法计算的太赫兹图像;(c) 组织的病理学检查图像[28]

图7 小鼠脑(脑胶质瘤)的光学、MR以及太赫兹图像[29]
烧伤导致伤口的内部和周围存在水肿和炎症,所以还可以通过太赫兹成像来诊断烧伤的深度和范围。加州大学洛杉矶分校的Tewari等[31]利用太赫兹反射成像系统,观察了活体鼠烧伤后创面内外水肿的形成,发现在不同时间下观察的图像由于水含量的变化呈现出不同的清晰程度。华盛顿大学的Hassan等[32]则用太赫兹时域光谱成像系统在0.1 THz~1 THz频段对大鼠的烧伤组织的活检样本进行了成像,成像光斑直径为2 mm。他们发现不同烧伤等级的太赫兹反射率不仅与组织中的总含水量一致,而且与皮肤层结构的密度有关,图像中离散的正常皮肤结构(如微血管系统、汗腺和毛囊)数量和大小的减少也可以作为判断烧伤等级的依据。因此对于磨损、割伤之类含水量变化较少的疤痕,太赫兹成像也能通过结构之间的差异观测到对比情况,来区分疤痕的类型和监测愈合的情况[21]。
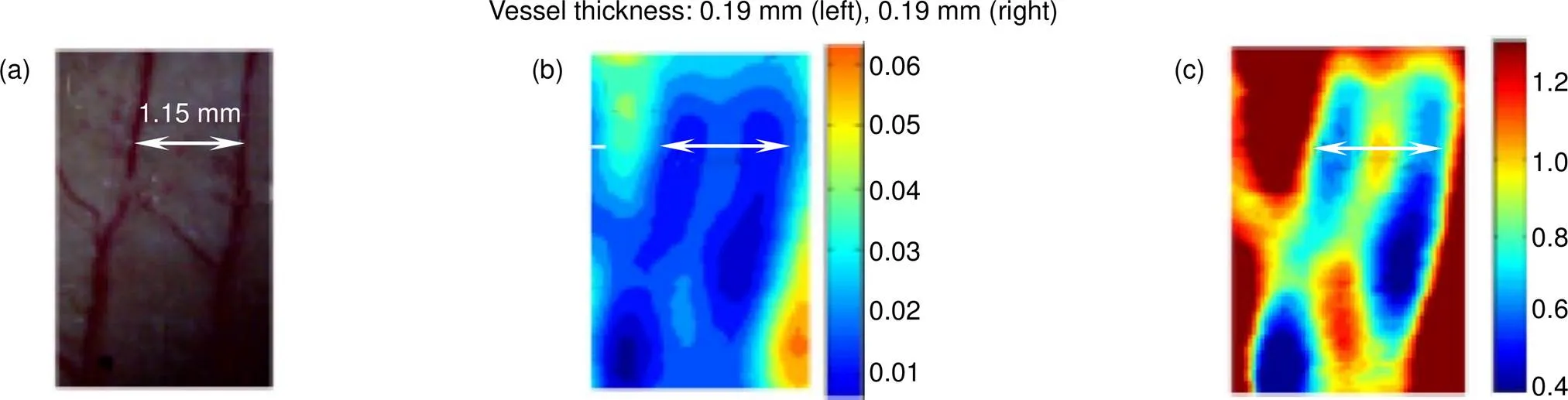
图8 小鼠耳朵的太赫兹透射近场成像。(a) 光学图片;(b) 显示实测透射率的原始太赫兹近场图像;(c) 处理后的归一化太赫兹透射图像[20]
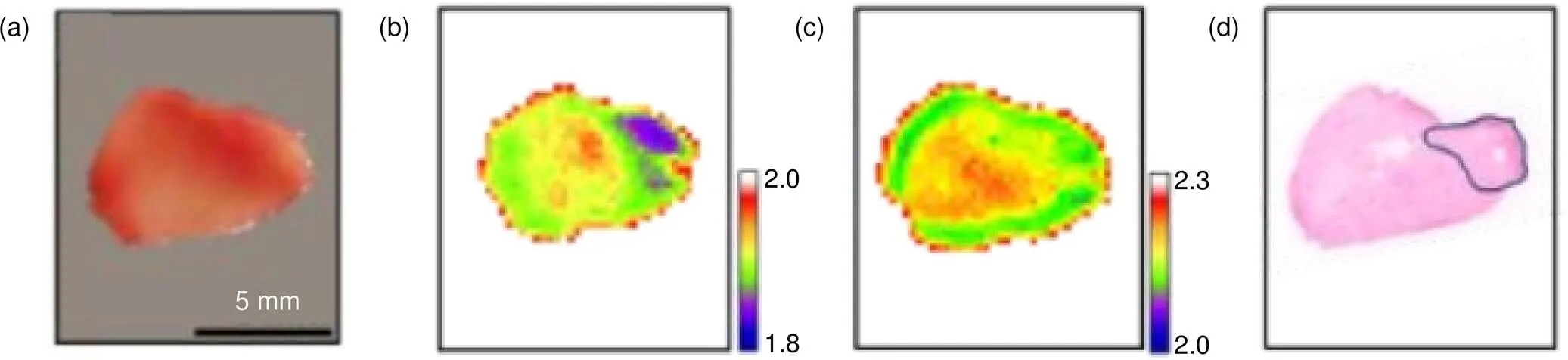
图9 口腔样本的(a) 光学图像;(b) -20 ℃太赫兹成像和(c) 室温太赫兹成像;(d) 病理学图像(组织学图像中癌区以蓝色圈标记)[33]
由于太赫兹波在体内的穿透深度的限制,大部分研究都只针对体表组织的反射成像,透射成像则一般只在较薄的组织中进行。台湾大学的Tseng等[20]利用分辨率为500 μm的太赫兹近场透射成像系统在0.34 THz对裸鼠耳组织进行了活体成像,图像中的血管可以被清晰分辨,同时该系统还可以定量监测血液吸收系数的变化,以对体内血液中的生理变化进行长期的监测(图8)。
针对太赫兹波在活体组织中穿透深度有限的问题,研究人员提出了一些改进方法。例如,由于太赫兹波被冰吸收的速率大大低于液态水,快速冷冻样品既可以保持细胞和组织的完整结构,也能增加太赫兹波的穿透深度。2013年普林斯顿大学的Sim等[33]通过太赫兹反射成像系统在0.2 THz~1.2 THz范围对口腔肿瘤进行了成像,该系统的分辨率为0.25 mm(图9)。通过在-20 ℃下冷冻组织成像以消除新鲜组织血液中水分的影响,实验结果表明,冷冻组织的口腔癌和正常粘膜之间太赫兹频谱的差异比室温太赫兹成像更大,说明冷冻组织的太赫兹成像在区分癌变组织和周围组织方面具有更高的敏感性。
除此之外,增加太赫兹波在体内的穿透深度还可通过将生物相容且太赫兹吸收率较低的渗透增强剂(THz-PEA)渗透入表皮中。如将甘油作为THz-PEA时,太赫兹波在活体中的反射信号大约是不添加甘油的两倍[9]。或者可以制造一种微型内窥镜,内置到人体后能够进行体内的太赫兹反射成像,这样的内窥镜信噪比高,频谱宽,与传统的太赫兹时域光谱系统相似[8]。
5 太赫兹医学成像造影剂研究
增强太赫兹活体成像对比度的另一种较为有效的方法就是使用特殊的造影剂来提高成像的对比度。像磁共振成像(MRI)、单光子发射计算机断层扫描、正电子发射断层扫描和使用荧光或生物发光的光学成像技术等方法类似。造影剂通常用于增强健康和病理组织区域或分子的图像对比度,通过使用造影剂,将有可能通过靶向肿瘤和使用更高的太赫兹频率来提高癌症诊断的敏感性,这将使成像分辨率大幅度提高。
自2008年来太赫兹的生物成像造影剂被提出[34]以来,许多可以被用作太赫兹成像造影剂的纳米材料得到了研究与应用。金纳米棒(gold nanorods, GNRs)作为研究较多的造影剂之一,它沿长轴的等离激元共振具有由可见光到近红外区连续可调谐的等离子体波长,使其可用于不同激发波长特别是在近红外区的成像(图10)。同时GNRs的表面易修饰,还可以很容易地与各种生物基团或是化学分子结合以实现功能化,且GNRs不易发生光漂白,这使得它们能够成为非常稳定的造影剂。
由于纳米粒子的尺寸比太赫兹波长小3到4个数量级,因此纳米粒子与太赫兹波之间几乎不会产生相互作用,但太赫兹波的吸收、反射等特性对水或含有大量水的细胞的温度变化很敏感,GNRs就是通过光热效应来升高周围环境的温度,从而增强太赫兹波的反射强度。如图11,通过近红外激光照射GNRs时,由于GNRs的局域表面等离共振效应,在近红外光频率与GNRs的共振频率相近时,表面等离激元共振产生的热能会使周围的液体环境快速升温,温度的升高改变了水分子和氢键的振动模式,从而提高了GNRs所在区域对太赫兹波的反射强度。基于该机制,可以实现对反射式太赫兹成像信号的增强。
2009年首尔大学的Oh等[10]首次使用了GNRs作为太赫兹的生物成像造影剂,从人表皮样癌细胞系(A431)中提取细胞,分别针对有GNRs和没有GNRs的细胞通过扫描分辨率为500 μm的太赫兹反射成像系统进行成像(图12),并利用波长为800 nm的近红外光照射激发GNRs表面等离共振产生光热效应。实验结果发现,由于GNRs引起的太赫兹波的反射或吸收可以忽略不计,所以从水中反射的太赫兹信号无论有无GNRs都基本相同。但如果同时用近红外激光照射含有及不含有GNRs的细胞样品,添加了GNRs的癌细胞对太赫兹信号反射振幅增加了20%。
此后研究人员进一步将成像对象由细胞扩大为活体小鼠,通过在GNRs上进行一定的分子修饰实现对肿瘤细胞的靶向。经由小鼠静脉注射,在24 h后开展成像实验[35],并与近红外成像(NAI)做了对比[36]。结果发现,太赫兹成像可以分辨出靶向肿瘤的位置和大小;将不同器官组织切除取出后则可以看到造影剂的分布(图13),其中肿瘤、肝脏和脾脏中含量较多,说明造影剂会通过小鼠的循环系统进入目标肿瘤,在被肾脏清除前会先残存在肝脏和脾脏中。
由此可以看到,利用纳米粒子造影剂能够进一步提高成像的对比度,从而实现更高对比度的活体组织成像诊断[37]。
虽然使用GNRs作为太赫兹成像造影剂可以明显提高成像对比度,但是其在制备过程中,通常会使用具有生物毒性的表面活性剂分子(如CTAB)作为模板。为了进一步提高其临床应用性能,四川大学的Huang等[13]使用二氧化硅对GNRs进行包覆,并且在前列腺癌细胞中用太赫兹反射成像系统进行太赫兹成像实验。结果表明,二氧化硅的包覆能够同时提高GNRs的生物相容性、稳定性以及细胞吞噬的性能,并且对太赫兹的反射信号有了进一步的增强,从而大大提高了GNRs作为太赫兹成像造影剂的应用前景。

图10 长径比为(a) 3.2;(b) 4.0;(c) 4.2的GNRs透射电镜图;(d) (a)~(c)的紫外可见吸收光谱[10]
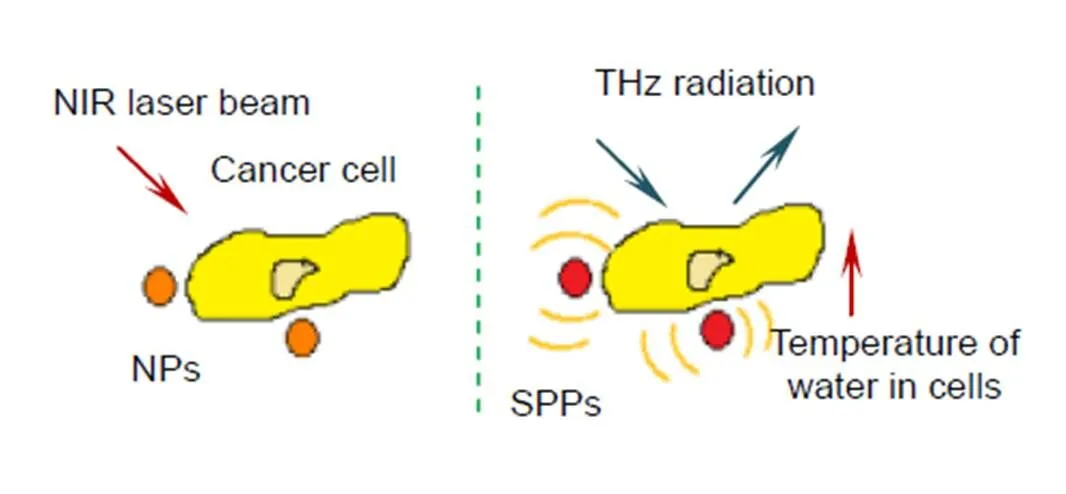
图11 GNRs增强太赫兹成像原理示意图[21]
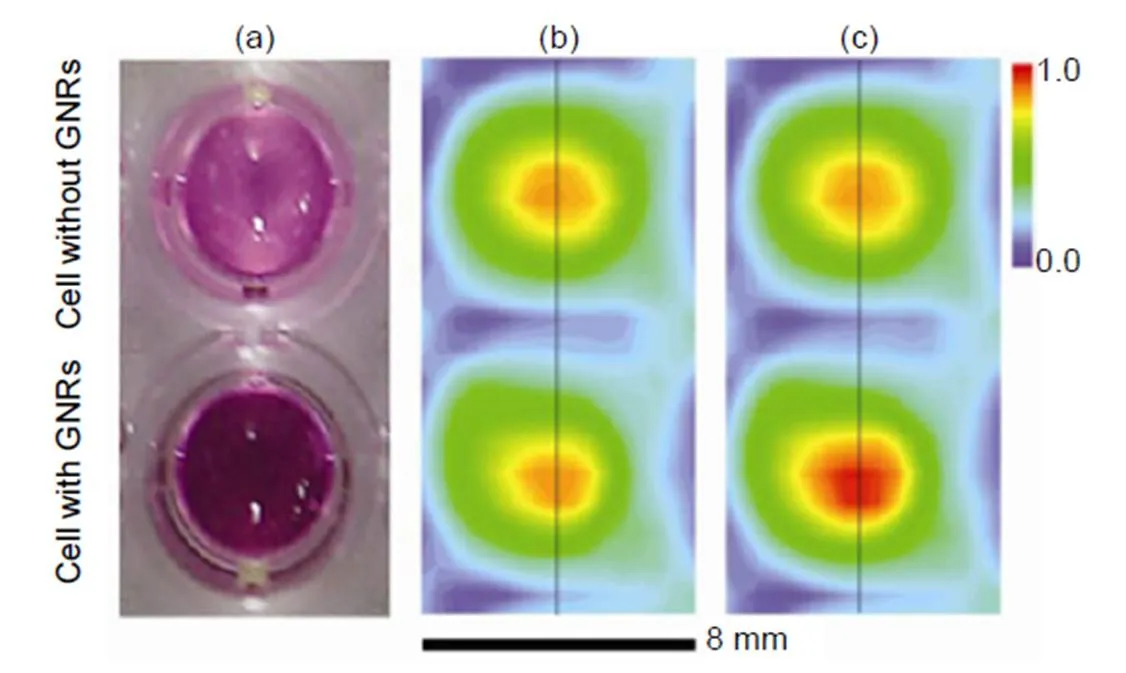
图12 有无GNRs的癌细胞太赫兹成像。(a) 光学图像;(b)没有红外辐射照射下的图像;(c) 红外辐射照射下的图像[10]
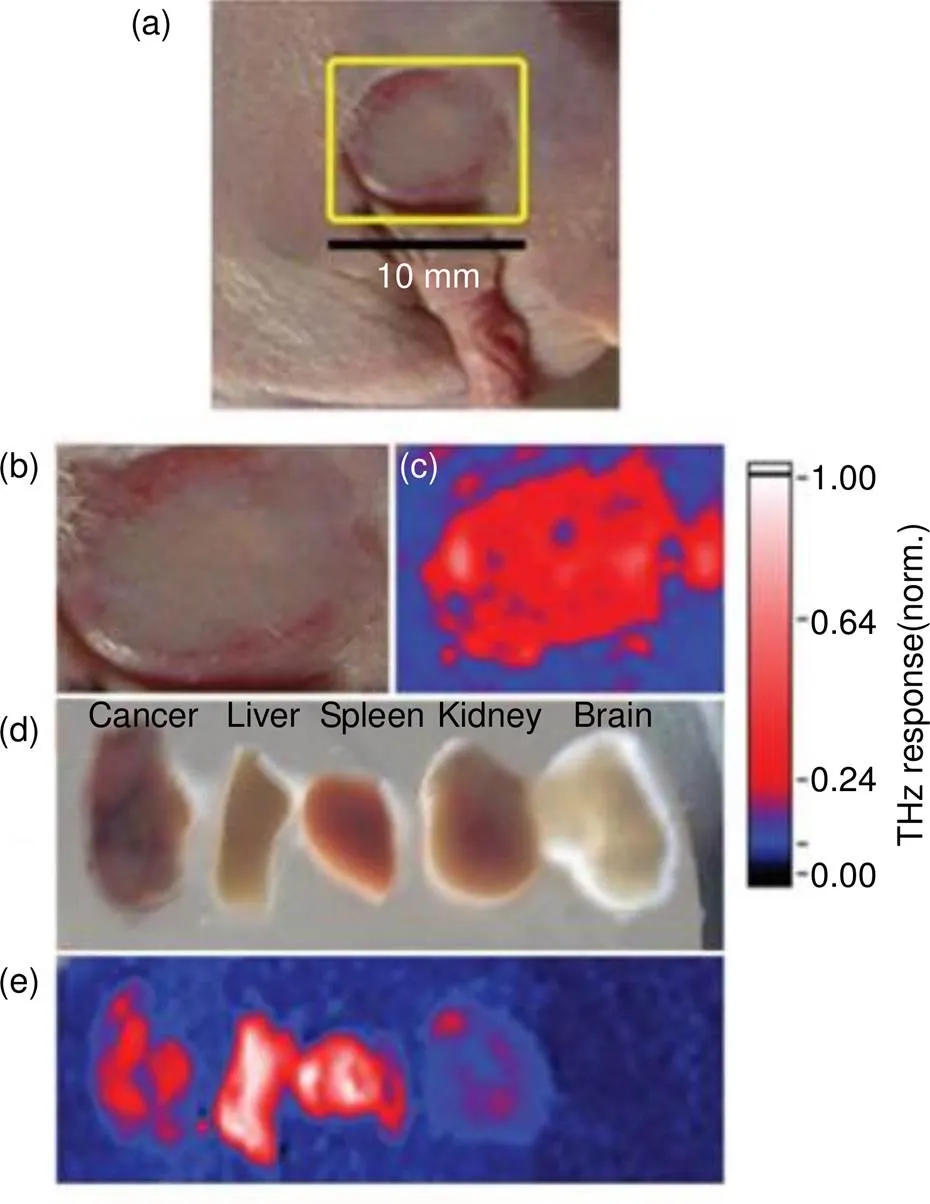
图13 体内和体外肿瘤的太赫兹图像。(a),( b) 体内肿瘤的光学图像;(c) 体内肿瘤的太赫兹图像;(d) 肿瘤、肝脏、脾脏、肾脏和大脑切片的光学图像;(e) 切片的太赫兹图像[36]
除了GNRs以外,还有一些纳米材料被研究作为太赫兹的医学成像造影剂。首尔大学的Lee等[11]使用了纳米氧化钆颗粒作为太赫兹成像的造影剂,并通过太赫兹时域光谱系统测量了氧化钆颗粒的光学常数。氧化钆最初被认为是适合MRI的多功能造影剂,但因为氧化钆对太赫兹波能产生强烈的吸收,比水的吸收强度还要大约3个数量级,所以它也能作为太赫兹成像的造影剂,且成像对比度较高,并且随着氧化钆颗粒尺寸减小,成像的对比度也会更高。Cristian等[38]通过对氧化钆纳米颗粒进行一定的修饰,在MRI与太赫兹成像中进行了细胞成像对比,结果发现,氧化钆对MRI图像对比度的影响有限,但太赫兹的成像对比度会随着纳米粒子浓度的增加而增强,可以看到更好的效果。
Zhang[12]使用了超顺磁性氧化铁纳米颗粒(SPIO)作为太赫兹生物成像的造影剂,在0.2 THz频点的连续太赫兹波反射成像系统上进行成像实验,该系统的分辨率为500 μm。通过外加交变磁场的激励,由于磁热效应,SPIO会加热周围的水环境,升温造成太赫兹波反射信号增强,从而提高太赫兹成像的对比度。首尔大学的Park等[39]则将SPIO用作为太赫兹成像与MRI的一种双成像造影剂进行了比较,并在小鼠体内利用分辨率为250 μm的太赫兹反射成像系统进行了成像实验。图14显示,二者都显示出了肿瘤的形状,表现为太赫兹反射强度的增加和MRI图像的变暗,且两者的信号强度均随SPIO的浓度而增大。结果表明,二者都具有良好的成像分辨率,但太赫兹成像可用于对手术过程中的监测,相较于MRI成像具有无损、实时、可视的特点。
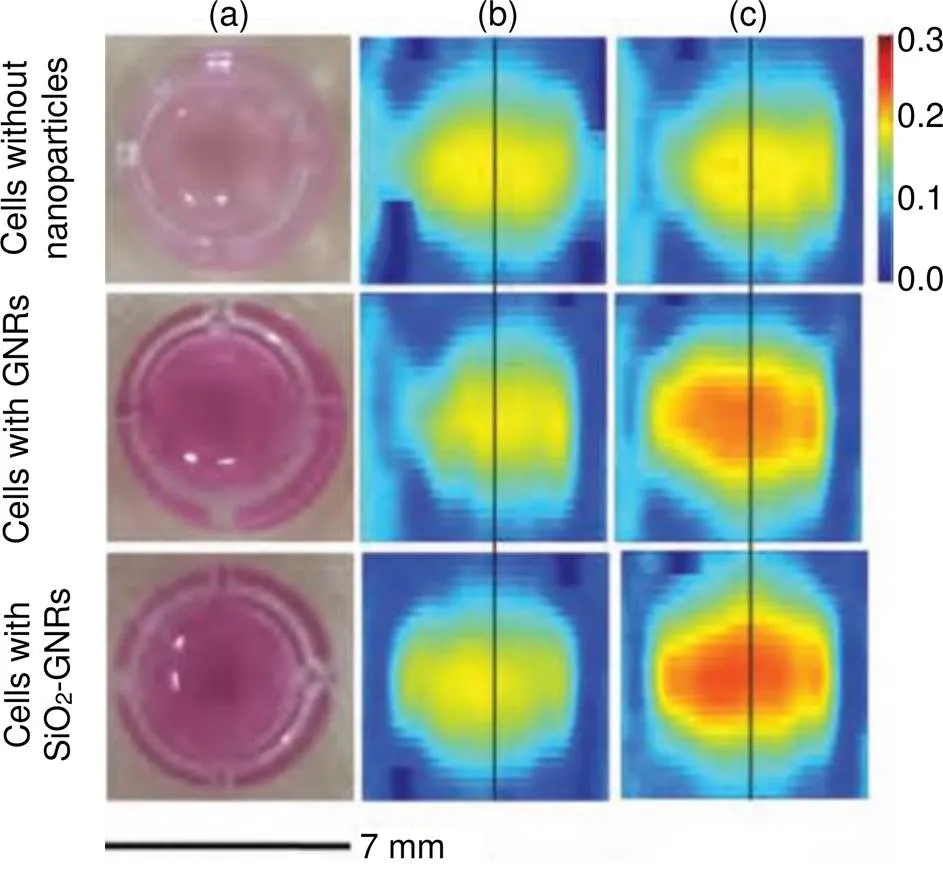
图14 含或不含纳米粒子的前列腺癌细胞及对照组。(a) 光学图像;(b) 在没有近红外激光照射的情况下获得的太赫兹图像;(c) 近红外激光照射后获得的太赫兹图像[13]

图15 小鼠体内肿瘤注射SPIO 24小时后的太赫兹(上)及MRI图像(下) [37]
阿肯色大学的Bowman等人[40]则提出以碳基纳米颗粒作为乳腺癌太赫兹成像的潜在造影剂,不像GNRs、SPIOs那样需要外部的激励,碳基纳米颗粒通过吸收太赫兹波产生的荧光效应能够直接进行对比成像。研究人员分别使用了微米金刚石、纳米金刚石(NDs)和纳米尺度洋葱状碳(OLC)经过扫描分辨率为400 μm的太赫兹脉冲成像系统在0.1 THz~4 THz频段进行了测试,结果显示,OLC与太赫兹信号的相互作用最明显,并且易被功能化修饰从而选择性地靶向癌细胞来实现成像。但由于对OLC的生物毒性的研究较少,他们只在乳腺肿瘤模型中进行了成像研究[41],在新鲜组织中的测试还需要进一步的研究。
6 总结与展望
太赫兹成像具有的无损性以及大量生物分子在太赫兹频段的指纹特性使其具有许多传统成像方式所不具备的特殊优势,能够准确识别生物组织结构,并有可能在如肿瘤切除等手术中实现实时监测。目前已在离体组织和部分浅表活体组织成像中得到应用。但是生物组织中主要存在的水分会对太赫兹波产生强烈的吸收,影响成像对比度,导致太赫兹成像在活体内的应用受到限制。发展太赫兹成像造影剂有望改善或解决该问题。在后续的研究中,将进一步发掘更高效、稳定且生物安全性高的太赫兹成像造影剂,有望促进太赫兹医学成像的快速发展和临床应用。
[1] Yu C, Fan S T, Sun Y W,. The potential of terahertz imaging for cancer diagnosis: a review of investigations to date[J].2012, 2(1): 33‒45.
[2] Fan S T, He Y Z, Ung B S,. The growth of biomedical terahertz research[J].2014, 47(37): 374009.
[3] Kawase K, Ogawa Y, Watanabe Y,. Non-destructive terahertz imaging of illicit drugs using spectral fingerprints[J].2003, 11(20): 2549‒2554.
[4] Bowman T C, El-Shenawee M, Campbell L K. Terahertz imaging of excised breast tumor tissue on paraffin sections[J].2015, 63(5): 2088‒2097.
[5] Rong L, Latychevskaia T, Chen C H,Terahertz in-line digital holography of human hepatocellular carcinoma tissue[J].2015, 5: 8445.
[6] Bowman T, El-Shenawee M, Campbell L K. Terahertz transmission vs reflection imaging and model-based characterization for excised breast carcinomas[J].2016, 7(9): 3756‒3783.
[7] Wahaia F, Kasalynas I, Venckevicius R,. Terahertz absorption and reflection imaging of carcinoma-affected colon tissues embedded in paraffin[J].2016, 1107: 214‒219.
[8] Ji Y B, Lee E S, Kim S H,. A miniaturized fiber-coupled terahertz endoscope system[J].2009, 17(19): 17082‒17087.
[9] Oh S J, Kim S H, Jeong K,Measurement depth enhancement in terahertz imaging of biological tissues[J].2013, 21(18): 21299‒21305.
[10] Oh S J, Kang J, Maeng I,Nanoparticle-enabled terahertz imaging for cancer diagnosis[J].2009, 17(5): 3469‒3475.
[11] Lee D K, Kim H, Kim T,Characteristics of gadolinium oxide nanoparticles as contrast agents for terahertz imaging[J].2011, 32(4): 506‒512.
[12] Zhang R, Zhang L L, Wu T,Contrast-enhanced continuous-terahertz-wave imaging based on superparamagnetic iron oxide nanoparticles for biomedical applications[J].2016, 24(8): 7915‒7921.
[13] Huang Q Q, Zou Y, Zhong S C,Silica-coated gold nanorods with high photothermal efficiency and biocompatibility as a contrast agent forterahertz imaging[J].2019, 15(5): 910‒920.
[14] Hu B B, Nuss M C. Imaging with terahertz waves[J].1995, 20(16): 1716‒1718.
[15] Wu L M, Xu D G, Wang Y Y,Study ofbrain glioma in a mouse model using continuous-wave terahertz reflection imaging[J].2019, 10(8): 3953‒3962.
[16] Mahon R J, Murphy J A, Lanigan W. Digital holography at millimetre wavelengths[J].2006, 260(2): 469‒473.
[17] Mitchell H H, Hamilton T S, Steggerda F R,. The chemical composition of the adult human body and its bearing on the biochemistry of growth[J].1945, 158(3): 625‒637.
[18] Crawley D A, Longbottom C, Wallace V P,Three-dimensional terahertz pulse imaging of dental tissue[J].2003, 8(2): 303‒307.
[19] Bennett D B, Taylor Z D, Tewari PTerahertz sensing in corneal tissues[J].2011, 16(5): 057003.
[20] Tseng T F, Yang S C, Shih Y T,Near-field sub-THz transmission-type image system for vessel imaging[J].2015, 23(19): 25058‒25071.
[21] Fan S T, Ung B S Y, Parrott E P J,.terahertz reflection imaging of human scars during and after the healing process[J].2017, 10(9): 1143‒1151.
[22] Cassar Q, Al-Ibadi A, Mavarani LPilot study of freshly excised breast tissue response in the 300 – 600 GHz range[J].2018, 9(7): 2930‒2942.
[23] Kolesnikov A S, Kolesnikova E A, Popov A P,In vitro terahertz monitoring of muscle tissue dehydration under the action of hyperosmotic agents[J].2014, 44(7): 633‒640.
[24] Stylianou A, Talias M A. Nanotechnology-supported THz medical imaging[J].2013, 2(1): 100.
[25] Lee K, Jeoung K, Kim S H,Measuring water contents in animal organ tissues using terahertz spectroscopic imaging[J].2018, 9(4): 1582‒1589.
[26] Wallace V P, Fitzgerald A J, Shankar S,Terahertz pulsed imaging of basal cell carcinomaand[J].2004, 151(2): 424‒432.
[27] Fitzgerald A J, Wallace V P, Jimenez-Linan M,Terahertz pulsed imaging of human breast tumors[J].2006, 239(2): 533‒540.
[28] Ashworth P C, Pickwell-MacPherson E, Provenzano E,Terahertz pulsed spectroscopy of freshly excised human breast cancer[J].2009, 17(15): 12444‒12454.
[29] Oh S J, Kim S H, Ji Y B,Study of freshly excised brain tissues using terahertz imaging[J].2014, 5(8): 2837‒2842.
[30] Ji Y B, Oh S J, Kang S G,Terahertz reflectometry imaging for low and high grade gliomas[J].2016, 6: 36040.
[31] Tewari P, Bajwa N, Singh R Sterahertz imaging of rat skin burns[J].2012, 17(4): 040503.
[32] Arbab M H, Winebrenner D P, Dickey T CTerahertz spectroscopy for the assessment of burn injuries[J].2013, 18(7): 077004.
[33] Sim Y C, Park J Y, Ahn K M,. Terahertz imaging of excised oral cancer at frozen temperature[J].2013, 4(8): 1413‒1421.
[34] Oh S J, Maeng I, Shin H J,. Nanoparticle contrast agents for Terahertz medical imaging[C]//, 2008: 1‒2.
[35] Oh S J, Choi J, Maeng I,. High-sensitivity terahertz imaging technique using nanoparticle probes for medical applications[C]//, 2010: 52‒53.
[36] Oh S J, Choi J, Maeng I,Molecular imaging with terahertz waves[J].2011, 19(5): 4009‒4016.
[37] Oh S J, Huh Y M, Suh J SCancer diagnosis by terahertz molecular imaging technique[J].2012, 33(1): 74‒81.
[38] Cristian C R, Thomas S, Vasile DResearch on functionalized gadolinium oxide nanoparticles for MRI and THz imaging[C]//, 2018: 646‒649.
[39] Park J Y, Choi H J, Nam G E,.dual-modality terahertz/magnetic resonance imaging using superparamagnetic iron oxide nanoparticles as a dual contrast agent[J].2012, 2(1): 93‒98.
[40] Bowman T, Walter A, Shenderova O,A phantom study of terahertz spectroscopy and imaging of micro- and nano-diamonds and nano-onions as contrast agents for breast cancer[J]., 2017, 3(5): 055001.
[41] El-Shenawee M, Vohra N, Bowman T,. Cancer detection in excised breast tumors using terahertz imaging and spectroscopy[J].2019, 8(1‒2): 1‒9.
Research progress of terahertz medical imaging
Yan Zhiyao1, Huang Wanxia1, Huang Qingqing1, Zou Yi2, Zhu Liguo2, Shi Qiwu1*
1College of Material Science and Engineering, Sichuan University, Chengdu, Sichuan 610064, China;2Institute of Fluid Physics, China Academy of Engineering Physics, Mianyang, Sichuan 621900, China
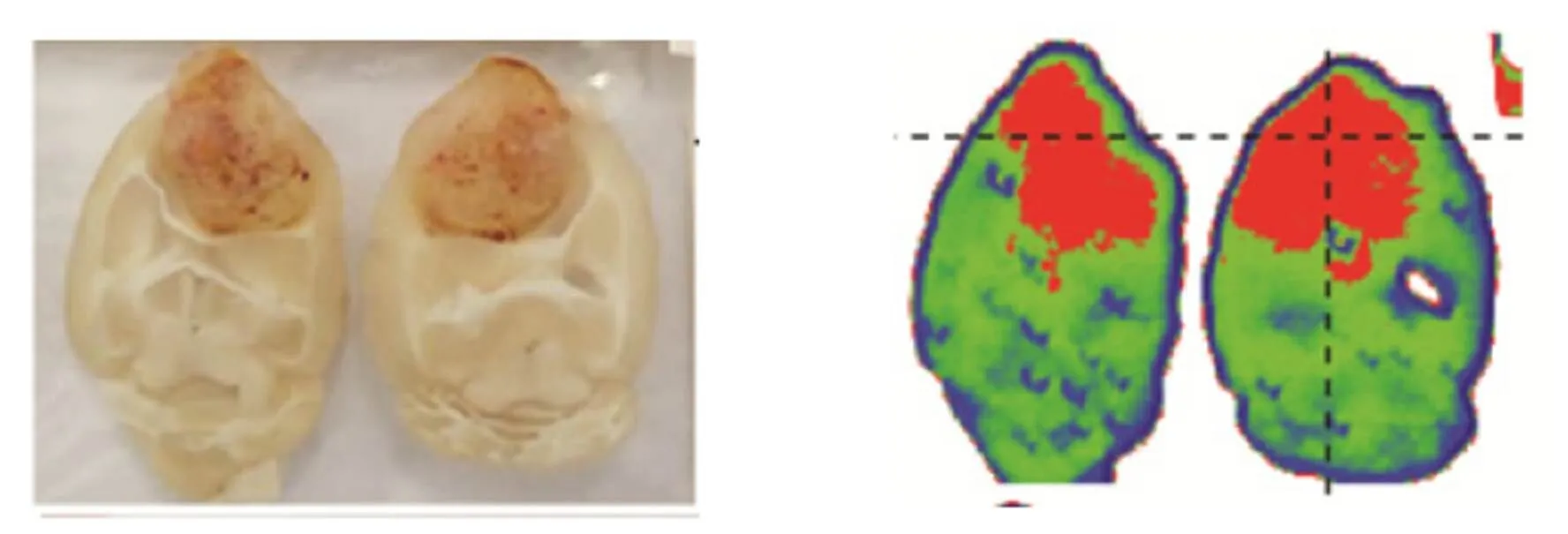
Visual and terahertz images of whole brain of rats with glioma
Overview:Terahertz, ranging from 0.1 THz to 10 THz, is situated in the frequency regime between optical and electronic techniques. Recently, with the rapid development of terahertz technology, it is widely applied in several fields such as material science, physics, chemistry, biology, and medicine. Due to the unique characteristics including low photon energy, excellent penetration ability through non-conducting materials and distinctive molecular fingerprints identification, terahertz medical imaging has become a promising imaging modality to date. It has been a significantly complementary medical imaging method, compared to other methods like magnetic resonance imaging (MRI), computed X-ray tomography (CT) and positron emission tomography (PET). And there has been an increasing interest in terahertz imaging for medical applications within the last few years, meanwhile, more and more terahertz imaging studies are being reported. In this review, we present a brief introduction on the terahertz imaging systems, and the applications of terahertz medical imaging from in vitro to in vivo.The essential mechanisms of terahertz medical imaging are based on the differences in water content and structural variations of tissues. But the abundant water in living tissues will strongly absorb terahertz wave, and lead to severely deteriorated imaging contrast. As a result, the terahertz medical imaging is mainly used in vitro or epidermal tissues. In most cases, the in vitro tissues should be pretreated with the processes including frozen sections, paraffin sections and so on. Many tissues have been studied by terahertz medical imaging in both human and animal models. Particularly, cancerous tissues of digestive system, reproductive system, integumentary system and respiratory system are focused. Brain, liver, breast tumors, for example, have been studied after different pretreatments. Fresh tissues directly excised from these tumors are also utilized to assess both water content and structural variations. While applied in vivo, skins are the main detected projects due to the penetration limit caused by water. In addition, some other methods have also been proposed to promote the application of terahertz medical imaging in the living body, such as endoscopy and penetration enhancing agents. Particularly, the nanoparticles contrast agents for terahertz medical imaging have been developed recently. This review concluded investigation of these contrast agents, including gold nanorods, gadolinium oxide nanoparticles, and superparamagnetic iron oxide nanoparticles. It seems that these contrast agents could enhance the imaging contrast largely, and would promote the application of terahertz medical imaging in vivo. Finally, the future development of terahertz medical imaging is prospected.
Citation: Yan Z Y, Huang W X, Huang Q Q,. Research progress of terahertz medical imaging[J]., 2020,47(5): 190721
Research progress of terahertz medical imaging
Yan Zhiyao1, Huang Wanxia1, Huang Qingqing1, Zou Yi2, Zhu Liguo2, Shi Qiwu1*
1College of Material Science and Engineering, Sichuan University, Chengdu, Sichuan 610064, China;2Institute of Fluid Physics, China Academy of Engineering Physics, Mianyang, Sichuan 621900, China
Terahertz wave has non-destructive nature and fingerprint characteristics for a large number of biomolecules, thus has a good application prospect in the field of medical imaging. In this review, we presented a brief introduction on the terahertz medical imaging systems, and the applications of terahertz medical imaging in biological tissues from in vitro to in vivo. Terahertz wave can be strongly absorbed by water, then the terahertz imaging contrast will be severely deteriorated in vivo. So the terahertz medical imaging was mainly used for detecting epidermal tissues or biological tissues with pretreatments, including excision, dehydration and so on. This review also concluded the recent development of nanoparticle contrast agents for improving the contrast of terahertz imaging in vivo. Finally, the future development of terahertz medical imaging was predicted.
terahertz; medical imaging; contrast; contrast agents
TN29;R318.6
A
严芷瑶,黄婉霞,黄青青,等. 太赫兹医学成像研究进展[J]. 光电工程,2020,47(5): 190721
10.12086/oee.2020.190721
: Yan Z Y, Huang W X, Huang Q Q,Research progress of terahertz medical imaging[J]., 2020, 47(5): 190721
* E-mail: shiqiwu@scu.edu.cn
2019-12-05;
2020-03-09
严芷瑶(1997-),女,硕士研究生,主要从事纳米功能材料制备与应用的研究。E-mail:754368485@qq.com
施奇武(1985-),男,博士,副教授,主要从事钒钛氧化物制备、相变性能与机制;材料与太赫兹波交互作用的研究。E-mail:shiqiwu@scu.edu.cn
版权所有©2020中国科学院光电技术研究所
