异甘草素通过降低ROS产生抑制顺铂诱导的NRK-52E细胞衰老
2020-06-02刁会王丽谭睿陟李健春樊均明
刁会 王丽 谭睿陟 李健春 樊均明,3
(西南医科大学 1附属医院肾病内科,四川 泸州 646000;2附属中医医院中西医结合研究中心;3成都医学院)
随着人口老龄化社会的到来,衰老和抗衰老研究已成为医学界的一大热点。目前衰老相关理论或学说包括氧化应激、遗传基因、线粒体DNA损伤、自由基、自身免疫、神经内分泌、体细胞突变、中医肾虚等学说。在中医理论中,肾中精气亏虚是衰老发生的根本机制之一,肾阴、肾阳的盛衰可直接、间接影响人的寿命和生命质量,故肾脏是衰老最重要的影响因素。顺铂(Cis)作为广泛用于临床治疗肿瘤(肺癌、卵巢癌、甲状腺癌等)的化疗药物〔1〕,其作用机制是与DNA结合,引起交叉联结,破坏DNA的功能,从而影响细胞的有丝分裂,因此Cis的使用过程中不可避免的也会产生一些副作用,包括引起急性肾损伤等肾毒性不良反应〔2〕。而Cis所致的肾损伤,目前除了肾脏替代治疗和水合疗法有一定的疗效外,尚缺乏更为有效的治疗手段。Cis及其代谢产物可能会通过肾小管上皮细胞外的离子转运通道被吸收〔3〕,毒物的重吸收使肾小管上皮细胞遭受到有害刺激,从而产生大量活性氧(ROS),使机体氧化和抗氧化系统平衡被破坏,氧化应激形成,而氧化应激又是导致肾小管上皮细胞损伤乃至衰老的关键因素〔4〕。因此,加强对Cis诱导的肾脏细胞衰老和氧化应激对防治肾脏损伤具有重要临床意义。 异甘草素(Iso)为甘草中的异黄酮类化合物,已有研究表明其具有较为广泛的药理活性〔5〕,本研究拟分析Iso对Cis及其代谢产物诱导大鼠肾小管上皮细胞NRK-52E衰老的作用及其相关机制。
1 材料和方法
1.1材料 NRK-52E细胞购自ATCC;胎牛血清(FBS) 购自Gemini公司;Cis购自西南医科大学附属医院肿瘤科;Iso购自普瑞法公司〔高效液相色谱法纯度>95 %〕; CCK-8试剂盒购自Promega公司;4,6-二氨基-2-苯基吲哚 (DAPI) 染料购自Vector公司;二氯二氢荧光素-二乙酸酯 (DCFH-DA) ROS检测试剂盒、异硫氰酸荧光素标记的膜联素Ⅴ/碘化丙啶 (AnnexinⅤ-FITC/PI) 细胞凋亡检测试剂盒、细胞衰老β半乳糖苷酶染色试剂盒购自碧云天生物科技公司;实时聚合酶链反应(PCR)试剂盒购自上海普洛麦格生物产品有限公司;白细胞介素(IL)-1、IL-6酶联免疫吸附试验(ELISA)试剂盒购自欣博盛生物科技有限公司;过氧化氢(H2O2)购自西南医科大学附属医院药房。
1.2NRK-52E细胞培养和实验分组 NRK-52E细胞用含10%FBS的DMEM高糖培养基培养于37℃、5%CO2环境,细胞汇合度达到90%~95%并处于对数生长期时,采用0.25%胰蛋白酶〔含乙二胺四乙酸(EDTA)〕消化传代备用。根据CCK-8法检测细胞活性结果,将细胞分为NC组,4 μmol/L Cis组,5、10、15 μmol/L Iso组,Cis+H2O2组,Cis+10 μmol/L Iso+0.02% H2O2组。
1.3CCK-8法检测NRK-52E细胞活性 NRK-52E细胞以5×104个/孔接种于96孔板,每组设5个复孔。培养24 h后,分别予以0、2、4、8、16 μmol/L Cis和0、5、10、15、20、25 μmol/L Iso刺激细胞48 h及0.000%、0.002%、0.005%、0.010%、0.020%、0.050%、0.100%、0.200%、0.500% H2O2刺激细胞30 min;吸出培养基,加入含100 ml/L CCK-8培养基,每孔100 μl,继续培养3 h。在酶联免疫检测仪450 nm处测量各孔吸光度 (A450) 值,根据结果计算Iso安全剂量范围、Cis有效毒性剂量范围及H2O2毒性剂量范围。
1.4衰老相关β半乳糖苷酶染色 在6孔板中,每孔接种5×104个细胞。培养24 h细胞贴壁后,给予处理,分为NC组,Cis组、5、10、15 μmol/L Iso处理细胞1 h后换液,再予以Cis联合Iso刺激细胞为Cis+Iso 5 μmol/L组、Cis+Iso 10 μmol/L组、Cis+Iso 15 μmol/L组。48 h后弃去培养基,磷酸盐缓冲液(PBS)清洗一次,加入1 ml β半乳糖苷酶染色固定液,室温固定15 min,吸除细胞固定液,用PBS或HBSS洗涤细胞3次,每次3 min。吸除PBS,每孔加入1 ml染色工作液(按说明书配制)。37℃孵育过夜(不能在CO2培养箱中进行),用保鲜膜封住6孔板防止蒸发。去除染色工作液,加入2 ml PBS,普通光学显微镜下观察并拍照。
1.5即时聚合酶链锁反应检测衰老相关分泌表型 引物由上海生物工程有限公司合成,GAPDH上游引物5′-ACAGCAACAGGGTGGTGGAC-3′,下游引物:5′-TTTGAGGGTGCAGCGAACTT-3′;转化生长因子(TGF)-β1上游引物:5′-GCGATCTAACCTGTTGCCTG-3′,下游引物:5′-AGCCATGGAGTAGACATCCG-3′;IL-1β上游引物:5′-TTCAAATCTCACAGCAGCAT-3′,下游引物:5′-AGGTCGTCATCATCCCAC-3′;IL-6上游引物:5′-AAAGAGTTGTGCAATGGCAATTCT-3′,下游引物:5′-AAGTGCATCATCGTTGTTCATACA-3′ ;肿瘤坏死因子(TNF)-α上游引物:5′-GGAAAGCATGATCCGAGAT-3′,下游引物:5′-GTAGACAGAAGAGCGTGGTG-3′。5×104个细胞接种于6孔板中。处理方法及培养时间同上。48 h后弃去培养基,PBS清洗一次,按照总 RNA试剂盒说明书提取细胞RNA,逆转录为cDNA,并按照试剂盒说明书进行实时PCR,反应条件:95℃ 2 min,40 个循环;95℃ 15 s;60℃ 1 min。以GAPDH内参进行校正后,比较循环阈值(CT) 的方法对靶基因IL-1β、IL-6、TNF-α、TGF-β mRNA表达水进行相对定量分析。
1.6ELISA检测衰老相关分泌表型 6孔板每孔接种5×104个NRK-52E细胞,处理方法及培养时间同上。48 h后,收集各组细胞培养上清,按照ELISA试剂盒说明书,检测IL-1β、IL-6,最后在酶联免疫检测仪450 nm处测量各孔的吸光度 (A450)值。
1.7AnnexinⅤ-FITC/PI双染色结合流式细胞术检测NRK-52E细胞凋亡 6孔板每孔接种5×104个NRK-52E细胞,处理方法及培养时间同上。分别收集每孔细胞培养液,加入(不含EDTA)的胰蛋白酶消化细胞,用相应的培养液终止消化;收集细胞悬液离心,弃上清;PBS重悬细胞,再次离心,用结合缓冲液重悬细胞,并取100 μl细胞悬液,加入5 μl AnnexinⅤ-FITC混匀后于室温避光封闭5 min,后加入10 μl PI,并加40 μl PBS调整每管细胞体积为500 μl,立刻进行流式细胞术检测。
1.8DCFH-DA染色法结合流式细胞术测定细胞内ROS水平 接种6孔板,每孔接种5×104个NRK-52E细胞,处理方法及培养时间同上。用无血清培养液稀释DCFH-DA (1∶8 000),弃孔内培养基,PBS清洗1次;每孔加入约1 ml已稀释的DCFH-DA,转移至培养箱内培养30 min;PBS洗涤细胞2次后,胰蛋白酶消化收集细胞。500 μl无血清培养液重悬细胞,过滤去除细胞团,流式细胞术采集数据。
1.9统计学分析 采用SPSS21.0、Graphpad Prism 7.0统计学软件进行单因素方差分析 (One-way ANOVA)。
2 结 果
2.1Cis诱导法建立NRK-52E细胞衰老模型 Cis能显著升高TGF-β1、TNF-α表达;不同浓度Cis造模,可引起肾小管上皮细胞产生衰老现象,以8 μmol/L以上Cis浓度可引起细胞形态的明显变化;综合以上结果,选择4 μmol/L Cis为最佳有效实验浓度。见图1,表1。
2.2Iso对Cis诱导NRK-5E细胞衰老的影响 CCK8法结果显示低于15 μmol/L的Iso无明显影响,15 μmol/L及以上浓度对细胞活性有显著抑制作用(P<0.01),其中NC组细胞活性为0.64±0.02,5 μmol/L Iso组为0.65±0.03,10 μmol/L Iso组为0.66±0.02,15 μmol/L Iso组为0.66±0.01,20 μmol/L Iso组为0.59±0.02,25 μmol/L Iso组为0.52±0.02。光学显微镜显示,与NC组比较,4 μmol/L Cis组细胞内有大量的细胞被染为深蓝色,部分细胞胞体萎缩或变大、漂浮;与4 μmol/L Cis组比较,Iso各剂量组细胞内被半乳糖苷酶染成蓝色的细胞数量明显减少,以10 μmol/L Iso尤为显著。见图2。
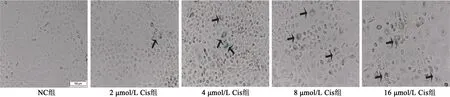
图1 不同Cis浓度处理下衰老相关β-半乳糖苷酶酶染色(×100)
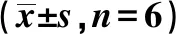
表1 各组TGF-β1、TNF-α比较
与NC组比较:1)P<0.05
2.3Iso对Cis诱导NRK-52E细胞衰老相关分泌表型的影响 实时PCR结果显示,与NC组相比,Cis组IL-1β、IL-6、TNF-α、TGF-β mRNA表达明显升高(P<0.05);Iso各剂量组与Cis组相比均显著降低(P<0.05)。ELISA结果显示,与NC组相比,Cis组IL-1β、IL-6表达显著升高(P<0.05);Iso各剂量组与Cis组相比,IL-1β、IL-6表达显著降低(P<0.05)。见表2。
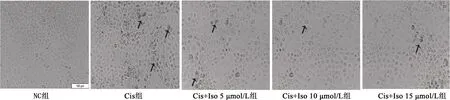
图2 衰老相关β半乳糖苷酶染色检测各组细胞衰老情况(×100)
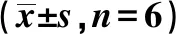
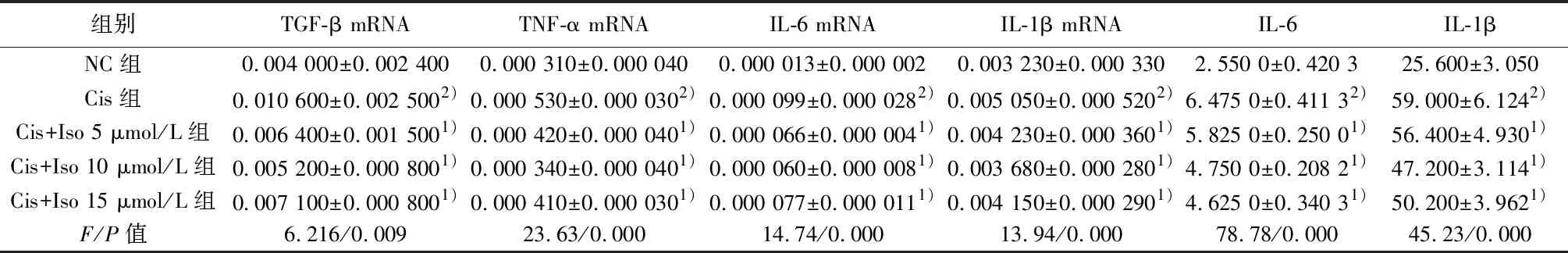
组别TGF-β mRNATNF-α mRNAIL-6 mRNAIL-1β mRNAIL-6IL-1βNC组0.004 000±0.002 4000.000 310±0.000 0400.000 013±0.000 0020.003 230±0.000 3302.550 0±0.420 325.600±3.050Cis组0.010 600±0.002 5002)0.000 530±0.000 0302)0.000 099±0.000 0282)0.005 050±0.000 5202)6.475 0±0.411 32)59.000±6.1242)Cis+Iso 5 μmol/L组0.006 400±0.001 5001)0.000 420±0.000 0401)0.000 066±0.000 0041)0.004 230±0.000 3601)5.825 0±0.250 01)56.400±4.9301)Cis+Iso 10 μmol/L组0.005 200±0.000 8001)0.000 340±0.000 0401)0.000 060±0.000 0081)0.003 680±0.000 2801)4.750 0±0.208 21)47.200±3.1141)Cis+Iso 15 μmol/L组0.007 100±0.000 8001)0.000 410±0.000 0301)0.000 077±0.000 0111)0.004 150±0.000 2901)4.625 0±0.340 31)50.200±3.9621)F/P值6.216/0.00923.63/0.00014.74/0.00013.94/0.00078.78/0.00045.23/0.000
与Cis组比较:1)P<0.05;与NC组比较:2)P<0.05
2.4Iso有效抑制Cis诱导的NRK-52E凋亡 流式细胞术检测Cis诱导后肾小管上皮细胞48 h后的凋亡情况,与NC组(12%)相比,Cis组凋亡(61%)明显增多(P<0.01);与Cis组相比,Cis+Iso 5 μmol/L、Cis+Iso 10 μmol/L、Cis+Iso 15 μmol/L组细胞凋亡(25%、23%、33%)明显减少(P<0.01)。见图3。
2.5Iso抑制Cis诱导的细胞内ROS水平升高 CCK-8法结果显示0.02%浓度以上的 H2O2处理NRK-52E细胞30 min后对细胞活性有明显抑制作用;流式检测ROS水平的结果显示,与NC组相比,Cis组产生ROS的细胞数明显增加(P<0.01);与Cis组相比,Cis+Iso 10 μmol/L组ROS水平显著降低;加入H2O2后的各组均较未加入前明显增加(P<0.01);但Cis+H2O2+Iso 10 μmol/L组ROS表达水平显著低于Cis+H2O2组(P<0.01)。见图4,图5。
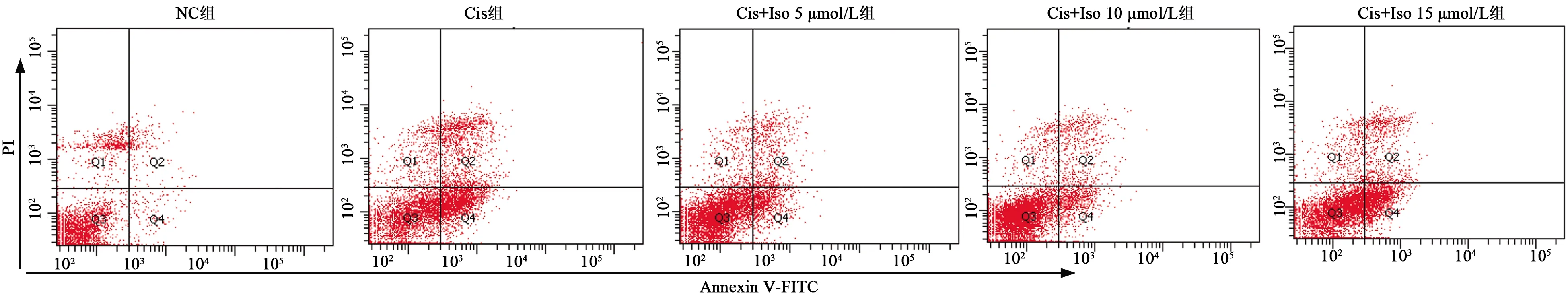
图3 流式细胞术检测各组细胞凋亡
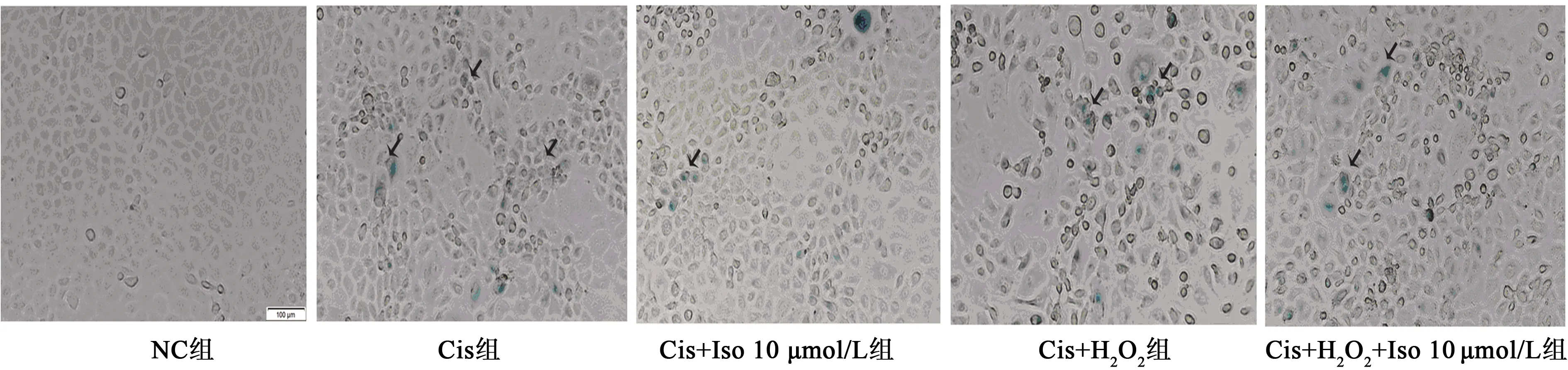
黑色箭头指示蓝色深染衰老细胞图4 衰老相关β-半乳糖苷酶染色检测各组细胞衰老情况(×100)
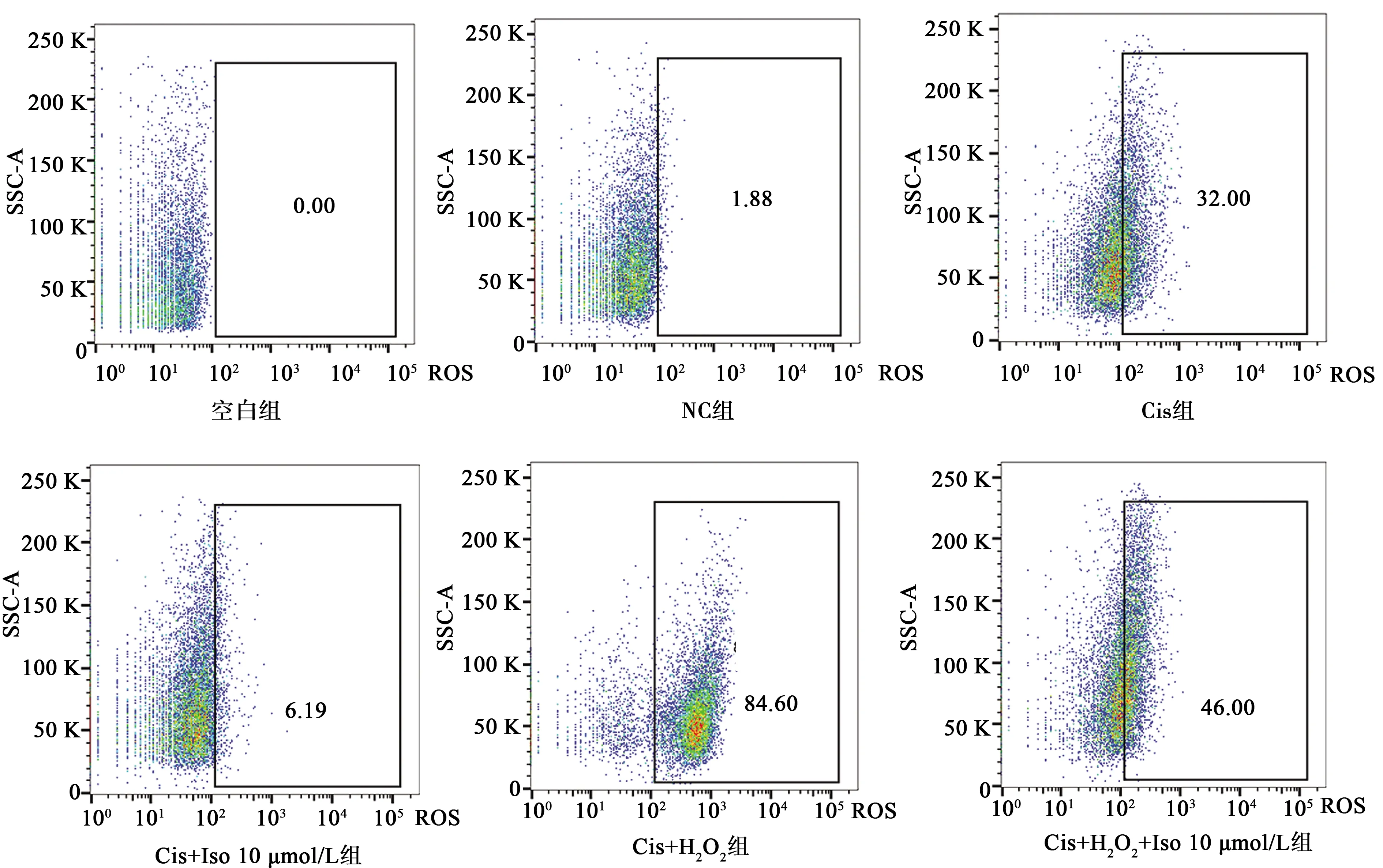
图5 流式细胞术检测各组ROS变化
3 讨 论
Cis是一种治疗恶性肿瘤的重要抗癌药物,但具有毒性副作用,如耳毒性、肾毒性和神经毒性。尽管进行预防性水合疗法,但仍有约30%的CP患者会出现肾毒性〔6〕。既往研究表明〔7〕,ROS的产生参与了Cis诱导的肾毒性发展。ROS可诱导炎性细胞因子如TNF-α及其他氧化介质的产生。这些炎症和氧化介质导致肾小管细胞和肾组织损伤。研究发现〔8〕,肾小球、肾小管,特别是近曲小管和集合管是Cis肾损伤的主要靶位,而其发病机制与氧化应激有密切关系。Cis通过肾小管上皮细胞的重吸收进入细胞后可破坏线粒体结构,使ROS产生增加。而大量的ROS可诱导内质网腔内钙离子向胞质释放,引发内质网应激。由此可见,氧化应激在Cis诱导的细胞衰老中起重要作用,与其他途径互为因果关系,共同加速细胞衰老甚至凋亡。本研究发现Cis对NRK-52E细胞刺激48 h 后,细胞内ROS水平明显增加,并用衰老相关β-半乳糖苷酶染色等一系列实验验证细胞衰老现象的出现,证明建模成功。
Iso为甘草中的异黄酮类化合物,已有研究表明Iso具有较为广泛的药理活性,如抗肿瘤、抗氧化、抗炎及对心脏和脑的保护等作用〔9〕。Zhao等〔10〕研究发现Iso可通过抑制M2巨噬细胞极化而有效防治大肠杆菌相关肿瘤的发生。Denzer等〔11〕证明在氧化和亚硝化应激细胞模型中,Iso能改善线粒体功能。任欢欢等〔12〕通过Iso预处理可以逆转I/R诱导的损伤效应,减轻I/R心肌损伤,作用机制可能与其抗氧化、抗炎和抗凋亡作用相关。而Cis诱导的肾小管上皮衰老细胞通过自分泌和旁分泌途径分泌大量促炎因子、趋化因子、生长因子和蛋白酶等,影响临近细胞和组织的微环境,加速衰老,衰老细胞的这一特征被定义为衰老相关分泌表型(SASP),常见的SASP有:IL-1β、IL-6、IL-8、TNF-α、TGF-β等。Zhang等〔13〕研究证明Iso能抑制IL-1β诱导的关节软骨细胞基质金属蛋白酶的产生,Chen等〔14〕研究表明Iso通过阻断IL-6信号传导抑制多发性骨髓瘤的生长,本实验证实Iso能降低细胞衰老相关表型,减缓细胞衰老,与既往不同疾病中的研究结果相似,但关于Iso对Cis诱导肾小管上皮细胞凋亡前衰老过程的影响研究甚少。Patricia Moreno-Londoo等〔15〕研究表明Iso预处理可减轻Cis诱导的近端小管细胞的死亡,增强Cis膀胱癌T24细胞株的毒性。本研究结果显示,Iso能有效抑制Cis诱导的 NRK-52E 细胞衰老,提高细胞存活率,其机制可能与抑制ROS产生有关。在细胞氧化应激研究中,Wang等〔16〕发现通过增加H2O2,可刺激ROS的表达,而Vashistha等〔17〕证实在HG培养基中ROS代谢显著增加,与通过细胞凋亡和获得衰老表型的细胞死亡增加有关。本研究结果提示Iso可通过降低ROS的产生抑制Cis诱导的大鼠NRK-52E细胞衰老。
综上,Iso可能通过降低 NRK-52E 细胞内ROS 水平,减少衰老相关表型的表达,从而抑制细胞衰老。由此推测,在临床上,对于Cis化疗的肿瘤患者,适当加用Iso治疗,不仅增强Cis抗肿瘤作用,还能缓解Cis引起的肾脏衰老。
