基于CT影像组学模型鉴别肾乏脂肪血管平滑肌脂肪瘤与均质肾透明细胞癌
2020-06-02杨光杰苗文杰龚爱迪赵钰鋆崔景景华闻达王振光
颜 蕾,杨光杰,聂 佩,苗文杰,龚爱迪,赵钰鋆,崔景景,贾 妍,华闻达,王振光*
(1.青岛大学医学部,山东 青岛 266100;2.青岛大学附属医院PET/CT中心,3.放射科,山东 青岛 266100;4.慧影医疗科技有限公司,北京 100089)
肾血管平滑肌脂肪瘤(angiomyolipoma, AML)是肾脏最常见良性肿瘤,典型AML含有明显脂肪成分[1],而少数缺乏或仅含有少量成熟脂肪成分,被称为肾乏脂肪血管AML(fat-poor angiomyolipoma, fp-AML),影像学表现与无坏死、囊变和出血的均质肾透明细胞癌(homogeneous density clear cell renal cell carcinoma, hd-ccRCC)相似[2],但临床诊疗方式迥异,故术前定性诊断极为重要。既往研究[3]表明,平扫CT值较高及增强扫描中延迟强化方式支持肾fp-AML诊断,但其特异性较低,且在fp-AML和hd-ccRCC间存在重叠[4]。影像组学作为新兴的肿瘤辅助检测和诊断技术,能高通量提取定量图像的数学结构特征并转化为可挖掘量化的数据信息[5]。本研究基于增强CT影像组学特征联合临床特征建立综合模型,并验证其术前鉴别fp-AML与hd-ccRCC的效能。
1 资料与方法
1.1 一般资料 回顾性分析2010年7月—2017年12月于青岛大学附属医院接受术前CT增强扫描的fp-AML和hd-ccRCC患者。纳入标准:①术后病理证实为肾单发AML或肾透明细胞癌(clear cell renal cell carcinoma, ccRCC);②术前增强CT资料完整且图像质量达分析要求;③fp-AML平扫及增强CT扫描无肉眼可见脂肪密度影;hd-ccRCC平扫及增强CT扫描无肉眼可见坏死、囊变及出血;④经随访获取所需临床资料。排除标准:①增强CT扫描前接受肿瘤相关放射化学治疗;②同时患有其他影响图像分析的肾疾病。共纳入32例fp-AML(fp-AML组)、39例hd-ccRCC(hd-ccRCC组)。fp-AML组男9例,女23例,年龄34~67岁,平均(50.6±8.7)岁;hd-ccRCC组男26例,女13例,年龄35~77岁,平均(58.2±11.4)岁。本研究经院伦理委员会批准。
1.2 仪器与方法 采用Siemens 64排螺旋CT(Somatom Sensation 64)及双源CT机(Definition Flash),球管旋转时间分别为0.50 s和0.28 s,探测器准直分别为64×0.6 mm和2×64×0.6 mm,螺距1.0,矩阵512×512,管电压120 kV,管电流220~250 mAs,层厚5 mm,层间距5 mm。嘱患者仰卧,屏气接受扫描;扫描范围自膈顶至肾脏下缘。先腹部平扫后,以高压注射器经肘静脉注入90 ml碘帕醇(350 mgI/ml)、流率3.0 ml/s后,分别延迟30 s、90 s、300 s行增强扫描,获得皮质期、实质期及排泄期图像。
1.3 CT图像分析与特征提取 从图像存储与传输系统(picture archiving and communications system, PACS)中以DICOM格式导出术前增强CT图像。由2名有3年(医师1)和10年(医师2)以上腹部CT诊断经验的放射科医师独立逐层手工勾画肿瘤病灶边界作为ROI(图1、2),由radiomics cloud platform分析平台分割出整个肿瘤,并自动保存病变容积ROI。经图像重采样及图像灰度标准化等预处理后,提取影像组学特征,计算观察者间组内相关系数(intraclass correlation coefficients, ICC)。2周后医师1对20例再次勾画ROI,计算观察者内ICC。提取的1 029个影像组学特征分为4组:①强度特征:由95个特征组成,通过常用和基本度量定量描绘CT图像内体素强度统计值;②形状特征:包含15个反映区域形状和大小的三维特征;③纹理特征:根据灰度共生矩阵、灰度游程矩阵和灰度区域矩阵计算量化区域异质性差异,得到295个纹理特征;④图像滤波特征:对原始图像进行滤波处理及小波变换后再次提取强度和纹理特征,使用指数、平方、平方根和对数4种类型滤波器,8种小波变换滤波器组合方式,即wavelet-LLL、wavelet-HHH、wavelet-HLL、wavelet-HHL、wavelet-LLH、wavelet-HLH、wavelet-LHL和wavelet-LHH。
1.4 影像组学特征筛选及影像组学得分计算 对观察者间及观察者自身ICC均>0.75的稳定且重复性好的影像组学特征进行后续分析。以LASSO回归算法进一步选择影像组学特征,10倍交叉验证选择模型中的最优调和参数λ来压缩模型系数,将无关变量的系数降于零,保留非零系数的变量[6]。对所选影像组学特征进行Logistic多元回归分析,并根据回归方程计算三期影像组学得分(radiomics score)。联合三期图像所有特征进行上述处理,得到三期联合影像组学得分。
1.5 临床特征 记录患者性别、年龄、身高、体质量、体质量指数(body mass index, BMI)及肿瘤位置,对fp-AML和hd-ccRCC临床特征进行单因素比较,筛选有鉴别意义者。
1.6 列线图绘制及其效能验证 通过Logistic多元回归分析,利用所选临床特征及最佳模型影像组学得分建立综合模型,并绘制列线图。以Hosmer-Lemeshow拟合优度检验评价列线图的拟合度,绘制校正曲线。以ROC曲线分析检测列线图的鉴别效能,以决策曲线评价列线图鉴别fp-AML和hd-ccRCC的净获益。
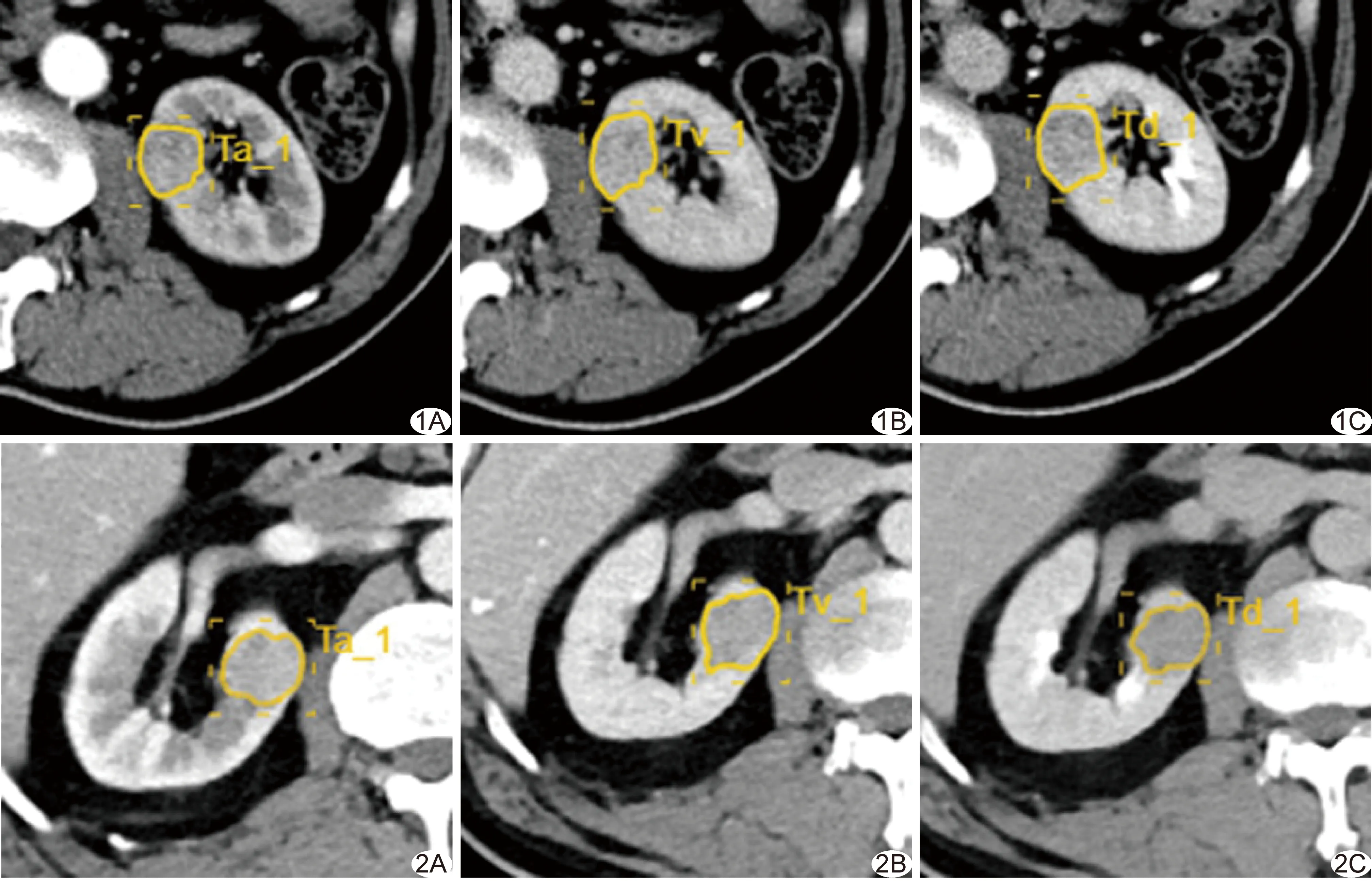
图1 患者男,65岁,fp-AML,三期CT增强扫描图像勾画ROI示意图 A.皮质期(Ta); B.实质期(Tv); C.排泄期(Td) 图2 患者男,47岁,hd-ccRCC,三期CT增强扫描图像勾画ROI示意图 A.皮质期(Ta); B.实质期(Tv); C.排泄期(Td)
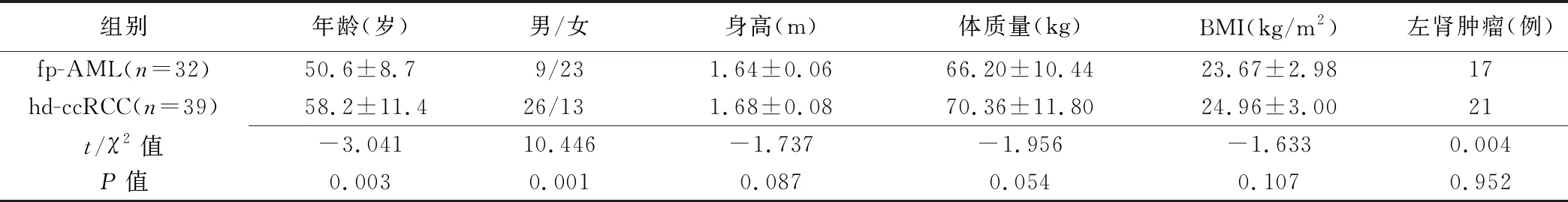
表1 2组临床特征比较
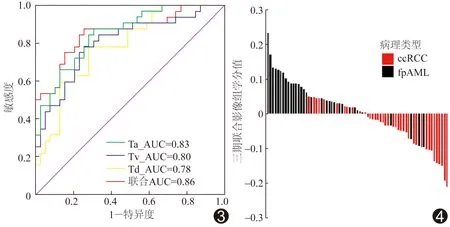
图3 皮质期(Ta)、实质期(Tv)、排泄期(Td)及三期联合影像组学得分鉴别fp-AML与hd-ccRCC的ROC曲线 图4 三期联合影像组学分图 得分>0预测为fp-AML,得分<0预测为hd-ccRCC
1.7 统计学分析 采用 R 软件Version:3.3.3(https://www.r-project.org)。以单因素分析比较组间临床因素,采用t检验及Mann-WhitneyU检验比较计量资料,计数资料采用χ2检验及Fisher精确概率法。LASSO回归采用“glmnet”包;ROC曲线分析采用“pROC”包;列线图和校正曲线绘制采用“rms”包;Hosmer-Lemeshow拟合优度检验采用“generalhoslem”包;决策曲线采用“dca.R.”包。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 2组临床特征比较见表1。组间年龄和性别差异有统计学意义(P=0.003、0.001),fp-AML更多见于女性人群,发病年龄比hd-ccRCC更低。组间身高、体质量、BMI和肿瘤位置差异均无统计学意义(P均>0.05)。
2.2 影像组学得分 于皮质期、实质期和排泄期分别获得824、937和849个影像特征。以LASSO回归进行特征选择后,分别于皮质期、实质期、排泄期和三期联合得到6、6、5和7个有重要鉴别意义的影像组学特征,以Logistic多元回归分析计算对应图像影像组学得分并进行ROC曲线分析(图3),计算AUC及敏感度、特异度。三期联合模型的影像组学得分鉴别fp-AML和hd-ccRCC的AUC最高 (表2)。绘制三期联合的影像组学得分图(图4)。
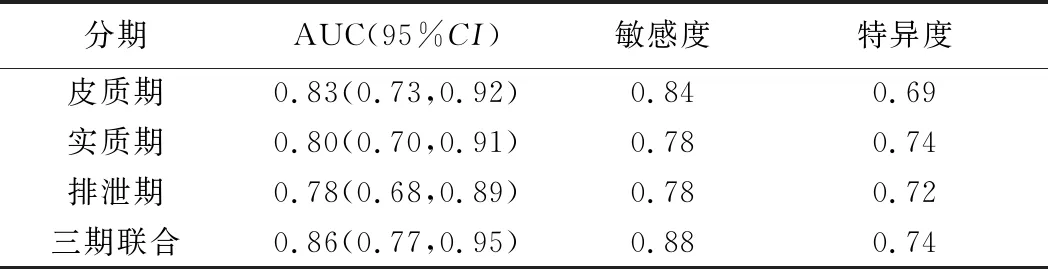
表2 各期图像影像组学得分ROC分析结果

图5 鉴别fp-AML和hd-ccRCC的列线图 根据患者性别、年龄及三期联合影像组学得分,通过多因素Logistic多元回归分析建模绘制的列线图
2.3 列线图建立及其效能验证 对组间差异有统计学意义的临床因素(性别、年龄)及三期联合影像组学得分进行Logistic多元回归分析并建模,回归方程为:Ln(P/1-P)=-3.51+age×0.09-radiomics score×20.31-sex×1.78,并绘制列线图(图5)。列线图ROC曲线的AUC为0.90[95%CI(0.81,0.99)],敏感度0.78,特异度1.00,比三期联合影像组学得分具有更高鉴别诊断效能。校准曲线表明列线图预测病理类型与术后病理的一致性较好(图6)。列线图的Hosmer-Lemeshow拟合优度检验差异无统计学意义(P=0.06),提示综合鉴别模型未偏离拟合。决策曲线(图7)表明列线图鉴别fp-AML与hd-ccRCC具有较好的净获益,且高于单纯三期联合影像组学得分。
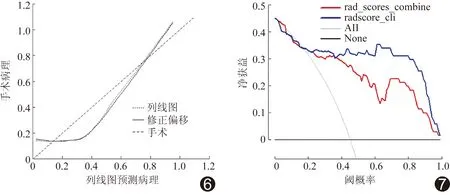
图6 列线图的校准曲线 图7 列线图的决策曲线
3 讨论
肾AML和ccRCC分属良性和恶性肿瘤,临床治疗策略及预后相差极大,因此术前准确定性诊断极为重要。肉眼观无脂肪成分的fp-AML和无坏死、囊变及出血的hd-ccRCC影像学表现缺乏特异性,给传统影像学鉴别诊断造成极大困难,导致fp-AML影像学误诊率较高[7]。本研究基于增强CT图像影像组学特征联合临床特征建立术前鉴别fp-AML与hd-ccRCC的综合模型,并绘制列线图,证实其良好的鉴别效能,AUC高达0.90,决策曲线分析表明其可获得较为满意的诊断净获益。
谢凯等[8]认为图像采集设备与参数不同会对影像组学特征产生影响,推荐使用同台或同种设备进行扫描;但对于少见病变,单一设备往往不能完成足够多病例数,也难以实现可供验证模型效能的大样本、多中心研究。在提取影像组学特征前对图像进行重采样和灰度标准化等预处理,可最小化不同设备造成的影响。
影像组学在肾脏肿瘤研究中应用广泛,包括鉴别良恶性肾肿瘤[9]、预测ccRCC病理分级[10]以及生存分析[11]等。既往研究[12-15]表明,基于影像组学的CT图像定量分析对鉴别fp-AML和ccRCC具有良好效能。LEE等[12]运用逻辑回归(LR)、k邻近(kNN)、支持向量机(SVM)和随机森林(RF)4种分类器对25例fp-AML和25例ccRCC进行鉴别,其中SVM的鉴别效能最高,AUC为0.78。FENG等[13]采用SVM对17例fp-AML和41例肾细胞癌(含31例ccRCC)进行鉴别析,得到AUC为0.86。HODGDON等[14]基于平扫图像的CT纹理分析鉴别16例fp-AML与84例肾细胞癌(含51例ccRCC),鉴别fp-AML的AUC为0.89。YAN等[15]通过CT纹理分析鉴别诊断18例fp-AML、18例ccRCC和14例乳头状肾细胞癌,错判率在9.3%以下。上述研究均基于数十个纹理特征,仅能表征肿瘤纹理方面的信息。本研究于各时相CT图像中提取更多影像组学特征,包括纹理及其外特征(如形状图特征、直方图特征等),有望对肿瘤进行更多维度的表征。另外,以往研究多基于肿瘤最大层面勾画ROI提取与分析二维特征。本研究提取三维特征,以更充分地反映肿瘤整体的异质性。fp-AML临床较为少见,本组纳入例数多于既往研究。另外,ccRCC常可见坏死、囊变和出血,而fp-AML则较均质。本研究hd-ccRCC组纳入标准为平扫及增强CT无肉眼可见坏死、囊变及出血,影像学表现与fp-AML更加接近,鉴别更接近临床实际。
本研究存在一定局限性:为单中心回顾性研究,所获模型的有效性有待多中心、大样本研究加以验证;勾画三维ROI较单层ROI工作量大,期待实现半自动或自动勾画,以提高效率。
综上所述,基于增强CT影像组学和临床特征建立的综合模型用于术前鉴别fp-AML与hd-ccRCC具有较高诊断效能,可获得较为满意的诊断净获益。
