胰腺腺鳞癌和导管腺癌影像学及病理学表现
2020-06-02田序伟马爱琳董家科杨泽宏
田序伟,马爱琳,董家科,杨泽宏,沈 君*
(1.喀什地区第一人民医院影像科,新疆 喀什 844000;2.中山大学孙逸仙纪念医院放射科,广东 广州 510120)
胰腺腺鳞癌(adenosquamous carcinoma of pancreas, ASqC)为罕见的原发胰腺上皮肿瘤的亚型,仅占胰腺腺癌的1%~4%[1],病理学上具有明显导管腺癌和鳞状细胞癌(简称鳞癌)特点,鳞癌分化至少占肿瘤30%[2]。胰腺浸润性导管腺癌(invasive ductal adenocarcinoma of pancreas, IDAC)是较常见的胰腺恶性肿瘤病理类型。ASqC与IDAC 的临床表现均缺乏特异性,术前难以鉴别诊断;而ASqC恶性程度更高,预后更差,患者生存时间更短[3],另一方面则对化学治疗更敏感[4],使得早期明确诊断对选择治疗方案具有重要意义。本研究对比分析ASqC和IDAC的影像学表现及病理特征,以期为鉴别诊断提供依据。
1 资料与方法
1.1 一般资料 回顾性分析2010年1月—2019年1月中山大学孙逸仙纪念医院经手术病理证实的11例ASqC(ASqC组)及22例IDAC(IDAC组)患者。ASqC组男8例,女3例,年龄50~79岁,平均(60.4±7.8)岁;IDAC组男、女各11例,年龄43~71岁,平均(56.8±9.7)岁。所有患者均无其他系统器质性病变。
1.2 仪器与方法 采用Siemens Sensation 64排CT仪,管电压120 kV,管电流为自动毫安(120~280 ms),螺距1∶1,球管转速0.6 s/r,准直层厚64×0.625 mm,层厚为5 mm,重建层厚1.25 mm,行腹部CT扫描。以3.0~3.5 ml/s流率经肘静脉团注对比剂碘海醇(300 mgI/ml,欧乃派克)80~100 ml后行3期动态增强扫描,扫描范围由隔顶至肾动脉水平,发现肝脾增大时扫描至肝/脾下级。
采用Philips Achieva 3.0T超导型MR扫描仪,16通道体部相控阵线圈,配合呼吸门控技术,嘱患者仰卧,行腹部扫描。序列及参数:轴位T2W,TR 1 650 ms,TE 80 ms,翻转角90°,层厚5 mm,层间距1 mm;冠状位T1W,TR 3.1 ms,TE 1.4 ms,翻转角10°,层厚6 mm,层间距3 mm;轴位m-DIXON T1W,TR 34 ms,TE 0 ms,翻转角10°,层厚6 mm,层间距3 mm;轴位扩散加权成像(diffusion weight imaging, DWI),b为0、800 s/mm2,TR 3 000 ms,TE 50 ms,翻转角90°,层厚6 mm,采集4个方向图像。以 0.1 ml/kg体质量经肘静脉注射钆对比剂(马根维显,Bayer Schering Pharma AG)后采集轴位与冠状位增强T1WI,参数同平扫。
1.3 图像分析 由2名影像科副主任医师采用盲法独立观察图像,意见不同时经讨论达成一致。观察肿瘤位置、形态、大小、边界、密度/信号及有无坏死、钙化、出血、动态增强特点及胆管与胰管扩张及周围侵犯、淋巴结转移情况。结合临床资料及病理报告分析并记录神经束受侵、Ki-67、淋巴结受累及脉管癌栓等。
1.4 统计学分析 采用SPSS 19.0统计分析软件。符合正态分布的计量资料以±s表示,非正态分布计量资料以中位数(上下四分位数)表示,计数资料以百分比表示。以独立样本t检验比较组间年龄差异;采用Fisher确切概率法比较组间性别、神经束侵犯、淋巴结转移、脉管癌栓及影像学特征的差异;以两独立样本非参数检验(Mann-WhitneyU检验)比较组间Ki-67及血清CA199差异。P<0.05为差异有统计学意义。
2 结果
2.1 临床及病理结果 2组患者性别、年龄差异均无统计学意义(χ2=1.55,t=3.25,P均>0.05)。ASqC组术前血清CA199为2.4~2 041 U/ml,中位值115.4 U/ml,其中8例(8/11,72.73%)高于正常值;IDAC组术前血清CA199为0.6~127 17 U/ml,中位值239.9 U/ml,其中19例(19/22,86.36%)高于正常值,组间差异无统计学意义(Z=-0.83,P=0.43)。2组神经束受侵、淋巴结转移及Ki-67差异无统计学意义(P均>0.05);ASqC组脉管癌栓比例高于IDAC组(χ2=5.80,P=0.02),见表1、图1D及图2D。
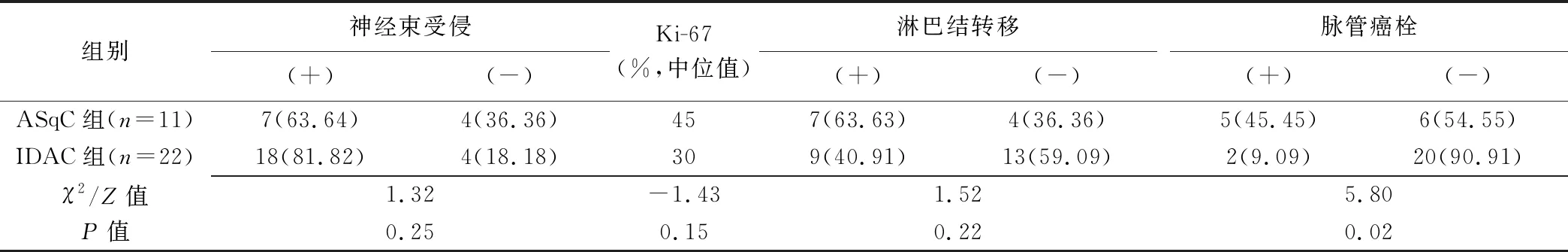
表1 组间病理结果比较[例(%)]
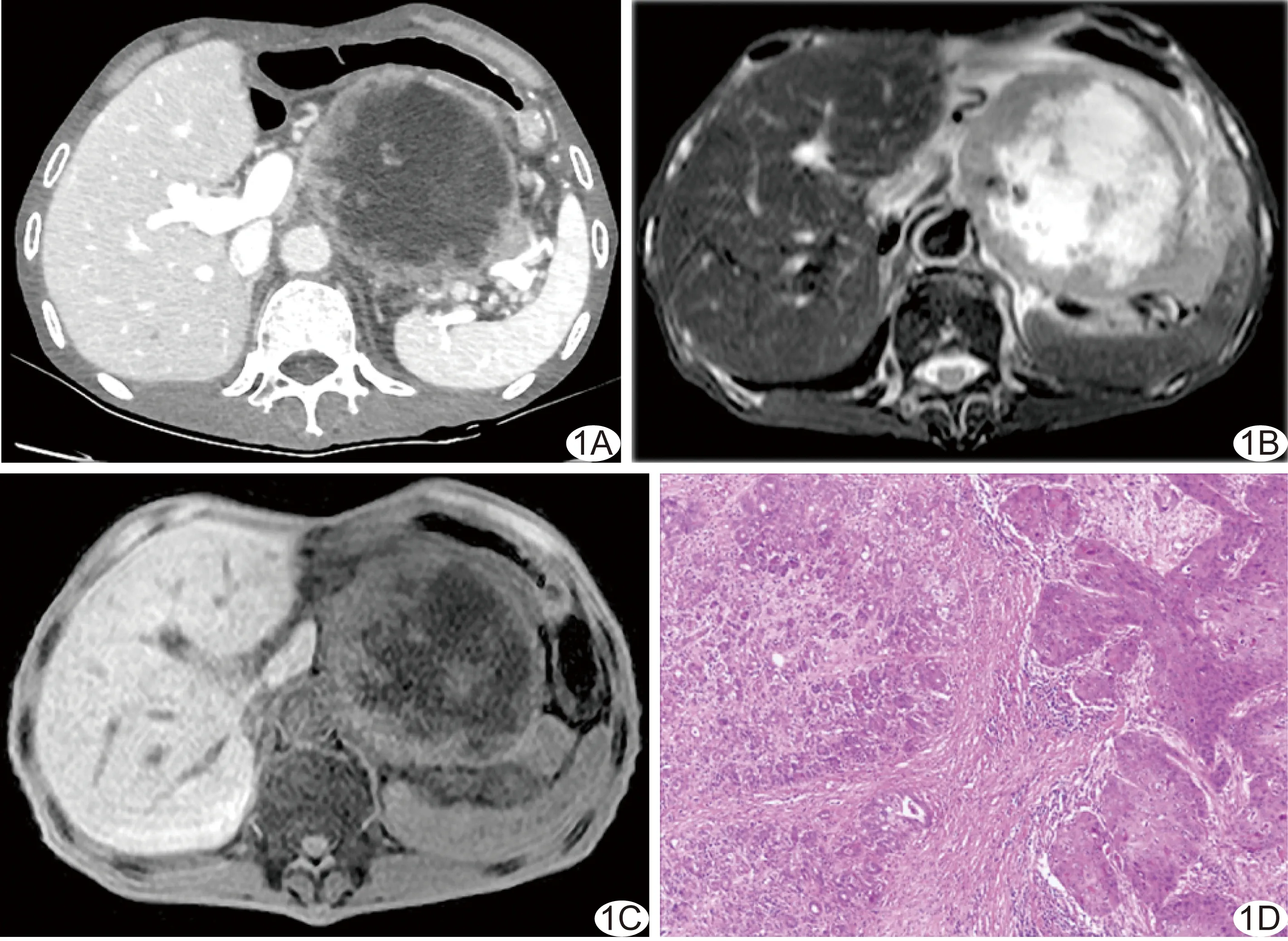
图1 患者男,62岁,ASqC A.门静脉期增强CT图像显示肿瘤实性部分持续强化; B.FS T2WI示病灶实性部分呈等信号,中心坏死部分呈高信号; C.FS T1WI示病灶实性部分等信号,中心坏死部分低信号; D.病理图(HE,×40)
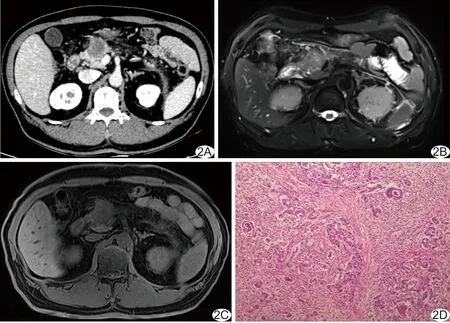
图2 患者男,52岁,IDAC A.门静脉期增强CT图像显示病灶持续轻度强化; B.FS T2WI示病灶呈等稍高信号; C.FS T1WI示病灶呈稍低信号; D.病理图(HE,×40)
2.2 影像学特征 ASqC组11例中,5例接受CT及MR平扫+增强,3例仅接受CT平扫+增强,3例仅接受MR平扫+增强。IDAC组22例均接受CT及MR平扫+增强。
CT显示ASqC组与IDAC组病变直径分别为(53.86±23.28)mm与(28.38±9.12)mm。ASqC组1例出现出血,无钙化病例,而IDAC组无出现出血及钙化。ASqC组4例(4/11,36.36%)胆管扩张、6例(6/11,54.55%)主胰管扩张,IDAC组11例(11/22,50%)胆管扩张、16例(16/22,72.73%)主胰管扩张,组间差异无统计学意义(χ2=0.55、1.09,P=0.30、0.46)。2组病变部位差异无统计学意义(P>0.05),而病变形态、直径、中心坏死比例及病灶强化峰值时间差异均有统计学意义(P均>0.05),见表2及图1A、2A。
MRI示ASqC组均呈T1WI等稍或低信号、T2WI等或高信号,动态增强多以第4期强化程度明显。IDAC组T1WI及动态增强病灶信号与ASqC组差异不明显,而T2WI信号低于ASqC组(图1B、1C,图2B、2C)。DWI示2组病灶信号均增高,ADC图信号减低,ASqC组病灶信号变化更明显。
3 讨论
大多数胰腺恶性肿瘤为IDAC,而ASqC为其中一种罕见亚型,据报道[2]男性发病率较高,男女比例为1.5∶1;发病年龄一般为60岁左右。本组患者年龄(60.4±7.8)岁,男性比例(72.73%)明显居多;临床表现均为腹痛、黄疸及体质量下降等,与既往报道[5-6]相符。
ASqC影像学表现无明显特异性,难以与IDAC鉴别,术前诊断存在一定困难。组织病理学上,ASqC既有导管腺癌成分,亦含鳞癌成分,而鳞癌相比腺癌恶性程度更高,倍增速度超过腺癌1倍以上,肿瘤迅速生长导致血供不足,更易出现中央液化坏死[7-8]。本研究CT显示ASqC组90.91%出现中央坏死,而IDAC组仅31.82%,且ASqC组为中央大面积坏死,IDAC为斑片状坏死,与苏建伟等[9]的结果相符。ASqC组81.82%、而IDAC组仅31.82%病变直径≥30 mm,可能由于ASqC同时含鳞癌和导管腺癌,肿瘤生长较快,故影像学检出肿瘤时其体积多已大于IDAC。本研究ASqC组63.64%病灶呈类圆形或分叶状,而IDAC组81.82%病灶呈不规则形。病理学上鳞癌多呈较密集的巢状排列,而导管腺癌多呈管状或筛状排列[10],即鳞癌细胞更集中、密实,而导管腺癌间质更丰富。另外,病理学上导管腺癌呈不同分化的腺体样或小管样[11],故其形态更趋向不规则。
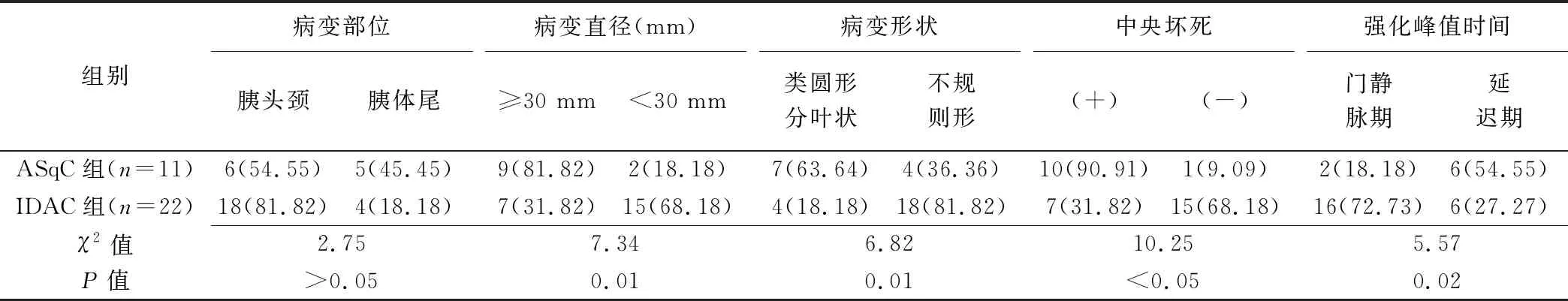
表2 2组CT特征比较[例(%)]
胰腺癌细胞生长速度快、细胞密度大、异型性明显,细胞外间隙较正常胰腺组织减小,血供差异明显,导致胰腺癌组织水分子扩散不同于正常胰腺组织[12-13];而ASqC与IDAC肿瘤细胞排列不同,DWI表现亦可能不同。本研究ASqC组与IDAC组DWI均可见水分子弥散受限,而相同条件下ASqC受限程度明显高于IDAC。增强CT示2组病灶均不均匀强化,呈环状或分隔状,由病灶边缘向中央渐进性强化,ASqC组75%病灶强化峰值出现于延时期,而IDAC组则多出现于门静脉期(72.73%)。动态增强MRI示2组病灶均于第4期强化程度较高,组间未见明显差异,可能与鳞癌细胞快速增殖和血管过度形成有关[14]。病理学上,2组均存在神经受侵和淋巴结转移,表现出恶性肿瘤的共同特性;而ASqC组出现脉管癌栓比例高于IDAC组,可能由于鳞癌细胞血管过度形成和易于发生坏死所致[15]。
综上所述,ASqC与IDAC均为胰腺恶性肿瘤,但其影像学及病理学表现存在一定差异,结合临床有助于鉴别诊断。本研究主要局限性为样本量较少,尤其ASqC组更少,不可避免在一定程度上影响结果,有待增加样本量进一步观察。
