2型糖尿病合并骨量异常患者血尿酸水平的变化
2020-06-02王雪莲吴乃君程梦凡
王雪莲 吴乃君 程梦凡
华北理工大学附属医院内分泌科 河北唐山 063000
2 型糖尿病(T2DM)合并骨质疏松症患病率逐年上升,可达9.8%~66.1%[1]。临床研究及Meta分析发现T2DM 增加骨质疏松性骨折的风险[2-3],且在T2DM 患者中,骨量减低及骨质疏松与全因死亡率之间的关系也已得到证实[4]。文献报道骨量减少者的骨折风险高于正常人,且约有50%的骨质疏松性骨折发生在骨量减少阶段[5],可严重危害T2DM 患者的生活质量和生命安全。有研究显示氧化应激和低循环浓度抗氧化剂参与T2DM 患者骨质疏松症的发生和发展[6]。T2DM 患者常伴有高尿酸(UA)血症,UA 作为一种内源性抗氧化剂,推测其可通过抗氧化应激效应对骨骼发挥有益作用,目前较多研究显示UA 在骨健康方面有保护 作 用[7,12-15],高UA 水 平 与 高 的 骨 密 度(BMD)和低的骨折风险相关[8]。但也有研究得出相反结论[9]。因此,血UA 水平对骨骼的影响是否是“双刃剑”,仍需进一步研究,本文旨在分析T2DM 合并骨量异常患者血UA 水平的变化,为临床预防骨折提供依据。
1 对象与方法
1.1 研究对象 随机选取2018 年12 月~2019年5月在华北理工大学附属医院内分泌科住院的T2DM 患者110 例,男47 例,女63例;110例患者均符合1999年WHO 糖尿病诊断标准。排除标准:①1型糖尿病、特殊类型糖尿病、近3月来发生糖尿病酮症酸中毒等急性并发症;②继发性骨质疏松症,如甲状腺、甲状旁腺、肾上腺或性腺疾病等;③严重心、肺、脑、肝、肾、精神等疾病;④合并肺部疾病、感染性疾病、免疫缺陷性疾病、甲状腺疾病、恶性肿瘤、急慢性肝、肾功能不全者;⑤入组前6个月内服用影响骨代谢的药物,如钙剂、维生素D、肾上腺皮质激素、性激素、噻唑烷二酮类药物及影响UA 生成和排泄的药物。110例患者均经双能X 线骨密度仪(DXA)测定BMD,依据1995年WHO 骨质疏松诊断标准:T≥-1为骨量正常,T≤-2.5为骨质疏松,-2.5<T<-1,为骨量减低。根据T 值将其分为骨量正常组、骨量异常组,进一步分层分析时将骨量异常组依据T 值分为骨量减低组、骨质疏松组。
1.2 方法 一般资料收集:入组患者均准确记录年龄、糖尿病病程,测量身高、体质量、腰围(测两次取平均值)、体质量指数(BMI)=体质量(kg)/身高2(m2)。实验室检查:所有研究对象于夜间12点以后均禁食,于晨起空腹采集肘静脉血测定空腹血糖(FPG)、空腹C 肽(FCP)、空腹胰岛素(FINS)、糖化血红蛋白(Hb A1c)、血尿酸(UA)、血脂,计算胰岛素抵抗指数(HOMA-IR)=FPG(mmol/L)×FINS(mU/L)/22.5、胰岛素分泌指数(HOMA-IS)=20×FINS(mU/L)/(FPG(mmol/L)-3.5)。
1.3 统计学方法 采用SPSS 17.0统计软件进行统计分析,计量资料采用t检验,数据用(x±s)表示;计数资料比较采用χ2检验,用例表示,T2DM 患者BMD 异常的危险因素采用二分类Logistic回归分析,P <0.05差异有统计学意义。
2 结果
2.1 两组临床资料和实验室检查指标比较 骨量异常组患者年龄、病程显著高于骨量正常组,BMI、UA 及腰椎、股骨颈、全髋BMD 水平显著低于骨量正常组,差异有统计学意义(P<0.05);两组间性别构成比、腰围、Hb A1c、FPG、FCP、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDLC)、HOMA-IR、HOMA-IS差异均无统计学意义(P >0.05),见表1。
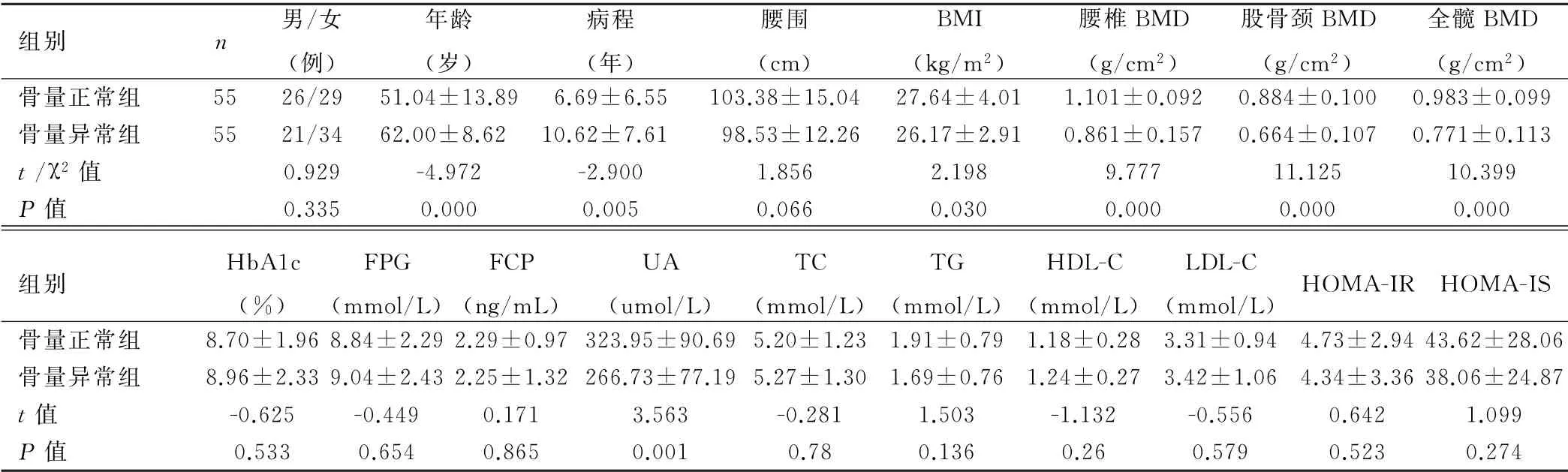
表1 两组患者临床资料和实验室检查指标比较(x±s)
2.2 T2DM 合并骨量异常患者不同骨量亚组血UA 水平比较 进一步分层分析显示,骨质疏松组血UA 水平显著低于骨量减低组,差异有统计学意义(P <0.05),见表2。

表2 T2DM 合并骨量异常患者不同骨量亚组血尿酸水平比较
2.3 T2DM 骨量异常危险因素分析 在110例T2DM 患者中,以是否合并骨量异常(骨量减低及骨质疏松)(是=1,否=0)为因变量,以患者年龄(≥60岁为1,<60岁为0)、BMI(<25kg/m2为1,≥25kg/m2为0)、T2DM 病程(≥10年为1,<10年为0)、血UA 水平(男≤420μmol/L;女≤360μmol/L 为 1,男 >420μmol/L;女>360μmol/L 为0)为自变量,进行二分类Logistic回归分析。结果显示:高龄、低血UA 水平与T2DM 患者BMD 下降独立相关(P <0.05),见表3。

表3 T2DM 患者骨量异常危险因素二分类Logistic回归分析
3 讨论
UA 是嘌呤代谢的中间产物,也是人体重要的内源性抗氧化剂,有研究认为当血UA 水平异常增高时,可在关节处出现UA 盐沉积,诱发痛风,限制关节活动,从而减弱对骨骼及成骨细胞的机械刺激作用,导致骨量下降。体外实验证明UA 盐沉积会促进破骨细胞的发展、抑制成骨细胞的生成,且可增加骨质破坏,甚至发生骨折[10]。此外,过高的UA 水平促使内皮细胞功能紊乱,影响骨的供血[11],导致BMD 下降。而另有研究发现[12-13]在T2DM 患者中,骨质疏松患者较非骨质疏松患者血UA水平明显降低。经相关分析显示,BMD 与血UA 呈正相关。张云[14]、修双玲[15]等进一步回归分析显示,血UA 与BMD 独立相关,低血UA 水平与T2DM 患者BMD 下降独立相关,偏高血UA 水平可能是BMD 的保护因素。
本研究与大多数既往研究结果相似:T2DM 骨量异常组血UA 水平较骨量正常组显著下降,进一步将T2DM 骨量异常组分为骨量减低组和骨质疏松组分析显示,骨质疏松组血UA 水平显著低于骨量减低组,差异有统计学意义(P <0.05)。经二分类Logistic回归分析显示,低血UA 水平与T2DM 患者骨量下降独立相关(OR=6.388,P =0.03)。目前,血UA 与BMD 相关机制尚无定论,大多数学者考虑其对BMD 发挥保护作用可能的机制有:①UA 作为内源性抗氧化物质,具有螯合金属离子,清除超氧化物、羟自由基的作用,并阻断强氧化剂形成[16],同时能阻止细胞外超氧化物歧化酶的降解,抑制活性氧所致的一系列氧化应激损伤[17]。因此UA 可减弱氧化应激对成骨的不利影响,抑制破骨细胞生成,减少破骨细胞前体活性氧的产生,从而发挥骨保护作用,减少骨质疏松的发生[18]。②UA 与骨形成蛋白的多态性有关[19],影响骨转换过程。除了可使BMD 增加外,男性UA 水平在改善骨骼僵硬度方面也可降低骨折的发生风险[20]。③有研究表明血UA 水平与25(OH)D 水平呈正相关[21],推测血UA 有可能通过提升活性维生素D 水平,促进肠钙吸收,增加BMD。④朱晓琳等发现UA 可抑制人骨髓间充质干细胞(h BMSCs)向脂肪细胞的诱导分化[22],具有浓度依赖性和时间依赖性。且可通过下调11B-HSDl m-RNA 的表达,上调BMP-2 mRNA、cbfa1/Run×2的表达,促进h BMSCs向成骨细胞增殖和分化,降低破骨细胞前体氧自由基的生成[23-25]。
综上所述,低血UA 水平可能是T2DM 患者骨量下降的危险因素,但需大样本前瞻性研究进一步证实。本研究结果提示T2DM 患者需动态监测血UA 水平,对于T2DM 合并骨量异常同时又伴有高UA 者,应将血UA 水平控制在适当水平,不宜降至过低,以免加重骨量流失。
