2型糖尿病合并非酒精性脂肪肝患者内脏脂肪指数相关研究
2020-06-02程梦凡吴乃君王雪莲
程梦凡 吴乃君 王雪莲
华北理工大学附属医院内分泌科 河北唐山 063000
非酒精性脂肪肝病(NAFLD)最早由Ludwig提出,糖尿病、内脏脂肪堆积、高胰岛素血症等是其高危因素[1]。有数据报道我国NAFID 发病率为20%~33%,而T2DM 患者的NAFLD 发生率为49%~62%[2]。肥胖人群NAFLD 的发病率为18%~50%[3-4]。反映肥胖的指标有很多,有研究者[5]指出内脏脂肪指数(VAI)可间接反映内脏脂肪分布及功能,可以作为评估内脏脂肪功能的一个简单工具。也有研究者[6]认为VAI并不能很好反映内脏脂肪功能。VAI与代谢相关疾病的研究是近几年的热点,主要集中在糖尿病和心血管疾病方面,在NAFLD 方面的研究较少。本组资料通过病例对照研究探讨VAI是否能取代传统体脂指标作为预测T2DM 合并NAFLD 的风险因素。
1 资料与方法
1.1 一般资料 选取2018年11月~2019年5月于华北理工大学附属医院住院的T2DM患者134例为研究对象,其中合并NAFLD 患者83例作为观察组,男36例,女47例;未合并NAFLD 患 者51 例 为 对 照 组,男23 例,女28例。所有入选患者均符合 WHO 1999 年T2DM 诊断标准,NAFLD 诊断标准符合2010年中华医学会肝脏病学会分会修订的《非酒精性脂肪性肝病诊断标准》,均行腹部超声。排除标准:①除外1型糖尿病、妊娠期糖尿病、特殊类型糖尿病、近3个月来发生糖尿病酮症酸中毒等急性并发症;②除外病毒性肝炎、药物性肝病、肝豆状核变性、全肠外营养、自身免疫性肝病等可导致脂肪肝的特定疾病;③除外合并肺部疾病、感染性疾病、免疫缺陷性疾病、甲状腺疾病、恶性肿瘤、急慢性肝、肾功能不全者;④近期有手术史、输血史或其他应激情况者;⑤除外依从性差、回答可信度低、检查治疗不配合的患者。
1.2 方法 基本信息:测量每位患者的身高、体质量、腰围、臀围,计算体质量指数(BMI)=体质量(kg)/身高(m)2、腰臀比(WHR)=腰围(c m)/臀围(c m)。实验室检查:禁食8~14小时后抽血,测定总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C),计算VAI:男=腰围/(39.68+1.88×BMI)×(TG/1.03)×(1.31/HDL-C),女=腰围/(36.58+1.89×BMI)×(TG/0.81)×(1.52/HDL-C);测定空腹血糖(FPG)、空腹胰岛素(FINS),计算胰岛素抵抗指数(HOMA-IR)=FPG×FINS/22.5、胰岛素分泌指数(HOMA-IS)=20×FINS/(FPG-3.5)(%)。
1.3 统计学方法 采用SPSS17.0统计软件进行分析,计数资料组间比较采用χ2检验,以率(%)表示;计量资料组间比较采用独立样本t检验,以(¯x±s)表示。T2DM 合并NAFLD 危险因素分析采用Logistic回归分析。构建受试者工作特征曲线(ROC曲线)进行曲线下面积(AUC)分析,P <0.05 为差异有统计学意义,计算VAI对T2DM 合并NAFLD 诊断价值,判断VAI对T2DM 合并NAFLD 诊断的敏感性。
2 结果
2.1 两组一般资料比较 观察组病程(10.76±7.732)年、WHR(1.18±0.213)、BMI(27.59±3.028),对照组病程(7.01±7.196)年、WHR(0.95±0.070)、BMI(24.67±3.633),两组比较差异有统计学意义(P <0.05),说明病程、WHR、BMI与T2DM 合并NAFLD 有明显相关性。观察组TC、TG、VAI、HOMA-IR、HOMA-IS均高于对照组,而HDL-C低于对照组,差异有统计学意义(P<0.05),说明TC、TG、HDL-C、VAI、HOMA-IR、HOMA-IS 均 与T2DM 合并NAFLD 明显相关,见表1。
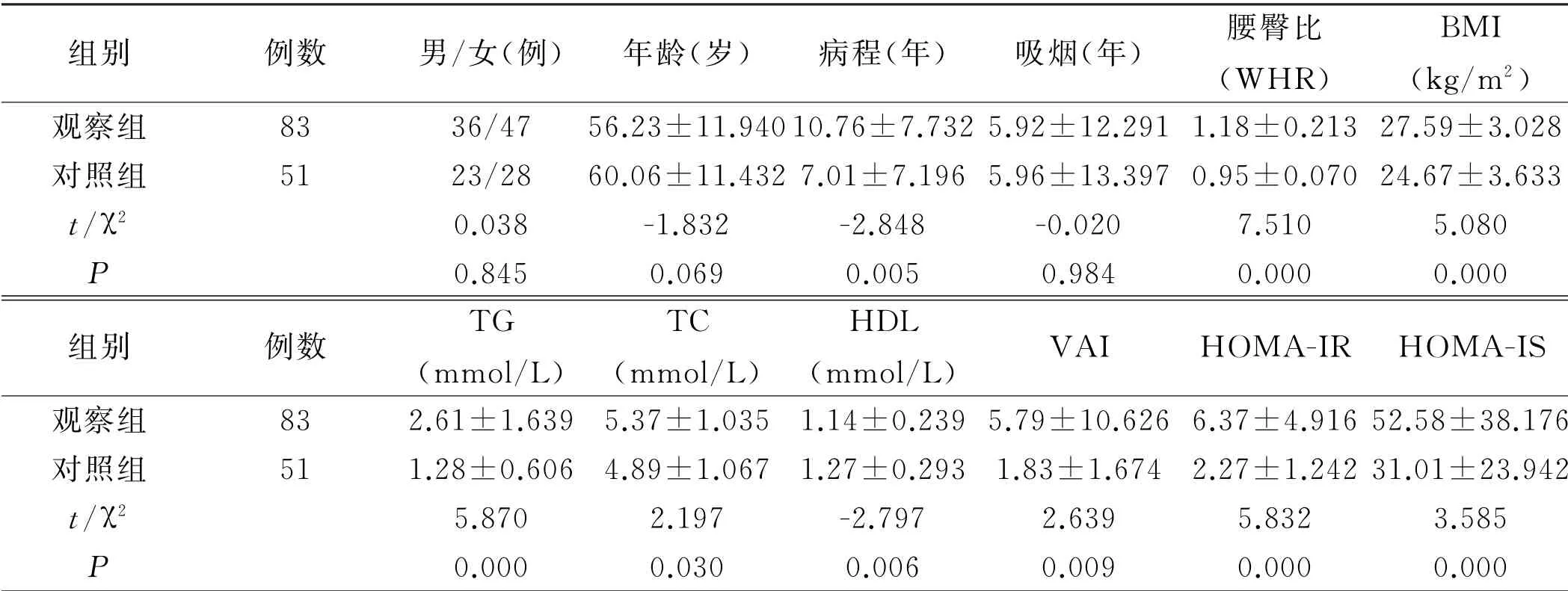
表1 两组各项指标比较(¯x±s)
2.3 T2DM 合并NAFLD 影响因素Logistic回归分析 以NAFLD 为因变量,将病程、WHR、BMI、TC、TG、HDL-C、VAI、HOMAIR、HOMA-IS为自变量纳入回归分析中进行统计,结果表明WHR、BMI、VAI、TG、HOMA-IR、HOMA-IS 升 高 是 T2DM 合 并NAFLD 的独立影响因素,见表2。
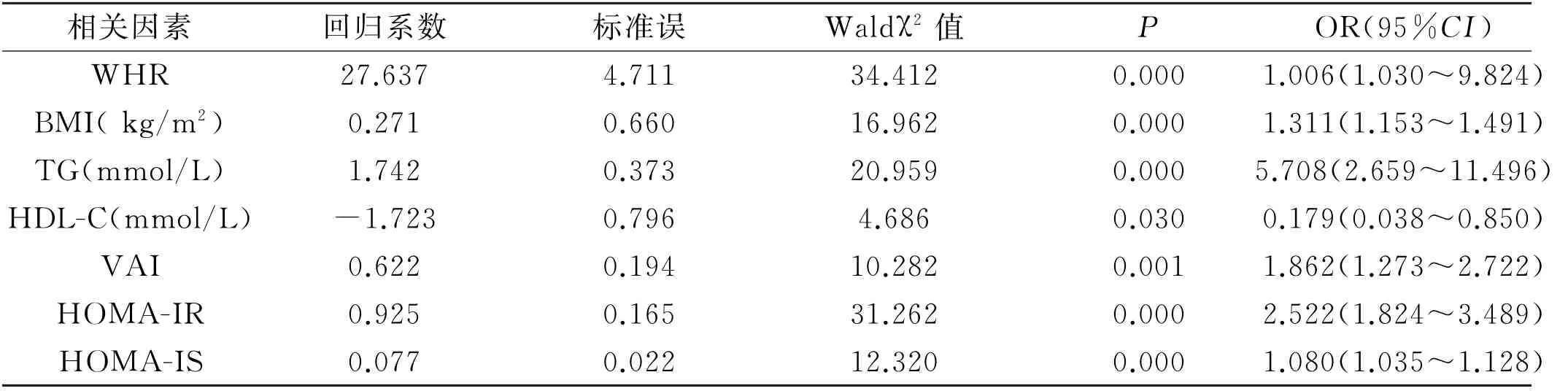
表2 T2DM 合并NAFLD 患者相关因素的l ogistic回归分析
2.4 T2DM 合并NAFLD 的ROC曲线分析 将83 例T2DM 合并NAFLD 患者的WHR、BMI、VAI、HOMA-IR、HOMA-IS 进行ROC曲线分析,结果WHR 的AUC 为0.894,敏感度91.6%,特 异 度76.5%;BMI 的AUC 为0.751,敏感度77.1%,特异度62.7%;VAI的AUC为0.951,敏感度90.4%,特异度88.2%;HOMA-IR 的AUC 为0.691,敏感度71.1%,特异度70.6%;HOMA-IS的AUC为0.834,敏感度79.5%,特异度76.5%。AUC越大诊断价值越高,其中VAI的AUC 最大(0.951),诊断力最强,见图1。

图1 观察组VAI、WHR、BMI、HOMA-IR、HOMAIS的ROC曲线及曲线下面积
3 讨论
NAFLD 目前广泛接受的理论是“二次打击”假说[7]。一次打击是脂类在肝细胞内堆积,二次打击是肝细胞内脂质堆积触发细胞毒素释放进一步导致肝内炎症反应。T2DM 患者长期高血糖使多余的葡萄糖进入肝细胞转化为脂肪储存在肝细胞内,进一步发展为脂肪肝,故T2DM 患者患NAFLD 的风险增加。多种因素参与了T2DM 合并NAFLD 的发生发展,主要与内脏脂肪过多堆积、胰岛素抵抗等有关。VAI是2010年Amato等[8]对收集的资料进行统计分析建立脂肪分布模型(Fat distribution model,MOAD)并进一步校正MOAD 后得出的能反映内脏脂肪含量及功能的指标。有研究比对提示,VAI与核磁共振检查(评价内脏脂肪含量的金标准[9-10])估算得出的内脏脂肪量相关性佳,是较好的评价内脏脂肪含量的简易临床指标[11]。
关于VAI在糖尿病方面的研究,Al-Daghri等[12]首次报告VAI与脂肪组织分泌功能及功能性血糖紊乱直接相关,可作为评估糖代谢受损风险的间接指标。国外有研究[13]发现在NAFLA 患者中,VAI作为一个定性定量反映内脏脂肪组织功能障碍的指标,与肝脏脂肪变性有关。李庆等[14]研究结果发现,VAI能对成人代谢综合征进行预测,因肥胖导致体内内脏脂肪堆积,进而累及肝脏而影响代谢。本组资料显示,VAI与T2DM 合并NAFLD 有相关性,VAI水平升高是T2DM 合并NAFLD 的独立危险因素。Vongsuvanh 等[15]发现,在判断肝脏脂肪变性方面,VAI不如腰围、WHR。故本研究进一步构建ROC 曲线,结果显示AUC依次为VAI(0.951)、WHR(0.894)、HOMA-IS(0.834)、BMI(0.751)、HOMA-IR(0.691),表明VAI对T2DM 合并NAFLD 的诊断价值高于WHR、HOMA-IS、BMI、HOMA-IR;但是VAI对T2DM 合并NAFLD 诊断的敏感性不如WHR,可能与VAI计算公式中的几个变量差距较大有关。目前,考虑VAI与T2DM 合并NAFLD 发生发展有关的几方面:①VAI可以反应内脏脂肪含量,人体内的脂类以脂肪形式储存在脂肪细胞中,脂肪细胞是一种内分泌器官,可分泌多种细胞因子,这些细胞因子可损害胰岛素的传导信号,导致胰岛素抵抗[13]。胰岛素抵抗可以引起脂质代谢紊乱,胰岛素抵抗时,血浆游离脂肪酸水平升高,TG、TC 水平升高、HDL-C水平降低,进而大量脂肪在肝内沉着、堆积引起肝细胞脂肪变性。②也可能是VAI的计算公式综合了TG、HDL-C 两个血脂指标,而TG 水平升高、HDL-C水平降低,可引起大量脂肪在肝内沉着、堆积引起肝细胞脂肪变性。本组资料还显示,HOMA-IR 与T2DM合并NAFLD 有相关性,证实胰岛素抵抗在NAFLD 的发病中起重要作用。胰岛素抵抗是NAFLD 与T2DM 的共同病理基础,二者互为因果、相互加重,NAFLD 可促进胰岛素水平的增加,形成高胰岛素血症,最终造成了恶性循环[16]。本次研究结果提示可将VAI作为预测T2DM 合并NAFLD 风险的指标之一。由于本组资料收集病例数较少,下一步可将VAI作为T2DM 合并NAFLD 早期诊断指标,在全国范围内对其诊断切值进行研究。
综上所述,T2DM 患者中的肥胖(尤其是内脏脂肪堆积)、胰岛素抵抗者并发NAFLD 的风险更高。在临床工作中,VAI可以作为评价内脏脂肪含量的简易临床指标,其测量方法相对简单、方便、经济,适合大规模筛查,故可以把VAI作为筛查T2DM 合并NAFLD 的简单而有效的指标,为早发现、早诊断NAFLD 提供一定的依据。
