高级别黏液性纤维肉瘤8例临床病理分析
2020-06-01邹冰清
邹冰清,芮 俊
黏液性纤维肉瘤是一类以不同程度的显著黏液性间质、多形性肿瘤细胞和独特的蜿蜒、线状血管为特征性病理表现的恶性纤维母细胞性肿瘤,也称黏液样恶性纤维组织细胞瘤[1]。黏液性纤维肉瘤好发于60~80岁的老人,青少年和儿童极少发病,对于个别发生于少儿的病例报道,部分研究者认为其病理诊断有待商榷。从发病部位而言,原发于下肢、躯干皮肤和皮下等浅表部位的黏液性纤维肉瘤最为常见,偶见原发于纵隔[2]和头颈部[3]的病例报道。黏液性纤维肉瘤易复发,并有一定发生转移的潜能。因此,正确诊断该病有助于改善患者预后。本文回顾性分析南京医科大学无锡人民医院诊治的8例黏液性纤维肉瘤,探讨其临床病理学特征、免疫表型、诊断及鉴别诊断等,旨在提高对该病的认识水平。
1 材料与方法
1.1 材料收集南京医科大学无锡人民医院2013年1月~2019年6月间诊治的8例黏液性纤维肉瘤。8例中手术样本10例(8例为原发肿瘤样本,1例为术后复发肿瘤样本,1例为原发病灶扩大切除样本)。由两位软组织病理医师复阅HE切片和免疫组化染色结果以明确诊断。同时收集包括主诉、体征、影像检查、术中所见和病理报告等在内的临床病理资料。
1.2 黏液性纤维肉瘤的病理分级黏液性纤维肉瘤的病理分级由3位医师采用双盲法进行阅片判读。低级别黏液性纤维肉瘤定义为镜下以黏液为主,肿瘤细胞稀疏、离散、呈短梭形或星形,细胞质略嗜酸性、边界不清,肿瘤细胞核大、异型且深染,坏死与核分裂均不多见,可见特征性的蜿蜒、细长的薄壁血管与假脂肪母细胞[1]。高级别黏液性纤维肉瘤镜下肿瘤细胞异型,可见梭形和多形的肿瘤细胞呈实性片状生长,常见病理性核分裂、出血和坏死,另可见奇异的多核巨细胞,局灶亦可见低级别病变的特征[1]。中间型黏液性纤维肉瘤的形态介于低级别与高级别之间,细胞较为丰富并且具有一定的多形性,既不完全由单纯的低级别肿瘤构成,亦无完全实性的区域,肿瘤细胞多聚集于血管周围生长,显著的细胞异型性和坏死相对少见[1]。
1.3 免疫组化免疫组化染色采用EnVision法,DAB显色,免疫组化染色由Ventena全自动免疫组化机完成。所用一抗(vimentin、SMA、MSA、Ki-67、CKAE1/AE3、CK7、desmin、S-100和CD68)均为即用型抗体,均购自福州迈新生物公司,二抗及显色系统均购自上海罗氏公司。
1.4 随访随访起始时间为2019年1月,末次随访时间为2019年7月。随访终点为黏液性纤维肉瘤相关的死亡,随访时间定义为首次手术至末次随访的时间间隔。将随访资料与临床病理资料进行相关性分析。
2 结果
2.1 临床特征8例黏液性纤维肉瘤中男性3例,女性5例,男 ∶女=1 ∶1.7。发病年龄51~79岁,平均年龄65岁,中位年龄63岁(表1)。临床表现均为渐进生长的肿块,病程1个月~3年不等。未侵犯肌层的皮下肿块可有轻压痛,边界不清,活动度欠佳;侵犯肌层或深达骨膜的肿块多为无痛性,边界不清,活动度欠佳或推之不动。肿瘤质地因黏液含量不同而软硬不等,黏液成分多者术中可见明显胶冻样物。所有病例切缘均阴性。

表1 8例高级别黏液性纤维肉瘤患者的临床病理资料
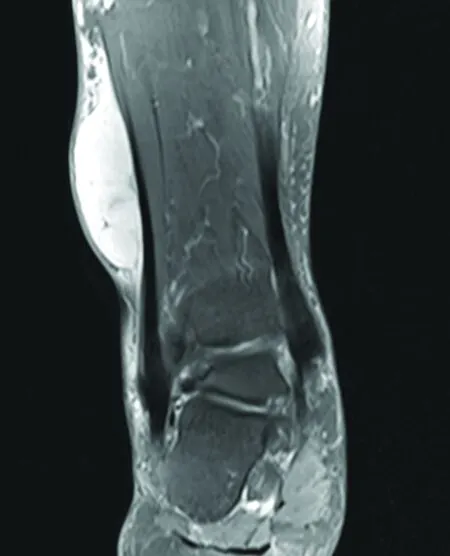
图1例8:MRI示右小腿下段外侧皮下囊性灶伴周围组织水肿(T2)
2.2 病理特征眼观:10例黏液性纤维肉瘤(原发肿瘤样本8例、例1扩大切除样本1例及例2复发切除样本1例)标本中以境界不清的灰白色肿块为主(9/10例,90%),仅1例(10%)表现为带部分包膜的肿块。肿瘤组织质地均较嫰,例3和例6切面呈半透明状或见黏冻样物,例4切面呈分叶状。肿瘤体积大小不等,最大径2~5 cm。镜检:10例黏液性纤维肉瘤样本均为高级别病变。低倍镜下肿瘤边界不清,呈结节状(图2)或不规则浸润性生长(图3),肿瘤细胞梭形,呈编织状、车辐状或束状排列,实性片状生长;高倍镜下可见肿瘤细胞明显异型,核浓染,核分裂象易见并可见病理性核分裂(图4),可见奇异的多核瘤巨细胞;间质黏液变,血管增生,并可见坏死及数量不等的炎细胞浸润。此外,复发肿瘤的肿瘤细胞密度高于原发肿瘤,而间质内黏液成分则显著减少。所有病例均可见不同比例的低级别病变成分,镜下表现为结节状黏液性肿瘤,黏液背景中散布稀疏的肿瘤细胞,肿瘤细胞短梭形或星形、边界不清,肿瘤细胞核大而异型、深染,核分裂象不多见,间质血管增生并呈典型的细长、蜿蜒状(图5),可见假脂肪母细胞。免疫表型:6/6例vimentin阳性,3/6例CD68阳性;1/6例SMA和(或)MSA局灶阳性,Ki-67增殖指数25%~50%;CKAE1/AE3、CK7、desmin和S-100均阴性。
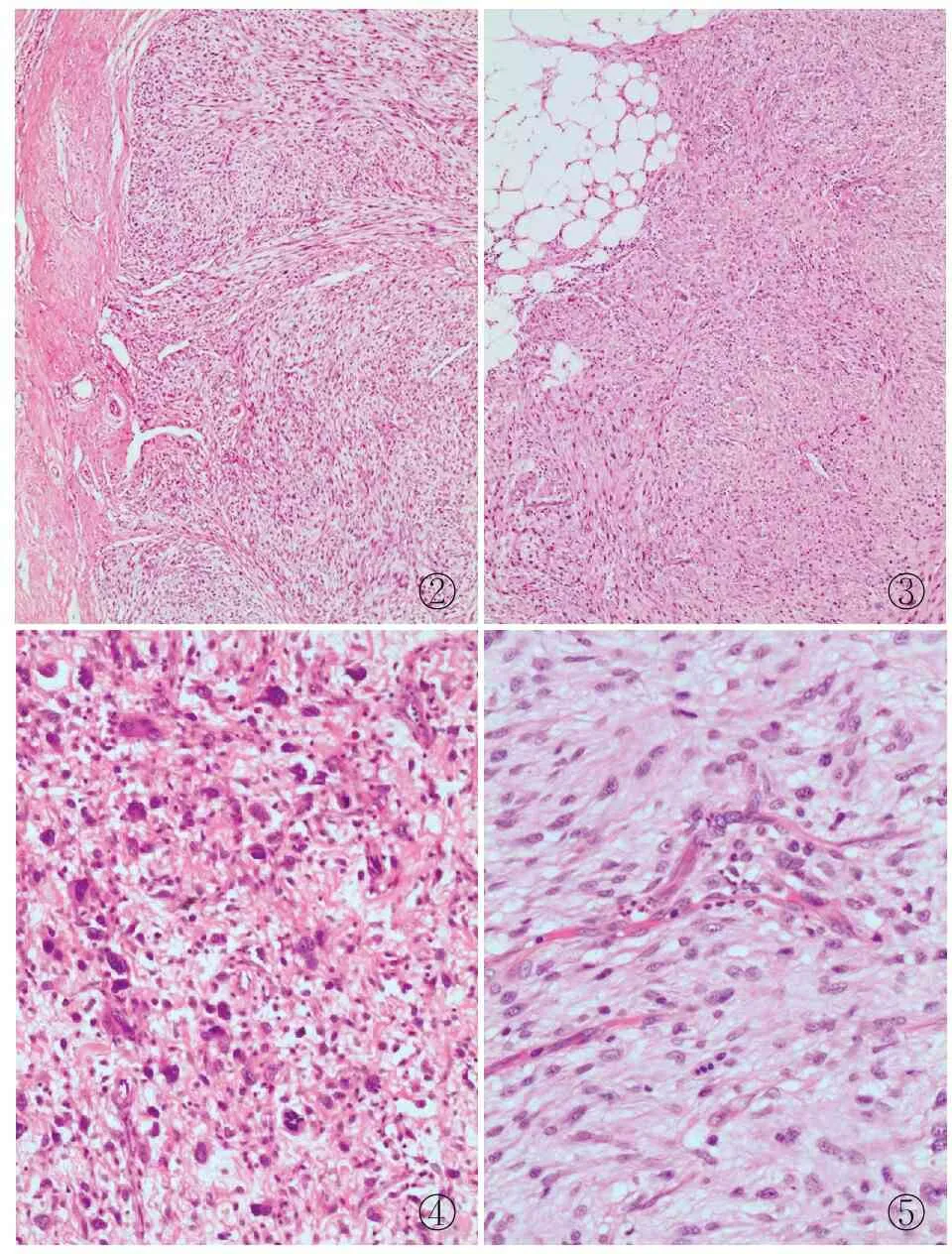
②③④⑤
图2例2原发病灶:高级别黏液性纤维肉瘤呈结节状,带部分包膜
图3例2复发病灶:高级别黏液性纤维肉瘤呈不规则浸润性生长,肿瘤的细胞密度高于原发肿瘤且间质内黏液成分减少图4高级别黏液性纤维肉瘤肿瘤细胞异型性大、核深染,核分裂象易见,可见病理性核分裂图5高级别黏液性纤维肉瘤特征性的细长、蜿蜒的薄壁血管
2.3 治疗及预后随访中2例患者失访,3例末次随访时仍存活,3例死于疾病进展。2例患者术后复发,1例发生转移。随访1~77个月,中位随访时间57个月(表1)。例2和例3的无进展生存期为6个月和50个月,复发后均行肿块扩大切除术。2例患者术后接受传统化疗,具体治疗方案不详,余4例患者未接受辅助治疗,无患者接受新辅助化疗或靶向治疗。未见患者性别、年龄、局部复发、转移、切缘状态、肿瘤体积、低级别成分占肿瘤比例和病理分级等表现出与预后相关的倾向。
3 讨论
黏液性纤维肉瘤的临床表现无特异性,大体与镜下表现也有较大差异,诊断和鉴别诊断有一定难度。黏液性纤维肉瘤的组织学特点为肿瘤细胞呈特征性的多结节状生长,纤维间隔不完全,伴黏液性背景间质;显著异型的细胞,蜿蜒、细长的薄壁血管,血管周围肿瘤细胞的聚集生长,黏液性间质(至少占肿瘤体积10%)和浸润性生长的不成熟树突状细胞均可提示诊断。多形性未分化肉瘤、低度恶性纤维黏液样肉瘤和黏液炎性纤维母细胞肉瘤的局部形态与黏液性纤维肉瘤可有交叉,需鉴别[1]。多形性未分化肉瘤(以往称为恶性纤维组织细胞瘤)可伴有黏液变性,但仅为小灶性,且蜿蜒、细长的薄壁血管不明显。低度恶性纤维黏液样肉瘤由形态温和的纤维母细胞样细胞组成,间质胶原与黏液互相交替,40%病例可见巨菊形团结构,免疫组化表达MUC4,遗传学上形成FUS-CREB3L2或FUS-CREB3L1融合基因[4]。黏液炎性纤维母细胞肉瘤在黏液、炎症及透明变性混合组成的背景中见散在分布神经节样、R-S样或病毒样大细胞,核仁明显,免疫组化常表达CD34[1]。
高级别黏液性纤维肉瘤中常可见低级别成分,后者常可见假脂肪母细胞,需与多形性脂肪肉瘤、黏液性脂肪肉瘤和去分化脂肪肉瘤鉴别[1]。假脂肪母细胞胞质内空泡为吞噬的黏液,表现为与背景黏液一致的淡染小泡,而非透亮的脂肪滴。多形性脂肪肉瘤的诊断线索是找到多性形脂肪母细胞,其胞质内见大的融合性脂滴,可表达S-100。黏液性脂肪肉瘤由原始间叶细胞组成,见数量不等的脂肪母细胞,间质黏液样,血管呈特征性的丛状或分支状,免疫组化表达S-100,遗传学上形成FUS-DDIT3或EWSR1-DDIT3融合基因。去分化脂肪肉瘤由高分化脂肪肉瘤成分和去分化成分组成,去分化成分大部分为非脂肪源性肉瘤,少数为多性形脂肪肉瘤[4]。
目前,黏液性纤维肉瘤尚无特异性的免疫组化标记,部分肿瘤细胞SMA和(或)MSA阳性可提示局灶性肌纤维母细胞分化;脂肪染色、desmin和S-100等染色阴性有助于与其他软组织恶性肿瘤进行鉴别[1]。
浸润性生长是黏液性纤维肉瘤复发率高的重要原因之一。然而微小的浸润灶和散在浸润的肿瘤细胞在影像学检查中和肉眼观察时无法辨别,难免遇到切缘累及情况。现有研究结果对切缘与预后的关系存在分歧:有研究表明切缘状态与患者预后无关,亦有研究支持切缘阳性患者的5年无复发生存率更低[5-8]。由于本实验中的病例切缘均阴性,因此,切缘的预后价值有待进一步探讨。
综上所述,黏液性纤维肉瘤的临床病理表现复杂且预后较差,诊断与鉴别诊断有一定难度。切缘状态等临床病理指标的预后价值有待深入探究。