共表达分子伴侣PDI和转录因子Aft1对毕赤酵母表达人溶菌酶的影响
2020-06-01王儒昕陈园园闫达中
王儒昕,韩 琴,陈园园,吴 菁,闫达中,刘 军,李 鑫
(武汉轻工大学生物与制药工程学院,湖北 武汉 430023)
细菌对传统抗生素耐药性的增强使得越来越多的研究人员致力于开发新型的抗菌化合物。溶菌酶又称胞壁质酶或N-乙酰胞壁质聚糖水解酶,能够水解细菌细胞壁中β-1,4糖苷键,破坏细胞壁肽聚糖的结构[1-2],保护宿主细胞免受细菌感染,是一种安全性高的药品及饲料食品添加剂[3]。人溶菌酶(human lysozyme,HLY)与鸡蛋清溶菌酶同属于c型溶菌酶,由130 个氨基酸残基组成,相对分子质量14 700,含4 个二硫键,活力中心由Glu35和Asp53构成[4]。目前,市场上销售的溶菌酶主要是从鸡蛋清中提取获得[3]。相比于鸡蛋清溶菌酶,HLY具有高的生物活力和热稳定性,抗菌活力是鸡蛋清溶菌酶的3 倍[5],同时HLY还具有抗病毒、增强免疫力和抗肿瘤的功效,在临床具有较高的应用价值[3]。HLY受限于原料来源、纯化精制成本等因素,制备量少,无法满足市场需求。构建基因工程菌株,生产重组HLY是解决这一问题的有效手段。
巴斯德毕赤酵母(Pichia pastoris)具有遗传操作简单、生长快速、易于培养、培养基廉价、拥有强诱导型甲醇氧化酶(alcohol oxidase,AOX)启动子、能对外源蛋白进行转录后修饰等诸多优点,是表达重组溶菌酶理想系统。Goda等[6]在毕赤酵母中实现了HLY的表达,并分析了氮末端残基对酶稳定性及折叠的影响。Zhou Xiaoyu等[7]通过优化表达条件和高密度补料分批发酵,实现HLYLYZL6在巴斯德毕赤酵母分泌表达,30 L发酵罐中蛋白分泌量达到331 mg/L。刘思彤等[8]用乳酸克鲁维酵母表达HLY,摇瓶发酵酶活力达到1 430 U/mL。陈姗姗等[9]根据毕赤酵母密码子偏爱性,对α-信号肽序列和人源溶菌酶基因序列进行整体优化,在5 L发酵罐中毕赤酵母工程菌分泌产胞外总蛋白达3.02 g/L。为降低生产成本,需要进一步提高工程菌表达HLY的水平。
通常提高毕赤酵母生产异源蛋白的产量策略如下:增加目的基因拷贝数,提高目的基因转录水平[10];优化基因序列,提高目的基因的翻译水平[11];选择信号肽与信号肽改造[12];共表达分子伴侣和转录因子[13-14];使用蛋白酶缺陷型宿主菌[15]或优化培养条件和培养基组分,减少目标蛋白的降解[16]。
过表达分子伴侣是提高外源蛋白表达水平的有效手段。蛋白质二硫键形成和内质网中蛋白质的折叠是蛋白分泌过程主要限速步骤。内质网蛋白质二硫键异构酶(protein disulfide isomerase,PDI)是来自硫氧还蛋白超家族的多功能蛋白质,它催化二硫键形成并有助于蛋白质的正确折叠。研究表明,PDI的过表达能增加毕赤酵母产异源蛋白[17-19]。过表达分子伴侣能否提高毕赤酵母外源蛋白表达水平,与所表达的外源蛋白性质相关[20]。HLY具有4 个二硫键,在工程菌中过表达PDI,可能有助于重组HLY形成二硫键,并正确折叠成其天然构相,从而提高毕赤酵母工程菌产HLY水平。
过表达转录因子是提高外源蛋白表达水平的另一重要手段。转录因子能同时调节涉及折叠和分泌的不同蛋白质,有克服宿主蛋白生产瓶颈的巨大潜力。Guerfal等[21]过表达转录因子Hac1,提高了mIL-10蛋白和抗体片段的分泌量。转录因子Nrg1的过表达提高了猪和人胰蛋白酶原,以及抗体Fab片段2F5的分泌产量[22]。毕赤酵母转录因子Aft1过表达,对毕赤酵母分泌表达来自Sphingopyxis sp. MTA144的羧酸酯酶具有促进效应,在补料分批发酵中,羧酸酯酶分泌量提高了2.5 倍[23]。
基于以上分析,本研究将构建共表达HLY和PDI及共表达HLY和Aft1的毕赤酵母工程菌株,分析共表达PDI和Aft1对菌株产HLY的影响,以期提高HLY产量,并为后续进一步构建高效产HLY毕赤酵母细胞工厂、降低HLY生产成本打下基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与载体
表达载体pPICZαA、pPIC9K 美国Invitrogen公司;溶壁微球菌 广东微生物菌种保藏中心;大肠杆菌DH5α、毕赤酵母KM71、毕赤酵母工程菌株KM71-HLY(表达重组HLY)为本实验室保藏。
1.1.2 酶、试剂与引物
DNA限制性内切酶、DNA Marker(DL 2 000及DL 10 000)、PrimeSTAR Max DNA聚合酶、DNA连接酶、无氨基酵母氮源(yeast nitrogen base without amino acids,YNB) 大连TaKaRa公司;质粒提取试剂盒、聚合酶链式以应(polymerase chain reaction,PCR)产物回收试剂盒、DNA胶回收试剂盒、酵母基因组提取试剂盒、山梨醇、Tris、十二烷基硫酸钠、卡那霉素、G418遗传霉素 上海捷瑞生物公司;蛋白胨酵母粉 英国Oxoid公司;牛血清蛋白标准品、考马斯亮蓝G250中国Biosharp公司;丙烯酰胺、甲叉双丙烯酰、四甲基乙二胺 美国Sigma公司;其他试剂均为国产分析纯。
引物由上海捷瑞生物工程公司合成,具体序列见表1。

表1 引物序列Table 1 Sequences of primer pairs used in this study
1.1.3 培养基
Luria-Bertani(LB)培养基:蛋白胨10 g/L,酵母浸出物5 g/L,NaCl 10 g/L。
酵母培养基:酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、酵母浸出粉胨葡萄糖含山梨醇(yeast extract peptone dextrose with sorbitol,YPDS)培养基、含甘油缓冲复合(buffered complex medium containing glycerol,BMGY)培养基、含甲醇缓冲复合(buffered complex medium containing methanol,BMMY)培养基配制及培养方法参照EasySelectTMPichiaExpression Kit方法。
1.2 仪器与设备
TProfessional PCR仪 德国Biometra公司;5417R台式高速冷冻离心机、Electroporator 2010电转化仪德国Eppendorf公司;DYY-6C电泳仪、DYCZ系列垂直式电泳槽 北京六一仪器厂;GBox-HR-E-M凝胶成像系统 英国Syngene公司。
1.3 方法
1.3.1 载体构建
以pPIC9K质粒为模板,用引物PG418-上与PG418-下扩增出卡那霉素基因序列,用BamHI和NcoI酶切回收的片段,连接到经BamHI和NcoI酶切回收的pPICZαA载体,构建出载体pG418。
根据GenBank中PDI基因序列(AJ302014.1)和Aft1基因序列(CP014715.1)设计引物PPDI-上/PPDI-下和PAft1-上/PAft1-下,以毕赤酵母KM71基因组为模板,扩增出PDI基因与Aft1基因片段;用BspT104I和NotI分别酶切回收扩增的片段,将它们连接到经BspT104I和NotI酶切回收的pG418载体,构建出重组载体pG418-PDI和pG418-Aft1。
1.3.2 电转化及重组毕赤酵母的鉴定
分别用SacI酶切质粒pG418-PDI和pG418-Aft1,将线性化回收的质粒电转化毕赤酵母KM71-HLY。电转化条件为:电压1.5 kV,电击时间4 ms。电击后,立即加入1 mL冰预冷的1 mol/L山梨醇溶液,用移液器吸打混匀,涂布在含G418的YPDS平板上(500 μg/mL)[24]。对在含G418的YPDS平板生长的菌落进行PCR扩增,鉴定阳性转化子。
1.3.3 重组菌株诱导表达
从YPD平板上挑取筛选的单菌落接入装有25 mL BMGY培养基的250 mL三角瓶中,28 ℃、220 r/min培养至OD600nm值为2~6。菌液用8 000 r/min离心5 min,弃上清液。用25 mL BMMY重悬菌体,装入250 mL三角瓶中,加入无水甲醇,使其体积分数为0.5%。28 ℃、220 r/min进行诱导培养。每隔24 h向培养基中补加甲醇,使其体积分数为0.5%。诱导物经8 000 r/min离心后,取上清液检测分析。
1.3.4 工程菌表达水平分析
用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)对工程菌株表达的HLY进行定性分析[25]。采用12%分离胶,5%浓缩胶,电泳电压120 V,电流100 mA。
用Bradford法[26]对菌株产胞外总蛋白进行定量分析。配制10%考马斯亮蓝G250溶液,每100 μL样品加入5 mL考马斯亮蓝G250溶液,以应5 min,测定595 nm波长处吸光度,以牛血清白蛋白为标准品制备标准曲线。
1.3.5 HLY活力检测
参照GB/T 30990—2014《溶菌酶活性检测方法》培养溶壁微球菌。制备含溶壁微球菌的LB平板,采用管蝶法对重组HLY活力进行定性分析。取发酵上清液,用磷酸缓冲液(pH 6.2)稀释4 倍,取200 μL加入牛津杯。37 ℃培养20 h,比较抑菌圈大小。
采用Olmo等[27]的方法测定重组HLY活力。以溶壁微球菌作为底物,通过450 nm波长处菌悬液吸光度的变化确定酶活力。将溶壁微球菌用磷酸盐缓冲液(pH 6.8)稀释至A450nm值为1.3,将稀释的菌悬液25 ℃温育,取2.5 mL加于1 cm的玻璃比色皿,再向比色皿中加入0.5 mL的待测样品,混匀,定时测定以应液吸光度。以每分钟450 nm波长处吸光度降低0.001为1 个酶活单位。
1.4 数据处理
采用Excel 2010分析数据,Origin 8.5绘制图表。
2 结果与分析
2.1 重组载体的构建

图1 重组质粒的构建Fig. 1 Construction of recombinant plasmids
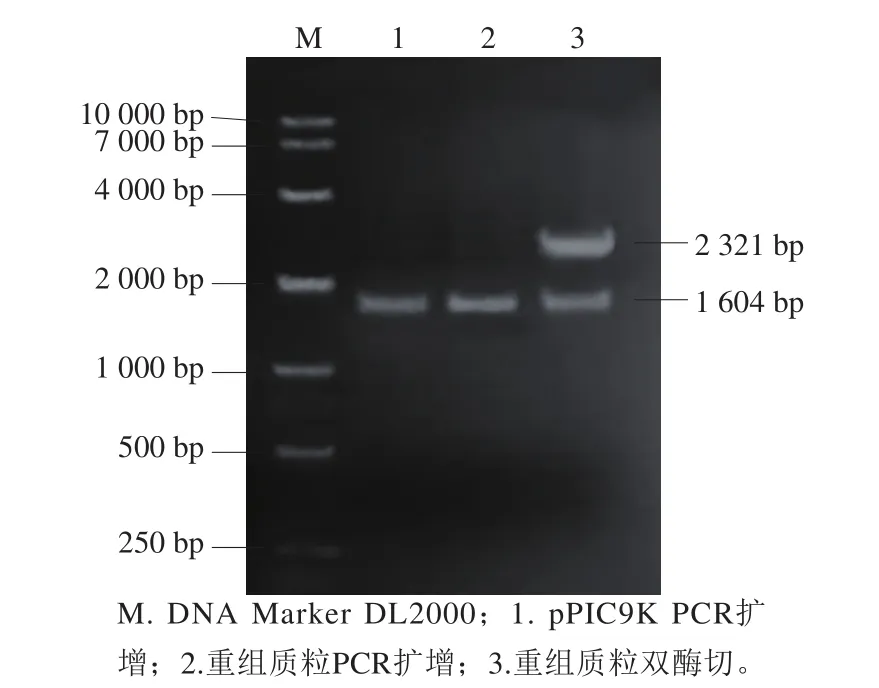
图2 pG418重组质粒的鉴定Fig. 2 Identification of recombinant plasmid pG418
重组载体的构建见图1。挑取在含卡那霉素(50 μg/mL)的LB平板上长出的菌落培养,从中提取重组质粒,用引物PG418-上/PG418-下对提取的重组质粒及质粒pPIC9K进行扩增,并用BamHI和NcoI酶切提取的重组质粒,结果见图2。从图2可知,PCR扩增和质粒酶切均能得到1 604 bp的片段,与卡那霉素基因片段大小一致,且构建的重组质粒大小与预期3 925 bp一致,表明pG418质粒构建成功。
将扩增的PDI基因和Aft1基因克隆至pG418,构建重组质粒pG418-PDI和pG418-Aft1。用PPDI-上/PPDI-下和PAft1-上/PAft1-下分别对在含卡那霉素的LB平板上长出的转化子进行PCR鉴定,并用BspT104I和NotI酶切提取的重组质粒,结果见图3。图3A表明,重组质粒PCR扩增与酶切均得到1 554 bp的片段,与以KM71基因组为模板扩增的PDI基因片段大小相同;图3B表明,重组质粒PCR扩增与酶切均得到1 092 bp的片段,与以KM71基因组为模板扩增的Aft1基因片段大小相同。因此,重组质粒pG418-PDI和pG418-Aft1构建成功,并经测序进行了确证。
2.2 重组毕赤酵母的构建
将pG418-PDI和pG418-Aft1用SacI酶切线性化,分别电转化至KM71-HLY。对在含G418的YPDS平板上生长的菌落,提取基因组作为模板,进行PCR,鉴定阳性转化子,结果见图4。

图4 工程菌株KM71-HLY-pG418-PDI(A)和KM71-HLY-pG418-Aft1(B)PCR鉴定Fig. 4 Identification of strains KM71-HLY-pG418-PDI (A) and KM71-HLY-pG418-Aft1 (B) by PCR
用PPDI-上/PAOX-下和PAft1-上/PAOX-下分别扩增pG418-PDI和pG418-Aft1转化后得到的转化子,扩增片段为1 750 bp和1 288 bp,大小与预期pG418-PDI质粒扩增片段一致,而以KM71-HLY基因组为模板没有相应扩增条带;对扩增的产物进行测序,证实重组质粒pG418-PDI和pG418-Aft1分别整合进KM71-HLY基因组,分别得到共表达PDI和Aft1工程菌株KM71-HLY-pG418-PDI和KM71-HLY-pG418-Aft1。
2.3 工程菌发酵产HLY及活力分析

图5 工程菌表达HLY的SDS-PAGE分析Fig. 5 SDS-PAGE analysis of HLY expression in recombinant strains
对KM71-HLY、KM71-HLY-pG418-PDI和KM71-HLY-pG418-Aft1进行甲醇诱导表达。对诱导96 h的发酵液离心,取上清液进行SDS-PAGE分析,3 种工程菌株诱导后均产生14.7 kDa蛋白条带,大小与HLY一致(图5)。
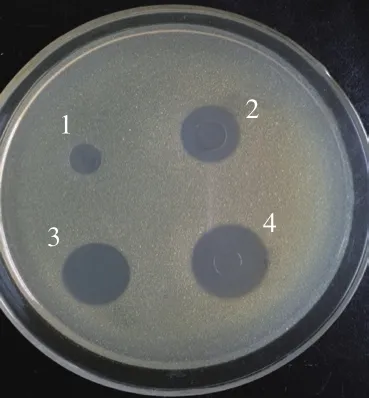
图6 管碟法测定发酵液抑菌活力Fig. 6 Assay of antibacterial activity of fermentation broth by the cylinder-plate method
采用管碟法检测工程菌表达的HLY活力,由图6可见,未加甲醇诱导KM71-HLY上清液未出现抑菌圈;KM71-HLY、KM71-HLY-pG418-PDI和KM71-HLY-pG418-Aft13 种菌株经甲醇诱导后,其上清液均产生HLY,在平板上出现明显抑菌圈,抑菌圈直径大小分别为17、20、24 mm。
2.4 共表达PDI和Aft1对工程菌生长及产酶的影响
菌株生长及产溶菌酶情况见图7及表2。KM71-HLY、KM71-HLY-pG418-PDI和KM71-HLY-pG418-Aft1在前70 h生长量差异不大,随后3 种菌株生长出现不同(图7A)。在发酵结束时,生物量OD600nm值分别为33.87、31.43、28.47。共表达PDI和Aft1对菌株生长会产生一定的影响,KM71-HLY-pG418-PDI和KM71-HLY-pG418-Aft1发酵最终生物量分别为KM71-HLY的92.8%与84.1%。
在发酵结束时,3 种菌株的胞外总蛋白量分别为324.02、350.87、474.80 mg/L。KM71-HLY-pG418-Aft1发酵分泌到胞外总蛋白量较KM71-HLY提高了46.5%,KM71-HLY-pG418-PDI胞外总蛋白量与KM71-HLY没有明显差异(图7B)。
随着诱导时间延长,KM71-HLY、KM71-HLY-pG418-PDI和KM71-HLY-pG418-Aft1产HLY活力逐渐增加,发酵结束后,3 种工程菌株发酵液所产HLY活力达到34 880、45 600 U/mL和50 180 U/mL(图7C)。KM71-HLY-pG418-PDI和KM71-HLY-pG418-Aft1总酶活力分别较KM71-HLY提高30.7%和43.9%。
如表2所示,KM71-HLY、KM71-HLY-pG418-PDI和KM71-HLY-pG418-Aft1所产胞外蛋白酶比活力分别为107 600、129 900 U/mg和105 600 U/mg。相对于对照菌株,过表达PDI的工程菌株所产HLY比酶活力得到提高,而过表达Aft1工程菌株所产HLY比酶活力有所降低。
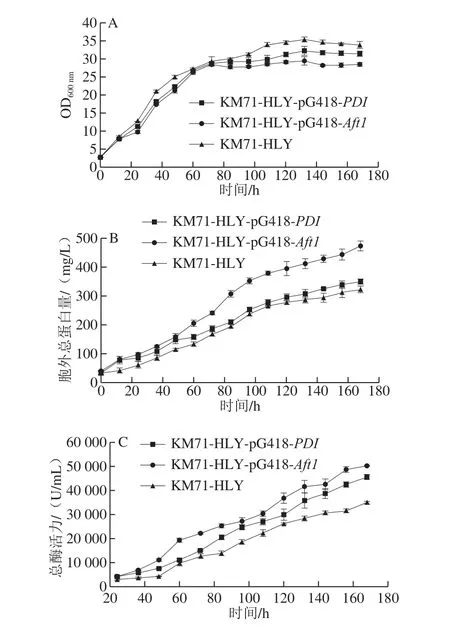
图7 工程菌摇瓶发酵Fig. 7 Time courses of shake flask fermentation

表2 工程菌株摇瓶发酵结束指标Table 2 Biomass, total protein production and lysozyme activity of recombinant strains at the end of shake flask fermentation
3 讨 论
毕赤酵母具有高效表达外源蛋白的能力,但在胞内大量表达的外源蛋白常无法及时折叠、加工而聚集在内质网中无法分泌到胞外,影响外源蛋白的分泌表达水平。分子伴侣促进蛋白正确折叠从而提高蛋白表达量[13-14]。本研究结果表明,诱导168 h后,KM71-HLY-pG418-PDI工程菌分泌的外源蛋白量与KM71-HLY无显著差别,但发酵液比酶活力提高了20.7%,胞外总酶活力提高了30.7%,这与PDI催化蛋白质分子二硫键形成并有助于蛋白质折叠的生物学功能一致。
与共表达PDI不同,KM71-HLY-pG418-Aft1较KM71-HLY菌株产胞外总蛋白量提高了46.5%,总酶活力较KM71-HLY菌株提高了43.9%,发酵液酶比活力与KM71-HLY相当。生物信息分析表明,在许多与蛋白分泌相关的基因启动子中发现有Aft1结合位点:内质网中两种重要的分子伴侣Pdi1和BiP[28-29];参与COPII囊泡形成和ER至高尔基体运输的Sec12和Sec23[30];参与蛋白质转位进出内质网通道形成的Sec61[31];参与内质网向高尔基体转位,及高尔基体内部运输的蛋白Gos1[32];参与氧化应激以应的转录因子Yap1[33];参与蛋白质糖基化作用的甘露糖基转移酶Och1[34];参与胞吐作用的蛋白激酶Kin1[35]。推测毕赤酵母Aft1在蛋白折叠、糖基化、胞内运输及蛋白胞吐外排等系列蛋白分泌途径中起重要作用[23]。因此,本研究的结果与转录因子Aft1可能的生物学功能一致。
目前,利用共表达转录因子Aft1提高外源蛋白的表达量仅见Ruth等[23]报道,本研究中,毕赤酵母转录因子Aft1能有效提高HLY产量,这为利用毕赤酵母转录因子Aft1提高毕赤酵母工程菌株产外源蛋白提供了又一参考。
毕赤酵母工程菌株摇瓶发酵产HLY最高水平为16 973.5 U/mL,本研究构建的毕赤酵母工程菌株产HLY超过了已报道的最高水平[6-9],后续将对所构建的工程菌株在发酵罐中生长及产酶情况进行研究。共表达PDI和转录因子Aft1对提高毕赤酵母产HLY有促进作用,这为进一步构建高效产HLY工程菌株提供了方向。后续会进一步将两种因子同时共表达于同一宿主细胞,分析它们在表达HLY中的协同作用,也会将他们与其他影响外源蛋白表达的因素结合起来,构建高效产HLY毕赤酵母细胞工厂,降低生产成本。
