油酸对植物乳杆菌LIP-1生长及冻干存活率的影响及其机理
2020-06-01何宗柏孙瑞胤鄂晶晶麻丽丽张晓宁王俊国
何宗柏,孙瑞胤,鄂晶晶,麻丽丽,张晓宁,王俊国
(内蒙古农业大学食品科学与工程学院,乳品生物技术与工程教育部重点实验室,农业农村部奶制品加工重点实验室,内蒙古 呼和浩特 010018)
乳酸菌真空冷冻干燥技术可将乳酸菌悬液冷冻一定时间后,再提高其环境中的真空度,使菌体中的水分在低温高真空度的环境下升华变成冻干菌粉[1]。由于真空冷冻干燥法制备的乳酸菌发酵剂具有遗传稳定、发酵活力高、贮藏条件好等优点,成为乳酸菌发酵剂最常用的制备方法之一[2]。然而乳酸菌在冷冻干燥过程中,不可避免地受到一些损伤,冻干后的菌粉存活率明显降低[3]。有研究表明,通过优化菌株的培养基组成成分,可提高菌株对冷冻干燥的抗性,从而提高冻干存活率[4]。
脂肪酸及其衍生物具有抑菌活性的报道国内外并不少见,已有研究表明,脂肪酸及其衍生物对丝状真菌、酵母菌、细菌的生长均有一定的抑制作用,抑制作用的强弱与碳链长度、不饱和键数目和位置有关,具体机制尚无定论。而脂肪酸及其衍生物对革兰氏阳性菌的抑制作用优于革兰氏阴性菌,有研究者认为与细胞膜的结构有关[5-6]。
近年来,长链脂肪酸及其衍生物的生理作用逐渐受到人们的关注。油酸(C18:1ω9c)是一种单不饱和ω-9脂肪酸,其化学式为C18H34O2(CH3(CH2)7CH=CH(CH2)7COOH),在自然界中广泛存在,因此人们普遍认可低剂量C18:1ω9c的安全性。Maciasr等[7]发现适当质量浓度的C18:1ω9c可以提高硫胺素的活性,提高菌的产酸能力,菌的生长量有所增加。但C18:1ω9c对乳酸菌生长的影响还存在争议,Sun等[8]比较了脂肪酸及其甘油单脂的抑菌活性,发现C18:1ω9c和α-亚麻酸具有抑菌效果。这可能是因为脂肪酸代谢产生过多的自由基,对DNA造成了损伤[9]。有研究显示,在乳酸菌培养基中添加C18:1ω9c、油酸钠和吐温-80可以提高细胞膜中不饱和脂肪酸的相对含量[10-11]。而大量研究表明,较高的细胞膜不饱和脂肪酸含量可以提高冷冻过程中形成的冰晶对细胞膜的机械损伤[12]。但以C18:1ω9c作为诱导物质提高冻干存活率的研究鲜见报道。
植物乳杆菌LIP-1是1 株从新疆地区传统发酵酸马奶中分离出的具有降胆固醇益生功能的菌株[13],减少菌株在冷冻干燥过程中的损伤,制备高活性、高存活率的益生菌制剂具有重要意义。本研究在MRS培养基中添加C18:1ω9c,以植物乳杆菌LIP-1为实验菌株,探究培养基中不同质量浓度C18:1ω9c与植物乳杆菌LIP-1发酵活菌数之间的关系,探究C18:1ω9c培养基对冻干存活率的影响。
1 材料与方法
1.1 材料与试剂
植物乳杆菌LIP-1由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供。
冻干保护剂:脱脂乳10.0 g、蔗糖8.0 g、L-谷氨酸钠0.1 g、蒸馏水82 mL,115 ℃灭菌7 min,急冷,4 ℃保存备用。
氯仿-甲醇(1∶2,V/V)溶液;1 mol/L甲醇钠-甲醇溶液(13.5 g甲醇钠溶于250 mL甲醇配制);荧光染料LIVE/DEAD BacLight Bacterial Viability Kit L7012 美国Invitrogen公司;β-半乳糖苷酶试剂盒 北京索莱宝试剂公司。
MRS液体培养基:葡萄糖20.0 g、大豆蛋白胨10.0 g、牛肉膏10.0 g、酵母粉5.0 g、无水乙酸钠5.0 g、无水磷酸氢二钾2.0 g、柠檬酸钠2.0 g、七水硫酸镁0.2 g、五水硫酸锰 0.05 g、吐温-80 1 mL,加蒸馏水1 000 mL,121 ℃灭菌15 min。MRS固体培养基:液体培养基的基础上添加琼脂12 g,121 ℃灭菌15 min。C18:1ω9c培养基:C18:1ω9c0.1~0.9 g、吐温-80 1 mL、1 000 mL蒸馏水,充分溶解后,加入液体MRS培养基的其他成分,配制成C18:1ω9c培养基,121 ℃灭菌15 min。
以上试剂均为分析纯。
1.2 仪器与设备
FD-1A-50真空冷冻干燥机 北京博医康实验仪器有限公司;6850气相色谱仪 安捷伦科技(中国)有限公司;DM4000B正置荧光显微镜 德国Leica公司;UV-1700紫外分光光度计 日本岛津公司。
1.3 方法
1.3.1 菌种活化
将植物乳杆菌LIP-1冻干粉接种至MRS液体培养基中,37 ℃条件下活化至3 代,再以2%的接种量接种于C18:1ω9c培养基中,37 ℃培养18 h后置于4 ℃保存备用,此为实验组,对照组以液体MRS培养基活化至4 代后置于4 ℃备用。
1.3.2 活菌计数
以MRS固体培养基为计数培养基,采用稀释平板菌落法计数。
1.3.3 真空冷冻干燥
在从C18:1ω9c培养基收集的菌泥中加入2 mL脱脂乳,充分混匀后取1 mL置于-80 ℃超低温冰箱中进行预冻,预冻6 h。冷冻后的样品放在冻干机中,冻干24 h,真空度20 Pa,冷陷温度-45 ℃。
1.3.4 植物乳杆菌LIP-1冻干存活率的测定
利用稀释平板菌落计数法测定冻干前后活菌数,冻干后的菌粉用生理盐水复水至冻干前的体积,并在37 ℃条件下培养10 min恢复活性,再采用MRS倒平板法,37 ℃培养48 h,计数。实验重复3 次,每次实验3 个平行。冻干存活率按下式计算:
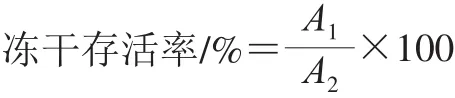
式中:A1为冻干后样品活菌数/(CFU/mL);A2为冻前样品活菌数/(CFU/mL)。
1.3.5 脂肪酸的提取及甲酯化
采用Bligh等[14]方法提取膜脂肪酸,后以甲醇钠进行甲酯化。C18:1ω9c培养基培养18 h后收集的菌体在4 ℃、4 000 r/min离心5 min,去上清液,洗涤2 次,弃上清液,取0.5 g湿菌泥,加入1.9 mL氯仿-甲醇溶液,充分振荡15 min,加入0.625 mL氯仿及0.625 mL无菌去离子水,振荡15 min后,4 ℃、5 000×g离心10 min,吸取下层液相,转移到新的离心管里,用氮吹仪吹干。以甲醇钠-甲醇溶液作为催化剂,在样品中加入1 mL 1 mol/L甲醇钠-甲醇溶液,冰浴下振摇5 min进行甲酯化;加入0.6 mL正己烷萃取脂肪酸的甲酯,振荡5 min,5 000×g离心5 min,吸取上层液相转入气相瓶,进行气相色谱分析。
1.3.6 细胞膜脂肪酸含量的气相色谱测定
气相色谱分析条件:P E G毛细管填充柱(30 m×0.22 mm,0.25 μm);载气:氦气;流速:29.6 mL/min;总流量:0.5 mL/min;柱压:63.4 kPa;进样口温度:260 ℃;检测器温度:280 ℃;柱温升温程序:起始温度100 ℃,保持1 min,随后以4 ℃/min的速率增至250 ℃并在250 ℃保持5 min。计算脂肪酸各峰的峰面积、保留时间及质谱范围,根据标样进行比对(37 种σ脂肪酸和C19cyc11的标样),对每个样品进行3 次重复测定。
脂肪酸含量采用归一化法,所有组分出峰之和按100%计算,各脂肪酸相对含量为该脂肪酸峰面积与总体脂肪酸峰面积和的比值。
1.3.7 细胞膜完整性的测定
细胞膜完整性利用LIVE/DEAD BacLight Bacterial Viability Kit L7012进行测定。将荧光染料碘化丙啶和SYTO9等体积混合均匀。取3 μL混合染料,加入到1 mL菌悬液中,避光振荡混合均匀,在室温条件下,避光孵育15 min。取5 μL染色的菌悬液,滴加在洁净的载玻片上,盖上盖玻片,压紧,在荧光显微镜下进行观察。
1.3.8 胞外β-半乳糖苷酶活性的测定
取不同组别冻干菌粉样品(菌数约为1×109CFU/mL),加0.05 mol/L NaH2PO4-Na2HPO4缓冲液10 mL,4 ℃、4 000 r/min离心5 min,各取上清液1 mL,用β-半乳糖苷酶试剂盒对3 组样品的β-半乳糖苷酶活性进行3 次重复测定,酶活性的单位以U表示。
2 结果与分析
2.1 C18:1ω9c质量浓度对菌株生长情况的影响
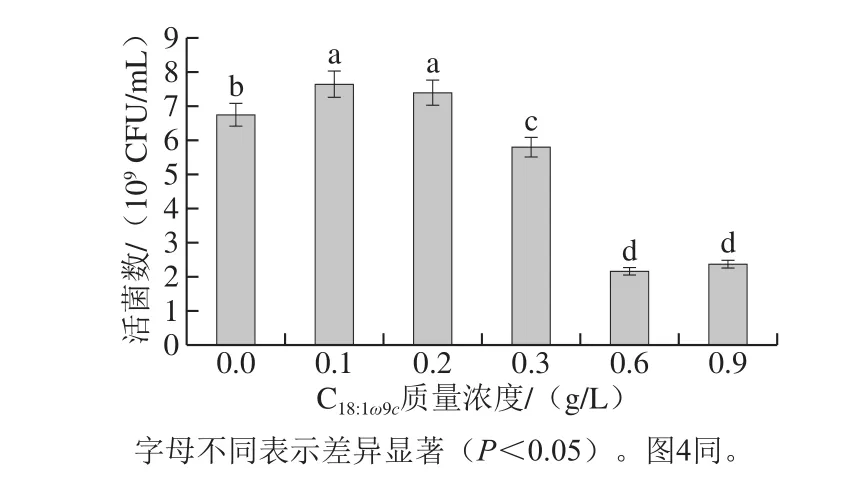
图1 C18:1ω9c对植物乳杆菌LIP-1生长情况的影响Fig. 1 Effects of oleic acid concentration on the growth of L. plantarum LIP-1
目前,C18:1ω9c对菌生长的作用是促进还是抑制存在争议[7-8],本实验探究在MRS培养基中添加不同质量浓度C18:1ω9c对植物乳杆菌LIP-1发酵活菌数的影响。由图1可知,在培养基中低质量浓度C18:1ω9c(≤0.2 g/L)可提高活菌数,高质量浓度(≥0.3 g/L)C18:1ω9c会降低活菌数。相比于对照组,当培养基中C18:1ω9c质量浓度为0.1 g/L和0.2 g/L时,活菌数分别提高到7.6×109、7.4×109CFU/mL,两组之间没有显著差异,说明低质量浓度C18:1ω9c(≤0.2 g/L)能促进菌的生长。可能是因为C18:1ω9c提高了硫胺素的活性,提高了菌的能量代谢水平,促进了菌的生长[7]。当培养基中质量浓度提高到0.3 g/L时,活菌数开始降低;当C18:1ω9c质量浓度提高到0.6 g/L时,实验组活菌数不到对照组的1/3,这说明高质量浓度C18:1ω9c(≥0.3 g/L)会抑制菌的生长。本研究表明,C18:1ω9c对植物乳杆菌最低抑制质量浓度在0.2~0.3 g/L之间,促进作用质量浓度在0~0.3 g/L之间。
有研究表明脂肪酸及其衍生物(包括C18:1ω9c)对革兰氏阳性菌具有抑菌活性[15]。宋宇航等[16]用透射电子显微镜观察C18:1ω9c组菌体状态,发现细胞壁变薄,细胞膜变厚,细胞壁和细胞膜中的间隙增大,这样有利于脂肪酸的跨膜运输,但也有可能引起细胞内重要酶和功能蛋白的丢失。除此之外有文献报道,不饱和脂肪酸的自动氧化作用会产生具有抗菌活性的氧脂质和短链醛[6,17]。由此推断C18:1ω9c对菌株的益生作用与抑制作用存在一个平衡点,C18:1ω9c质量浓度低于平衡点时,益生作用大于抑制作用,从而促进菌的生长;当C18:1ω9c质量浓度大于平衡点时,C18:1ω9c会在细胞内过多积累,产生有害的代谢产物,对菌体产生抑制作用。
2.2 C18:1ω9c质量浓度对菌株冻干存活率的影响
冷冻干燥中,由于水分的升华,细胞液浓缩,细胞外溶质质量浓度升高,形成高渗透压的环境;低温、高渗透压、缺水的环境还会引起蛋白质变性、酶活性降低、DNA超螺旋结构的破坏[18]。这些不利条件和极端的环境,最终都会导致菌株的活力下降和冻干存活率的降低[19]。为提高冻干存活率,在菌株培养期间,优化培养条件,使菌株获得对冷冻干燥抗性,从而提高冻干存活率[4]。选取对植物乳杆菌LIP-1生长有促进作用的C18:1ω9c添加质量浓度0.1 g/L和0.2 g/L,与普通MRS培养基进行对比,探究C18:1ω9c对菌株冻后活菌数及冻干存活率的影响。
从图2可以看出,在培养基中添加C18:1ω9c,显著提高了植物乳杆菌LIP-1冻后活菌数和冻干存活率。相比于对照组,0.1 g/L和0.2 g/L组冻干存活率分别提高了8.38%和4.46%,而0.1 g/L组与0.2 g/L组无显著差异(P>0.05)。实验组冻后活菌数分别提高了1.18×109、7.19×108CFU/mL,而0.1 g/L组冻后活菌数要高于0.2 g/L组,可能是因为0.2 g/L组的菌体内C18:1ω9c的有害代谢产物开始累积,并对菌产生了抑制作用[5],但这种抑制作用与C18:1ω9c的积极作用存在一个平衡点,最终的结果是0.2 g/L冻后活菌数高于对照组,低于0.1 g/L组。总而言之,培养基中添加低质量浓度C18:1ω9c能提高菌株冻后活菌数和冻干存活率,冻干存活率的提高与C18:1ω9c质量浓度有关。可能的原因是,在培养期间,C18:1ω9c能促进菌株合成不饱和脂肪酸,细胞膜的流动性提高,增强了菌株对冷冻干燥的抗性,此推论在后续实验中进行验证。
2.3 C18:1ω9c对细胞膜脂肪酸构成的影响
研究结果表明,培养基中添加0.1 g/L C18:1ω9c,能促进菌的生长,且能提高菌的冻干存活率,而0.2 g/L C18:1ω9c培养基的效果比0.1 g/L组略差。为探究低质量浓度C18:1ω9c提高菌株冻干存活率的机理,以MRS培养基中收获的菌为对照组,选取更有代表性的0.1 g/L C18:1ω9c培养基收获的菌体为实验组,用气相色谱法对细胞膜脂肪酸构成进行分析。
在冷冻干燥过程中,细胞膜的流动性与细胞膜中不饱和脂肪酸/饱和脂肪酸比值有密切的关系,乳酸菌可以通过乳酸脱氢酶调节不饱和脂肪酸/饱和脂肪酸比例[20-21]。细胞膜中不饱和脂肪酸比例增加,可以降低膜从液晶态转化为结晶态的温度,保持菌株在冷冻干燥过程中细胞膜的流动性,防止冰晶的形成对细胞膜的机械损伤[22-23]。

表1 C18:1ω9c对植物乳杆菌LIP-1细胞膜脂肪酸构成的影响Table 1 Effects of oleic acid concentration on membrane fatty acid composition of L. plantarumLIP-1
从表1可知,对照组植物乳杆菌LIP-1细胞膜主要由5 种脂肪酸构成,分别为C16:0、C16:1、C18:0、C18:1ω9c和C19cyc11(此处作为不饱和脂肪酸),相对含量2%~40%不等,占细胞膜总脂肪酸比例的89%以上,说明这5 种脂肪酸是植物乳杆菌LIP-1的主要脂肪酸。除此之外还检测到C4:0、C6:0、C8:0、C10:0、C12:0、C14:0、C14:1、C15:0、C17:0、C18:1t、C18:3,但因为含有比例较少或不能被稳定检测而没有进行比较分析。
总体上看,在培养基中添加C18:1ω9c,对植物乳杆菌LIP-1细胞膜脂肪酸构成产生了很大的影响,主要体现为饱和脂肪酸含量降低,不饱和脂肪酸含量增加。当培养基中含有0.1 g/L C18:1ω9c时,C16:0和C18:0相对含量不同程度下降,其中C16:0相对含量下降6.27%,C18:0下降7.2%。
C16:1、C18:1ω9c和C19cyc11相对含量不同程度增加。C18:1ω9c含量增加了3.52%,与以式脂肪酸和饱和脂肪酸的线性结构不同,C18:1ω9c的顺式结构中存在一个突出“结”的分子,这种特殊结构能够引起脂质双分子层疏水核心的改变,导致细胞膜的流动性增加[24]。C19cyc11比例上升得最为显著,增加了8.35%,这表明C18:1ω9c能促进C19cyc11的合成。而C19cyc11决定了细胞膜的弹性和伸缩性,能防止脂肪酸过紧地结合到细胞膜上,维持细胞膜的流动性,从而提高冻干存活率[3,25]。此外,不饱和脂肪酸/饱和脂肪酸比值上升了0.45%,可能是因为C18:1ω9c能诱导饱和脂肪酸转化为不饱和脂肪酸。随着不饱和脂肪酸含量的增加,菌株冻干存活率也显著提高,相比对照组提高了8.38%。
2.4 相关性分析

表2 主要膜脂肪酸和生长量及冻干存活率相关性分析Table 2 Correlation analysis among fatty acids, biomass and freeze-drying survival rate
为进一步确定C18:1ω9c与菌株细胞膜脂肪酸构成及冻干存活率之间的关系,对0.1 g/L C18:1ω9c培养基下收获的菌株各主要脂肪酸、活菌数及冻干存活率作相关性分析,相关系数及P值如表2所示。不饱和脂肪酸和C19cyc11的比例对菌应对冷冻胁迫非常重要[10]。在C18:1ω9c的作用下,C19cyc11和不饱和脂肪酸相对含量显著增加,而Pearson相关性分析表明,C19cyc11相对含量与冻干存活率呈显著正相关。这表明C19cyc11能在冷冻干燥过程中对细胞起到的保护作用,与张国强等[26]的研究结果一致。C19cyc11可以提高细胞膜的流动性,且由于其存在的环状结构决定了其化学性质的稳定,可以稳定细胞膜组成成分[27]。有研究表明C19cyc11由C18:1ω9c转化而来,但本研究中,C19cyc11与C16:0之间呈显著负相关,说明在C18:1ω9c的作用下,C16:0可转化为C19cyc11,这可能是菌株之间差异性决定的,同时也说明不同菌株之间C19cyc11的生物合成方式存在差异。
C18:0与C18:1存在显著负相关性,可推测培养基中的C18:1ω9c可以促进饱和脂肪酸(C18:0)转化为不饱和脂肪酸(C18:1ω9c),提高细胞膜中不饱和脂肪酸的比例。不饱和脂肪酸/饱和脂肪酸比值与冻干存活率存在显著正相关性,不饱和脂肪酸/饱和脂肪酸比值越高,冻干存活率也越高。不饱和脂肪酸中的顺式双键能阻止脂肪酸分子之间的整齐排列,这种整齐的排列会导致脂肪膜的流动性下降[21]。不饱和脂肪酸含量高还可降低细胞膜由液晶相转化为凝胶相的温度,从而提高细胞对低温胁迫的抗性,减少细胞在冷冻干燥过程中的损伤[28]。这可能是C18:1ω9c提高菌株冻干存活率的一个重要原因。
此外,相关性分析还显示出,C16:1相对含量与C18:0有较大的负相关系数,虽然不具有显著性,但能显示出在C18:1ω9c的作用下,短链脂肪酸有向长链脂肪酸转化的趋势。长链脂肪酸能降低细胞膜上H+的透过性,减缓细胞内pH值的下降速率,维持细胞内pH值的动态平衡,以维持细胞的正常生理功能[29]。这可能是C18:1ω9c提高菌株冻干存活率的另一个潜在原因。
2.5 C18:1ω9c对细胞膜完整性的影响
细胞膜的完整性直接关系到细胞的活性,细胞膜的完整性受到破环,生理功能必然受到影响[30]。碘化丙啶是一种排斥性染料,可以对DNA染色,只有细胞膜完整性被破坏的细胞才允许染料进入胞浆,因此碘化乙啶可区分细胞膜是否完整的细胞[31]。
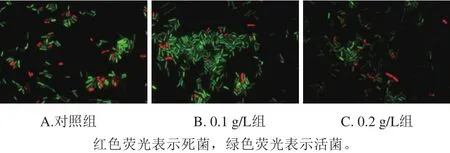
图3 C18:1ω9c对植物乳杆菌LIP-1冷冻干燥后细胞膜完整性的影响Fig. 3 Effect of oleic acid concentration on cell membrane integrity of L. plantarum LIP-1 after freeze-drying
图3 显示,从含0.1 g/L C18:1ω9c培养基中收获的菌体进行冷冻干燥后,发出红色荧光的菌体明显少于另外两组,这说明菌体细胞膜完整性维持得较好。与没有添加C18:1ω9c的对照组相比,0.2 g/L组发出红色荧光的菌体少于对照组,这说明该组菌体细胞膜的完整性受到破坏的程度小于对照组,冷冻干燥对对照组的影响大于实验组。在冷冻干燥的预冻阶段,细胞内外都会形成冰晶,对细胞膜造成机械损伤,破坏细胞膜的完整性,细胞膜的通透性增加,胞内的关键酶如β-半乳糖苷酶、ATP酶等,蛋白质和离子发生泄漏,导致细胞活性降低[32-33]。这很好地解释了0.1 g/L组与0.2 g/L组具有较高冻干存活率的原因。同时也间接验证了培养基中低质量浓度的C18:1ω9c可以诱导饱和脂肪酸向不饱和脂肪酸转化,促进C19cyc11合成,提高了细胞膜的流动性。
2.6 C18:1ω9c对植物乳杆菌LIP-1胞外β-半乳糖苷酶活性的影响
β-半乳糖苷酶属于胞内酶,一般不能在胞外检测到活性,其在上清液中活性能以映细胞膜通透性的改变,当细胞膜的完整性受到破坏时,细胞膜通透性增大,β-半乳糖苷酶会泄露到细胞外,导致上清液中β-半乳糖苷酶活性增加[18]。

图4 C18:1ω9c对 植物乳杆菌LIP-1冻干后β-半乳糖苷酶活性的影响Fig. 4 Effect of oleic acid concentration on β-galactosidase activity in supernant of freeze-dried L . plantarum LIP-1
由图4可知,MRS组、0.1 g/L组和0.2 g/L组冻干后胞外β-半乳糖苷酶活性分别为1.68×10-2、1.20×10-2U/mL和1.33×10-2U/mL,0.1 g/L组、0.2 g/L组冷冻干燥后胞外β-半乳糖苷酶活性均低于MRS组,0.1 g/L组低于0.2 g/L组,差异显著(P<0.5)。冷冻干燥过程会对菌体细胞膜造成一定程度的损伤,细胞膜的通透性增大,泄漏到细胞外的β-半乳糖苷酶增加[22]。本研究中0.1 g/L组和0.2 g/L组胞外β-半乳糖苷酶活性低于MRS组,表明培养基中添加低质量浓度C18:1ω9c能有效阻止β-半乳糖苷酶的泄露。培养基中添加低质量浓度C18:1ω9c可提高细胞膜的流动性,降低冷冻过程中冰晶对细胞膜的机械损伤,使细胞膜的完整性维持较好,因而0.1 g/L组和0.2 g/L组β-半乳糖苷酶泄漏量低于MRS组。
3 结 论
培养基中低质量浓度(≤0.2 g/L)的C18:1ω9c可以促进植物乳杆菌LIP-1生长,提高冻干存活率。培养基中高质量浓度C18:1ω9c会抑制菌的生长,最低抑制质量浓度在0.2~0.3 g/L之间。低质量浓度C18:1ω9c可以促进C16:0转化为C19cyc11,同时诱导饱和脂肪酸向不饱和脂肪酸转化,通过这两条途径提高菌体对冷冻干燥的抗性。
