湿型外耳道分泌物的菌群结构及其药物敏感性分析
2020-05-31李一强章银波朱欣琰晏晨曦王鹏孙桂芹俞洪
李一强,章银波,朱欣琰,晏晨曦,王鹏,孙桂芹,俞洪
1. 浙江中医药大学医学技术学院, 杭州 310053; 2. 浙江中医药大学基础医学院, 杭州 310053
微生物和人类生活密切相关,人的体表以及与外界相连的腔道中存在不同种类和数量的微生物。外耳道作为特殊的皮肤表层,也有相应的微生物生存。外耳道软骨部皮肤具有耵聍腺,其分泌的淡黄色黏稠物称为耵聍,按黏稠度可分为干型和湿型[1],干湿型别由常染色体单基因遗传决定,湿型为显性,干型为隐性[2]。耵聍作为一种常见的外耳道分泌物,能反映耳道微环境的状况,其中含有脱落角质细胞、蛋白质及脂质等成分,可能会影响耳道微生物的生长[3]。耳道微生物的种类与生长数量存在基线,评估其水平可为人体外耳道健康监测提供依据。
目前,国内外对耳道微生物的研究多集中于耳道感染性疾病的病原菌分离及其耐药性分析[4-6]。关于健康人耳道微生物的研究,我国已有对儿童、成人和老年人3类不同年龄人群的外耳道微生物进行分析的报道,但未区分干、湿型别[7-9]。有研究表明,正常人皮肤表面的常居菌,如表皮葡萄球菌,在免疫力低下时可能转变为条件致病菌[10]。外耳道作为特殊的皮肤表层,寄居于其中的正常菌群也有可能引发机会性致病。本课题组前期已对30例干型和10例湿型健康大学生的外耳道分泌物进行细菌分离培养及药物敏感性分析[11],但由于湿型耳道分泌物的样本量较少,分析存在一定局限性。本研究通过进一步收集样本,分析健康人湿型外耳道分泌物的菌群结构及其药物敏感性,为湿型外耳道微生物种类和数量的基线水平研究提供数据,同时为耳道微生物的基础研究提供参考。
1 材料和方法
1.1 研究对象
38例湿型外耳道志愿者,年龄18~71岁,男女比例为1∶1。经纯音测听和声导抗测定均无明显中耳、外耳道疾病。采集志愿者双耳的外耳道分泌物,共76份。
1.2 主要仪器与试剂
主要仪器包括恒温培养箱(上海森信实验仪器有限公司 SPH-250)、生物安全柜(美国NUAIRE公司 NU-425-400S)、高压蒸汽灭菌锅(上海博迅医疗生物仪器股份有限公司 YXQ-LS-100SII)、全自动微生物鉴定仪(法国生物梅里埃股份有限公司 VITEK 2 Compact)及其配套的细菌鉴定卡(GP卡和GN卡)等。主要试剂为普通营养琼脂培养基(HTWS-B442)、水解酪蛋白(Mueller-Hinton,MH)培养基、细菌微量生化反应管(012)、药敏纸片(170922)等,均购自杭州滨和微生物试剂有限公司。头孢硝噻吩纸片购自重庆庞通医疗器械有限公司。
1.3 方法
1.3.1 外耳道分泌物采集参考《临床检验标本采集手册》(2011年)[12]及《全国临床检验操作规程》(第4版)[13],对受试者的左、右耳分别进行采样,使用无菌棉签蘸取少量无菌生理盐水后,在外耳道用力旋转取样,采集的分泌物置于2 mL无菌生理盐水中。
1.3.2 细菌的分离培养将上述采集的外耳道分泌物震荡混匀,静置30 min,取上清液进行10、100及 1 000 倍梯度稀释;采用平板涂布法,将原液及不同稀释梯度的分泌物接种至营养琼脂培养基上,倒置于37 ℃恒温培养箱,孵育24 h;再挑取平板上的不同菌落,分别进行4区划线接种,得到纯培养物。
1.3.3 菌落计数按照《GB 4789.2-2016食品安全国家标准食品微生物学检验菌落总数测定》标准[14],用肉眼观察平板,选取菌落数在30~300 CFU、无蔓延生长的平板计数菌落总数,菌落数<30 CFU的平板记录其具体菌落数,菌落数>300 CFU的平板记录为多不可计。分别计算左、右耳原始样品每毫升中的菌落数,以CFU/mL为单位进行报告。
1.3.4 细菌的生化反应鉴定将分离得到的菌株,先进行触酶试验和革兰染色初步判断,然后使用微量生化管和全自动微生物鉴定仪鉴定,鉴定结果参考《葡萄球菌属细菌生化鉴定编码册》(TH-16S)和《伯杰细菌鉴定手册》(第8版)进行判定[15]。
1.3.5 药物敏感性试验采用纸片扩散法对外耳道分泌物分离得到的细菌进行药敏分析。用比浊仪调菌液至0.5麦氏单位,涂布于MH培养基,贴上药敏纸片,每张纸片中心的间距≥24 mm,倒置于37 ℃恒温培养箱,孵育24 h,用直尺测定抑菌环直径。依据临床及实验室标准化研究所制定的标准(CLSI 2017)[16],判定药敏试验结果。
1.3.6 β-内酰胺酶的检测采用头孢硝噻吩纸片法,检测青霉素耐药菌株产β-内酰胺酶的情况。将β-内酰胺酶测试条末端滤纸用无菌生理盐水浸润后,用接种环挑取可疑待测菌落,在末端滤纸上涂抹开,置37 ℃恒温孵育1~15 min,观察滤纸上是否显现红色。显红色为阳性,反之为阴性。上述操作过程严格遵守无菌标准,避免外界微生物污染。
1.4 统计学方法
用SPSS 25.0软件对试验结果进行卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 湿型外耳道分泌物的菌落计数
根据菌群计数的原则,从连续稀释梯度平板中,选择平行性好、菌落数在30~300 CFU的平板进行菌落计数,低于30 CFU的平板记录具体菌落数。结果表明,88.3%的湿型外耳道分泌物菌落数处于1×102CFU/mL~1×106CFU/mL,对左、右耳各范围的菌落数量进行比较,P值为0.786,说明两者差异无显著统计学意义。详见表1。
2.2 湿型外耳道分泌物细菌以葡萄球菌为主
从76份湿型外耳道分泌物中分离得到139株细菌,其中135株为球菌,占97.1%;4株为杆菌,占2.9%。135株球菌中以葡萄球菌为主,位列前4位的分别是头葡萄球菌、耳葡萄球菌、人葡萄球菌和表皮葡萄球菌,共111株,占82.2%。详见表2。
此外,分离得到的139株细菌中,67株来自左耳,72株来自右耳,左、右耳中均以头葡萄球菌、耳葡萄球菌、人葡萄球菌和表皮葡萄球菌居多。对左、右耳两组菌株种类的检验结果进行比较,P值为0.047,差异有统计学意义。
2.3 药物敏感性试验
采用纸片扩散法对上述分离到的所有细菌进行体外药敏试验,针对分离率前4位的球菌、其他常见的葡萄球菌以及杆菌进行药物敏感性试验结果分析。
2.3.1 湿型耳道分泌物中葡萄球菌的药物敏感性头葡萄球菌是分离率最高的细菌,药物敏感性试验结果显示,湿型外耳道分泌物分离的头葡萄球菌对青霉素、复方新诺明、四环素耐药率分别为10.6%、14.9%、10.6%,而对临床上常用的万古霉素、米诺环素、头孢西啶、头孢哌酮、头孢吡肟等头孢菌素、喹诺酮类及氨基糖苷类药物敏感率均在95%以上,见表3。
湿型外耳道分泌物中共分离到耳葡萄球菌23株,占第2位。药物敏感性试验结果显示,耳葡萄球菌对四环素、复方新诺明耐药率分别为13.0%、30.4%;对临床上常用的青霉素、头孢菌素、庆大霉素、米诺环素、万古霉素、喹诺酮类药物敏感率均在95%以上,见表3。
人葡萄球菌的药物敏感性试验结果显示,其对青霉素和红霉素的耐药率分别为50.0%和40.9%;而对四环素类和糖肽类等临床常用药物的敏感率均在90.0%以上,见表3。

表1 湿型外耳道分泌物菌落计数结果[CFU/mL](n=76)
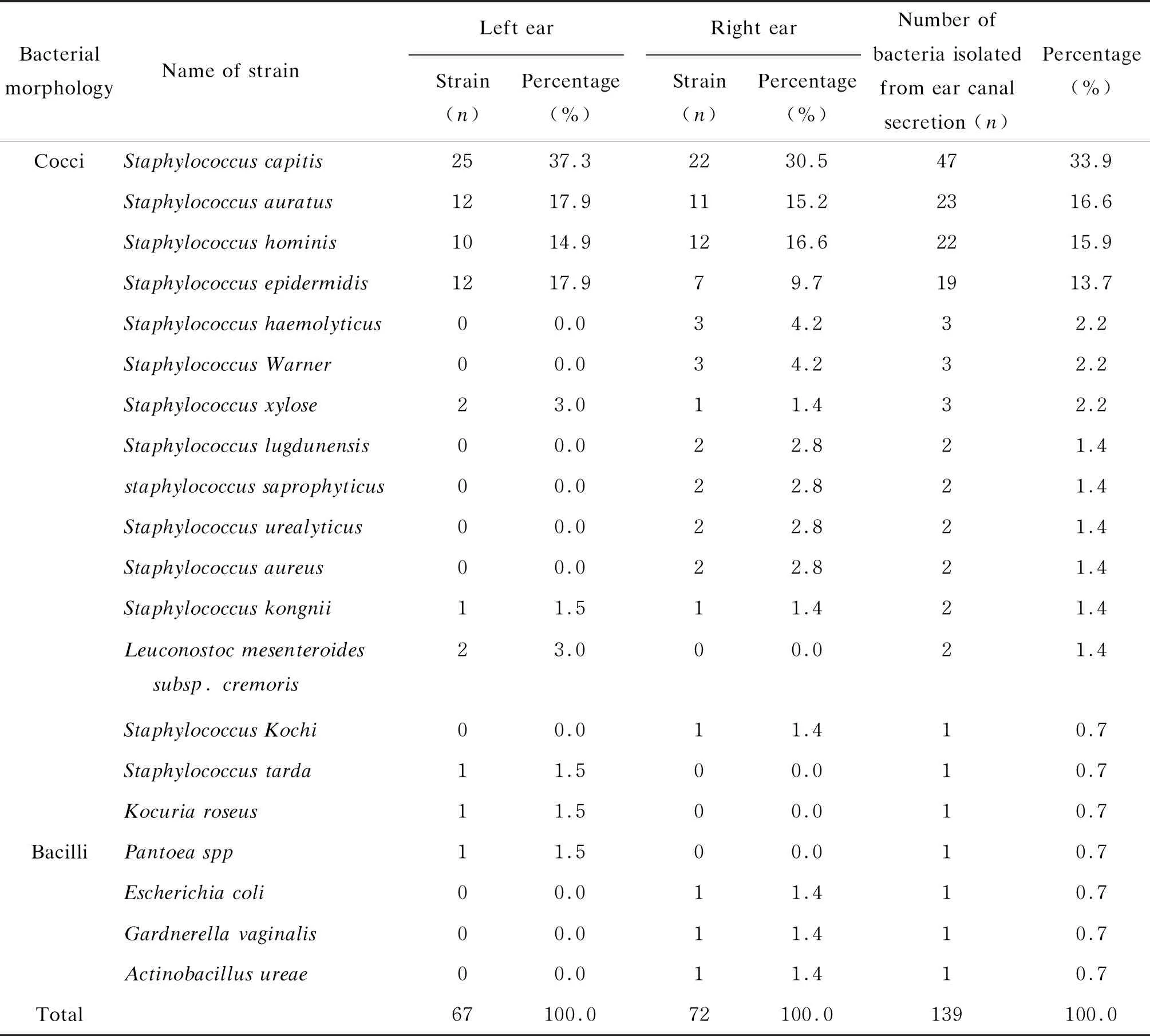
表2 76份湿型外耳道分泌物细菌分离统计
湿型外耳道分泌物中分离率第4位的细菌为表皮葡萄球菌,药物敏感性试验结果显示其对临床常用的红霉素、万古霉素、头孢菌素、氨基糖苷类以及四环素类等药物的敏感率均在80.0%以上,而对复方新诺明的耐药率为42.1%,见表3。
2.3.2 湿型耳道分泌物中杆菌的药物敏感性在湿型外耳道分泌物中共分离到成团泛菌、大肠埃希菌、阴道加德纳菌、尿放线杆菌各1例。结果显示,阴道加德纳菌和尿放线杆菌均对临床常见的抗生素具有一定敏感性;成团泛菌对青霉素、苯唑西林、万古霉素和克林霉素等抗生素,以及大肠埃希菌对复方新诺明具有一定耐药性,结果详见表4。
2.4 部分青霉素耐药菌株的β-内酰胺酶试验阳性
湿型外耳道分泌物中分离到的132株葡萄球菌,其中25株对青霉素耐药,占比18.9%。采用头孢硝噻吩纸片法检测青霉素耐药株产β-内酰胺酶的情况,初步分析其对青霉素的耐药机制,结果表明25株青霉素耐药株的β-内酰胺酶阳性率为44.0%,见表5。
3 讨论
研究表明,人体皮肤微生物群随部位不同而有一定差异[17],而外耳道微生物是皮肤微生物群的组成部分之一。近年来,关于耳道微生物的研究多集中于针对外耳道炎、中耳炎等耳道疾病进行的病原菌分离,而有关健康人外耳道菌群分析的报道较少。


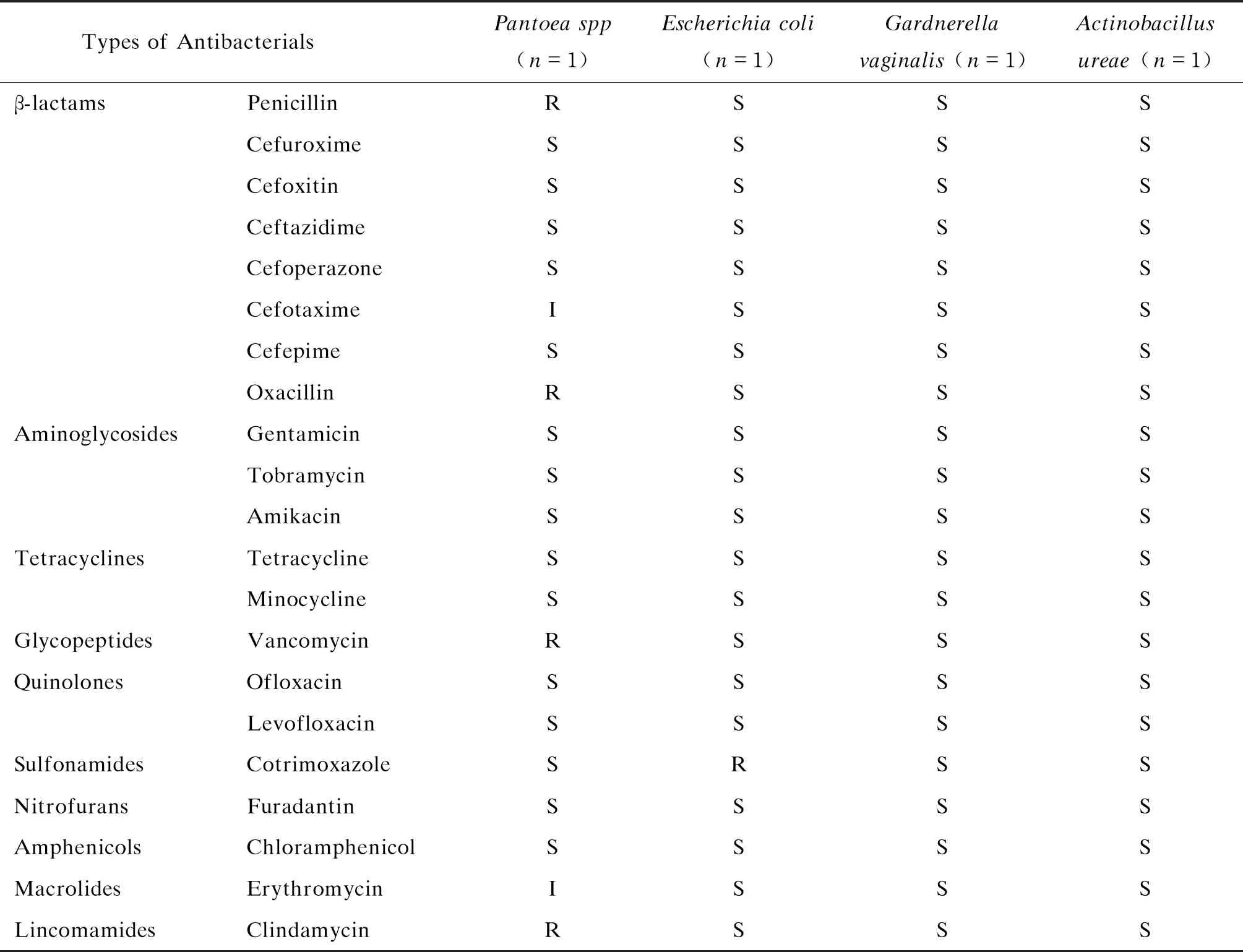
表4 湿型耳道分泌物中杆菌的药物敏感性分析(n=4)

表5 25株耐青霉素葡萄球菌产β-内酰胺酶情况统计
20世纪50年代至今,国内外针对健康人耳道微生物的研究仅有少量文献报道。1956年,Nichols等[18]报道从健康成年人外耳道中主要检出微球菌。1981年,Brook[8]从3个月~12岁(平均年龄3岁零8个月)的健康儿童外耳道中分离培养出表皮葡萄球菌、类白喉棒状杆菌和α-溶血性链球菌等,其中以表皮葡萄球菌最多,占比78%。美国、挪威等国家也有研究报道从健康儿童、成人的外耳道分泌物中分离到凝固酶阴性葡萄球菌和类棒状杆菌,且均以葡萄球菌的检出率最高,占60%以上[19-20]。谭振文等[7]从健康小学生的油耵聍(即湿型外耳道分泌物)中也检测出葡萄球菌。传统的分离培养技术存在局限性,利用聚合酶链反应(polymerase chain reaction,PCR)等技术能更全面分析外耳道分泌物的菌群种类。王悦颖[9]采用PCR-变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)技术,对60~75岁的健康老年人和老年性耳聋患者的外耳道细菌种类进行分析,发现其优势菌为表皮葡萄球菌、里昂葡萄球菌等。另有研究通过16S rRNA基因测序发现,外耳道含有大量的耳炎差异球菌、葡萄球菌和铜绿假单胞菌[21-22]。本研究对76例耳湿型外耳道分泌物进行分离培养,94.7%的样本来自19~22岁健康大学生志愿者,共20种细菌,其中葡萄球菌多达14种,均为凝固酶阴性,主要为头葡萄球菌、耳葡萄球菌、人葡萄球菌和表皮葡萄球菌,约占总株数80%。同时,对左、右耳两组菌株数量、种类的检验结果进行比较,其中左、右耳菌群数量无统计学差异,而细菌种类差异具有统计学差异,为耳道微生物研究选择单耳或双耳采集样本提供参考依据。上述研究提示,经分离培养检测,不同国家、不同年龄段健康人群外耳道分泌物中主要存在凝固酶阴性葡萄球菌,且以表皮葡萄球菌最为常见,本研究结果与此一致。但利用PCR、16S rRNA等方法可检测出更多种类细菌,如耳炎差异球菌、铜绿假单胞菌等。葡萄球菌作为健康人机体的正常菌群,常寄居于皮肤、口腔、肠道等部位[23],当宿主的卫生状况、免疫状态、皮肤屏障功能等处于完好或正常的状态时并不致病,但当细菌集聚部位改变、机体抵抗力降低或菌群失调等状况影响宿主时,葡萄球菌可能成为致病菌,引发静脉导管感染、血流感染,甚至败血症等[10,24]。例如,表皮葡萄球菌对于无症状带菌者来说属于无致病性的常驻微生物,但当皮肤屏障受到破坏且皮肤消毒不彻底时,表皮葡萄球菌可侵入血液引发血流感染[25]。另有研究表明,作为外耳道的常驻菌群,凝固酶阴性葡萄球菌在慢性化脓性中耳炎与外耳道炎患者的耳道分泌物中也常被检出,且检出率在革兰阳性球菌中排第2位[26-27],这可能与外耳道作为中耳微生物库有关[21]。
药物敏感性试验可帮助临床合理使用抗菌药物,也是监测细菌耐药性的重要手段。从湿型耳道分泌物中分离细菌并对其进行药物敏感性分析,结果显示,分离率排前4位的葡萄球菌对临床常用的头孢吡肟、妥布霉素、米诺环素和氧氟沙星等抗生素的敏感率在90.0%以上,对青霉素和复方新诺明具有一定耐药性,但低于50.0%。然而在对慢性化脓性中耳炎患者的研究报道中提示,从耳道分泌物分离到的表皮葡萄球菌对青霉素的耐药率均高于80.0%,且对红霉素、克林霉素耐药率高于50.0%[28-29]。这与从健康人中分离到的表皮葡萄球菌耐药率存在一定差异,可能与临床上长期使用抗生素导致其耐药性提高有关。
青霉素常用于治疗敏感菌所致的感染。近年来随着抗生素的大量使用,青霉素耐药率呈上升趋势。有研究报道,在医院感染的金黄色葡萄球菌、表皮葡萄球菌和凝固酶阴性葡萄球菌中,其耐药率常高于70.0%[30-32]。目前导致青霉素耐药的机制主要涉及β-内酰胺酶、青霉素结合蛋白、mecA基因、mecC基因、主动外排系统等[33-35],其中β-内酰胺酶可水解青霉素类使其灭活,为最常见的耐药机制。据文献报道,从临床标本分离的葡萄球菌产β-内酰胺酶率可达80.0%,从化脓性中耳炎的耳脓液中分离的金黄色葡萄球菌产β-内酰胺酶率为84.6%[36-38]。本研究从健康人耳道分离的葡萄球菌对青霉素的耐药率较高,但通过头孢硝噻吩纸片测得青霉素耐药株β-内酰胺酶的阳性率为44.0%,提示β-内酰胺酶阴性菌株可能由其他机制介导耐药,有待进一步研究。分离到的4株杆菌中,阴道加德纳菌和尿放线杆菌均对临床常见的抗生素具有一定敏感性,而成团泛菌对苯唑西林、万古霉素和克林霉素等抗生素,以及大肠埃希菌对复方新诺明具有一定耐药性。由于菌株数量较少,需扩大样本量做进一步分析。本研究对健康人湿型外耳道分泌物的细菌数量、种类及其药物敏感性进行了初步探讨,为湿型耳道微生物数量和种类的基线研究提供依据。但因样本数量较少,存在一定局限性,仍需扩大样本量做进一步的深入研究,以期为健康人外耳道微生物组研究奠定基础。
