去N端信号肽的水痘-带状疱疹病毒糖蛋白E的原核可溶性表达及其免疫原性评价
2020-05-31魏明童夏兵兵何志远周炜刘兴东赵俊陈敬贤王明丽
魏明童,夏兵兵,何志远,周炜,刘兴东,赵俊,,陈敬贤,王明丽,
1. 安徽医科大学第一临床医学院,安徽 合肥 230060; 2. 芜湖英特菲尔生物制品产业研究院有限公司, 芜湖 241000; 3. 安徽医科大学第二临床医学院, 合肥 230060; 4. 安徽医科大学临床病毒学研究所, 合肥 230032
水痘-带状疱疹病毒(varicella-zoster virus,VZV)为双链DNA病毒,属疱疹病毒α亚科。VZV主要通过呼吸道传播,在人类原发感染时可引起水痘并在人脊髓神经节中终身潜伏,当宿主免疫力低下时病毒可再次被激活导致带状疱疹(herpes zoster, HZ)[1, 2]。HZ在我国年发病率约为3.4/1 000~5.8/1 000[3],并且在50岁以上人群中发病率急剧上升[4]。HZ导致的后遗神经痛等并发症严重影响患者的生活质量[5],而且目前无治疗HZ特效药,临床上以对症治疗为主。VZV糖蛋白E(glycoprotein E, gE)由开放阅读框(open reading frames,ORF)68基因编码,全长为 1 872 bp,其N端第1~544氨基酸残基为含有信号肽的胞外域[6],第121~135氨基酸残基为产生中和抗体的抗原表位[7]。gE为病毒包膜和感染细胞膜上含量最丰富的糖蛋白[8],具有促进病毒复制增殖以及介导病毒在细胞间传播的功能[9]。gE基因序列高度保守,抗原性稳定并且具有很强的免疫原性[10, 11],是VZV亚单位疫苗的主要候选蛋白。
葛兰素史克(GlaxoSmithKline, GSK)公司的VZV gE亚单位疫苗Shingrix于2017年获得美国食品药品监督管理局(U. S. Food and Drug Administration, FDA)批准用于预防带状疱疹,其在临床试验中获得良好的预防效果,这说明采用gE亚单位疫苗具有可行性和优越性。Shingrix由于使用真核表达系统(中国仓鼠卵巢细胞)生产,其产量较低、价格较高。我国2019年5月批准Shingrix疫苗在中国上市,但到目前为止仍未见广泛使用。目前采用原核表达系统表达的重组VZV gE蛋白均为包涵体形式,故后续工艺需要变复性处理,操作步骤较复杂,且变复性可能影响该蛋白的结构与活性。因此,研究重组VZV gE蛋白原核可溶性表达可充分发挥原核表达系统工艺简单、成本低等优势,为VZV gE亚单位疫苗研制提供一种新的方案。
伊兴旭等[12]通过原核表达系统以包涵体形式表达的重组VZV gE蛋白具有一定的特异性,免疫家兔可得到相应特异性较强的多克隆抗体。因此在参考其研究的基础上,本研究通过分析VZV gE 第31~539氨基酸残基信号肽、亲水性等理化性质和抗原表位后,采用VZV gE去除信号肽的胞外域序列,以原核表达系统构建并表达重组gE蛋白,进一步鉴定其免疫反应性及产生抗体的特异性,期望对VZV gE亚单位疫苗研制提供新的策略。
1 材料与方法
1.1 材料
大肠埃希菌BL21(DE3)感受态细胞、人胚成纤维细胞(HF)、非洲绿猴肾(Vero)细胞、VZV(OKA株)、人巨细胞病毒(HCMV,AD169 株)、单纯疱疹病毒(herpes simplex virus, HSV) 1型(HSV-1,F 株)及HSV-2型(HSV-2,Sav株)均为本实验室保存。6~8周龄BALB/c小鼠(SPF级,体重22~25克/只)购自安徽医科大学动物实验中心。pET32a-VZV gE重组质粒由安徽省滁州通用生物公司合成。限制性内切酶BamH Ⅰ和Hind Ⅲ购自大连Takara公司。小鼠抗VZV gE单克隆抗体购自美国Abcam公司;辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗小鼠IgG抗体购自北京中杉金桥生物技术有限公司;Alexa Fluor 488标记的山羊抗小鼠IgG抗体购自美国Invitrogen公司;4′, 6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole, DAPI)购自北京索莱宝科技有限公司。弗氏完全佐剂、弗氏不完全佐剂购自美国 SIGMA 公司。含有氨苄西林(ampicillin, Amp+)的琼脂培养基为本实验室制备。质粒提取试剂盒购自美国AXYGEN公司。EtEraserTM HP 内毒素去除试剂盒购自厦门鲎试剂生物科技有限公司。荧光倒置显微镜购自日本OLYMPUS公司。蛋白纯化仪(AKTA)购自上海宸乔生物科技有限公司,Ni Sepharose 6 Fast Flow 亲和层析柱和HiPrepTM Q FF 16/10阴离子交换预装柱购自美国GE公司,0.45 μm针形滤器购自美国Millipore公司,酶标仪(iMark)购自美国Bio-Rad公司,化学发光成像仪(ChemiScope 5200)购自上海勤翔科学仪器有限公司。
1.2 方法
1.2.1 VZV gE胞外域生物信息学分析基因序列来源于美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)ID: 1487709,在伊兴旭等[12]的研究基础上,去除第1~30氨基酸序列,目的基因大小 1 527 bp。引物设计:Sense:5′-GCCTTACTACCATTCAGATC-3′;Antisense:5′-GTGTATGCTACGGCTTCA-3′。用ExPASy在线工具(www.expasy.org)分析VZV gE第31~539氨基酸残基序列的信号肽、跨膜区、疏水性及三级空间结构,通过德泰生物在线工具(www.detaibio.com)预测其抗原表位。
1.2.2 BL21/pET32a-VZV gE工程菌构建及鉴定将10 μL pET32a-VZV gE重组质粒转化至100 μL BL21(DE3)感受态细胞中,冰浴45 min后置42 ℃水浴热激90 s,热激完成后冰浴3~5 min。加入1 mL的溶菌肉汤(lysogeny broth, LB)培养液,置摇床37 ℃温浴1 h,离心去除上清液,将转化后的感受态细胞接种至含Amp+琼脂培养基平皿上。37 ℃培养12~16 h后,挑取单菌落接种到含Amp+液体LB培养基中扩增培养。根据质粒提取试剂盒说明书提取质粒后进行聚合酶链反应(polymerase chain reaction,PCR)及双酶切,并交由北京六合华大基因科技有限公司测序鉴定。PCR体系为25 μL,包括1 μL pET32a-VZV gE质粒模板,Premix Taq 12.5 μL,上、下游引物各 0.5 μL 和RNase free H2O 10.5 μL。PCR程序为:94 ℃ 预变性4 min;94 ℃变性50 s,60 ℃退火45 s,72 ℃ 延伸2 min,共39个循环;最后72 ℃延伸 10 min。双酶切反应体系为:质粒模板15 μL,BamH Ⅰ和Hind Ⅲ内切酶各1.5 μL,10×QuickCut 缓冲液 2 μL,用RNase free H2O 配制成终体积为 20 μL 体系,37 ℃反应1 h。
1.2.3 重组gE蛋白诱导表达及可溶性检测将BL21/pET32a-VZV gE重组菌置于LB液体培养基(Amp+)中37 ℃培养至OD600值为0.6~0.8,加入终浓度为1 mmol/L异丙基-β-D-硫代半乳糖苷(isopropylβ-D-thiogalactoside,IPTG),30 ℃诱导,分别在第2、4、6、8、10、12 h收集1 mL菌液,12 000 rpm离心收集沉淀物,300 μL 磷酸盐缓冲液(phosphate buffered solution,PBS)重悬,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和Gis软件分析检测重组gE蛋白表达情况。重组菌扩增培养至OD600值等于0.6~0.8时,加入终浓度为1 mmol/L IPTG诱导8 h,7 000 r/min 离心20 min,使用PBS重悬菌体,冰浴超声破碎菌体,12 000 r/min离心5 min分离上清液和沉淀物,分别取上清液、沉淀物及破碎前菌体经SDS-PAGE检测重组gE蛋白的可溶性。
1.2.4 重组gE蛋白纯化、去内毒素以及特异性检测将重组菌超声破碎,12 000 r/min离心5 min,取上清液后,使用His-tag亲和层析柱对重组gE蛋白进行纯化后,将收集洗脱下的目的蛋白溶液去除内毒素,即取VZV gE蛋白溶液置于20倍柱体积PBS中,4 ℃透析6 h以上。采用HiPrepTM Q FF 16/10预装柱,超纯水冲洗层析柱至出液端液体pH值为中性。平衡缓冲液(50 mmol/L乙酸钠,pH=5.0)平衡层析柱,再使用冰乙酸快速调节重组gE蛋白纯化产物pH值至5.0±0.2,12 000 r/min离心5 min后收集上清液。经0.45 μm针形滤器过滤后,过HiPrepTM Q FF 16/10预装柱去除内毒素,待UV 280 nm吸收值开始上升时收样,收集流穿液,即为去除内毒素后的重组gE蛋白。采用EtEraserTM HP 内毒素去除试剂盒,按照操作方法检测该重组蛋白溶液的内毒素含量。以蛋白质印迹法(Western blot, WB)鉴定其特异性,即以小鼠抗VZV gE单克隆抗体(1∶4 000 稀释)为一抗,4 ℃孵育过夜,TBST缓冲液洗涤3次,每次5 min;HRP标记山羊抗小鼠IgG(1∶50 000稀释)为二抗,37 ℃孵育1 h,TBST缓冲液洗涤3次,每次5 min。最后使用化学发光成像仪观察结果。
1.2.5 重组gE蛋白的多克隆抗体制备实验用6~8周龄SPF级BALB/c小鼠50只,体重为22~25克/只,随机平均分为5组(组号:1、2、3、4、5)。免疫前小鼠尾静脉采血保存作为阴性血清对照。初次免疫时,每只小鼠腹腔注射0.2 mL由弗氏完全佐剂乳化的纯化gE抗原(蛋白浓度为1.0 mg/mL)。第3和第5周以弗氏不完全佐剂乳化的纯化抗原进行免疫,最后以无佐剂纯化抗原再进行2次免疫,每次间隔2周。每次免疫后1周内经小鼠眼眶静脉采血,分别收集血清备用。

1.2.7 间接免疫荧光法检测多克隆抗体的特异性将HF细胞和Vero细胞分别接种至12孔细胞培养板中,待细胞长满单层,分别取VZV、人巨细胞病毒(human cytomegalovirus, HCMV)感染HF细胞,HSV-1、HSV-2感染Vero细胞,置 37 ℃、5%CO2温箱培养。待出现病毒特征性致细胞病变后,用固定液(甲醛与丙酮体积比为1∶1)固定细胞,室温作用10 min,PBS洗涤3次,每次5 min(以下各步骤间均用相同方法洗涤);1%聚乙二醇辛基苯基醚(Triton X-100)处理细胞10 min,10%小牛血清封闭1 h;以1∶500稀释的小鼠抗血清作为一抗,37 ℃ 孵育1 h;然后用1∶4 000 稀释的Alexa Fluor 488标记山羊抗小鼠IgG作为二抗,37 ℃孵育1 h;加入0.5 μg/mL DAPI在室温染色10 min,洗涤、盖片,置荧光显微镜下观察结果。

2 结果
2.1 VZV gE第31~509氨基酸残基为亲水蛋白且抗原表位丰富
使用ExPASy在线工具分析VZV gE第31~539氨基酸残基信号肽、跨膜区、三级结构和亲水性,使用德泰生物在线工具预测该序列抗原表位。结果表明,该序列不含信号肽序列和跨膜区;其三级结构由规则的空间构象组成,包括多个β折叠和无规则卷曲(图1A);对该序列进行亲水性预测发现,它由509个氨基酸残基组成,只有少数疏水区域,预测结果为亲水蛋白;同时得到gE第31~539氨基酸残基抗原表位预测信息,即该全长序列中有丰富的抗原表位且位点的抗原指数较高(图1B)。
2.2 pET32a-VZV gE重组质粒含有目的基因序列
将BL21/pET32a-VZV gE工程菌扩增培养,提取质粒进行PCR和双酶切后,交由北京六合华大基因科技有限公司测序鉴定。鉴定结果显示,pET32a-VZV gE重组质粒中含有去除第1~30氨基酸序列的VZV gE胞外域基因序列。
2.3 重组gE蛋白可溶性表达检测
重组菌经1 mmol/L IPTG诱导后,通过电泳图谱分析发现,随着诱导时间的延长,重组gE蛋白表达量不断增加,在第8小时时表达量趋向峰值,条带为43.07%(图2A)。重组菌经超声破碎后,取上清液和沉淀物进行SDS-PAGE分析。结果发现,在上清液样本泳道中,相对分子质量(molecular weight, MW)约77.6×103处出现明显的目的条带,而沉淀物样本中目的条带较浅,表明重组gE蛋白主要为可溶性表达(图2B)。

A: Tertiary structure prediction of recombinant gE protein. B: Prediction of antigen epitopes of recombinant gE protein.
2.4 重组gE蛋白纯化产物的特异性检测
重组gE蛋白纯化并去除内毒素后,经检测内毒素含量<5 EU/mL。经SDS-PAGE鉴定和Gis软件分析,该重组蛋白溶液的纯度约90%(图3A)。进一步采用以小鼠抗VZV gE单克隆抗体(1∶4 000稀释)为一抗的WB技术进行鉴定,结果显示纯化的重组gE蛋白实验组在MW约为77.6×103处出现明显的优势条带,提示重组gE蛋白具有较强的特异性(图3B)。
2.5 小鼠血清抗VZV gE多克隆抗体效价测定
2.6 小鼠抗VZV gE多克隆抗体的特异性鉴定
制备VZV和HCMV感染的HF细胞片及HSV-1、HSV-2感染的Vero细胞片,以重组gE抗原免疫小鼠制备的相应特异性多克隆抗体作为一抗(1∶500稀释)、Alexa Fluor 488标记山羊抗小鼠IgG作为二抗(1∶4 000 稀释)进行间接免疫荧光染 色反应。结果显示,VZV感染的HF细胞膜呈现典型的绿色荧光着色;而其他疱疹病毒感染的细胞膜均未出现绿色荧光信号(图4)。这提示用重组gE蛋白制备的多克隆抗体具有高度特异性。

A: SDS-PAGE detected the expression of recombinant gE protein induced at different time. M: Protein Marker 26610; 1: BL21/pET32a-VZV gE recombinant bacteria before induction; 2-7: Followed by inducted 2, 4, 6, 8, 10 and 12 h. B: The expression of recombinant gE protein was detected by SDS-PAGE electrophoresis. M: Protein Marker 26610; 1: BL21/pET32a-VZV gE recombinant bacteria before induction; 2: Recombinant bacteria were not lysised after induction; 3: Supernatant of bacterial lysates; 4: Precipitation of bacterial lysates.

A: SDS-PAGE results of recombinant gE protein purified product. M: Protein marker 26610; 1: BL21/ pET-32a negative control; 2: Recombinant gE protein purified product. B: Results of WB identification of recombinant gE protein purified product. M: Protein marker26616; 1: BL21/pET-32a negative control; 2: Recombinant gE protein purified product.
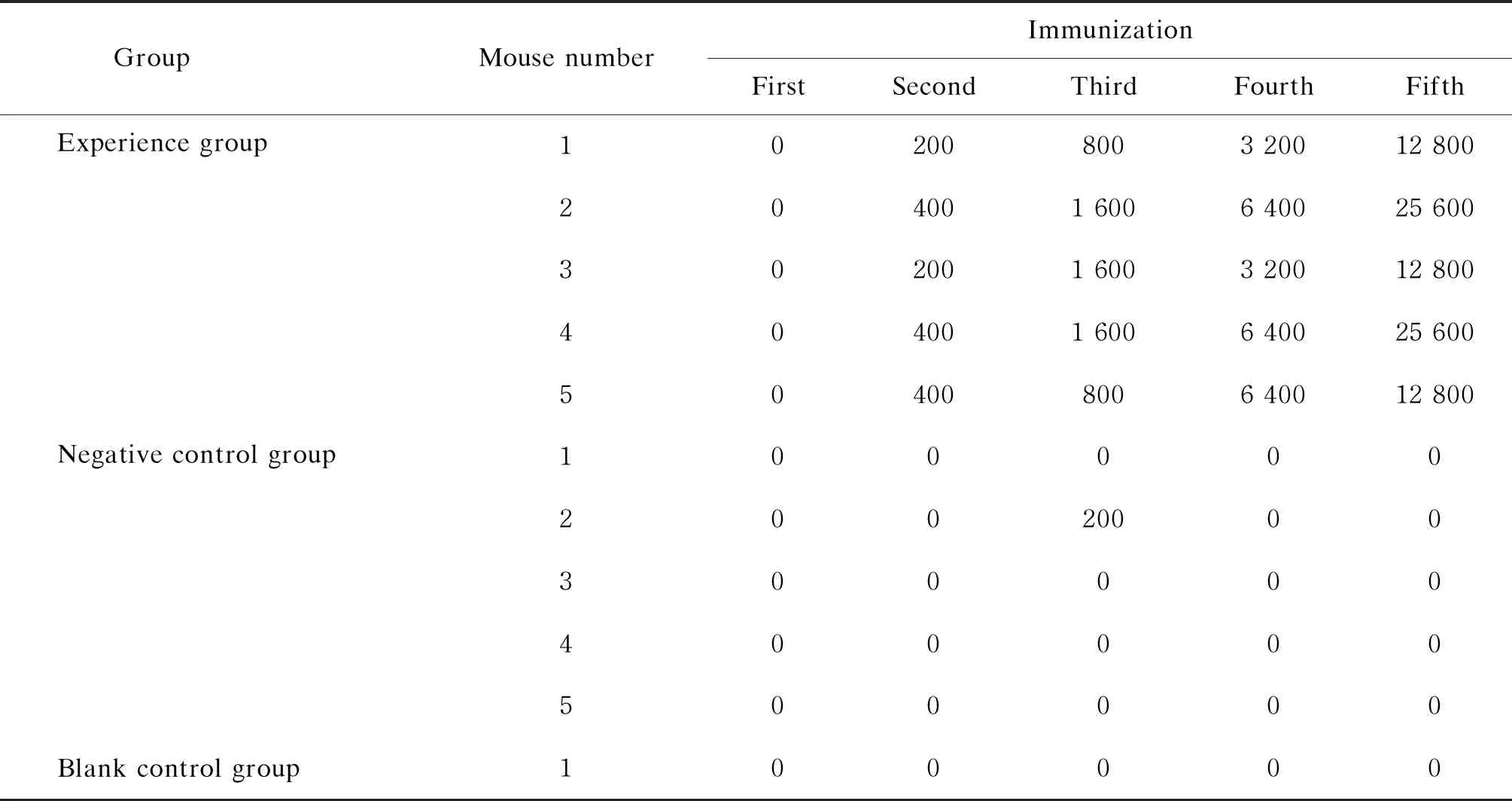
表1 小鼠血清抗VZV gE多克隆抗体水平
3 讨论
VZVgE胞外域主要含有3个抗原表位,分别位于第56~75、第86~105和第116~135氨基酸残基[13]。在原核表达系统中,gE蛋白N端的信号肽因无法被相应受体识别而失去其作用,并且其疏水性可能会导致gE蛋白的错误折叠从而影响蛋白表达。在pET32a质粒中,Trx含有原核表达系统的信号肽且对人体无毒副作用[14]。因此,采用去除信号肽的gE胞外域序列构建的BL21/pET32a-VZV gE重组菌可能有助于重组gE蛋白重要抗原表位的可溶性表达。这可能是本研究所获目的蛋白能够保持较高免疫原性的原因之一。但本次实验数据处理时,未对临界值附近标本进行重复检测,这是此次实验研究中存在的不足,今后还将进一步改进和完善。
HZ多发于老年人以及免疫缺陷患者,细胞免疫功能的降低是HZ发病的重要因素[15]。gE丰富表达于VZV和其感染的细胞表面,是VZV特异性CD4+T细胞反应的主要靶点[16]。VZV gE亚单位疫苗Shingrix良好的临床免疫效果得益于其使用的AS01B佐剂能够有效协助抗原诱导产生VZV gE特异性CD4+T细胞,从而引发细胞免疫应答[17, 18]。所以国产VZV gE亚单位疫苗的研发应当重视不同的佐剂产生的效力,有效的佐剂不仅在先期接种时强化疫苗产生的免疫效果, 同时有助于提高机体的免疫记忆能力,使机体随着年龄增长仍能保持对VZV特异性免疫应答能力。
真核表达系统具有磷酸化和糖基化等修饰功能[19,20],可提高蛋白的活性和免疫原性,但由于其生产周期长和成本高等因素的限制,目前上市的VZV疫苗Shingrix产能相对不足。由于我国每年有近300万人受HZ影响,使得疫苗的需求压力较大,尽快研发出国产疫苗迫在眉睫。本研究构建的原核系统表达的重组gE蛋白在保持其有较强的免疫原性的同时,还具备工艺相对简单、生产成本低、可大规模发酵和工业化生产等优势[21],这为后期能够大规模工业化生产VZV gE亚单位疫苗奠定了基础。

A: Normal HF cells and cells were infected with VZV or HCMV AD169 respectively; normal Vero cells and cells were infected with HSV-1 or HSV-2 respectively. B: HF cells were infected with VZV, and each panel shows DAPI (left), Alexa Fluor488 labeled goat anti-mouse IgG (middle) fluorescence signals, as well as a merge (right). C: HCMV-infected HF cells, HSV-1 infected Vero cells and HSV-2 infected Vero cells were stained with DAPI (upper) or Alexa Fluor488 labeled goat anti-mouse IgG (lower) respectively. Scale bar is 50 μm.
