基线血清外泌体miR-155-5p联合乙型肝炎病毒DNA定量实验预测聚乙二醇干扰素治疗乙型肝炎e抗原阳性慢性乙型肝炎的疗效
2020-05-31胡乾坤王倩倩李强黄晨璐许伟张毅李新艳陈良黄玉仙
胡乾坤,王倩倩,李强,黄晨璐,许伟,张毅,李新艳,陈良,黄玉仙
复旦大学附属公共卫生临床中心肝病科,上海 201508
乙型肝炎病毒(hepatitis B virus,HBV)感染呈世界性流行,严重影响人类健康。全球约有2.48亿慢性HBV感染者,每年约有100万人死于HBV感染相关疾病[1],尽早规范抗病毒治疗对于延缓疾病进展、改善患者生命质量至关重要。目前,聚乙二醇干扰素(peginterferon, Peg-IFN)是治疗乙型肝炎e抗原(hepatitis B e antigen,HBeAg)阳性慢性乙型肝炎(chronic hepatitis B, CHB)的一线药物之一。虽然它能够在有限的疗程里提高HBeAg血清学转换率[2],但仍有近2/3患者的治疗结果不理想。研究表明基线高水平丙氨酸转氨酶(alanine aminotransferase,ALT)、低水平HBV DNA、HBV基因型[3]以及治疗过程中乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)和HBV DNA的动态变化[4]等可作为Peg-IFN治疗后是否发生HBeAg血清学转换的预测因子。然而,上述临床参数多为病毒相关预测因子,有关宿主免疫功能的预测因子较少涉及。
microRNAs(miRNAs, miR)是一类在转录后水平调控靶基因表达的非编码小RNA[5]。HBV感染会改变宿主miRNAs谱,进而影响病毒-宿主相互作用。其中,miR-155表达上调与CHB患者外周血免疫细胞活化密切相关[6, 7],它能通过靶向细胞因子信号抑制物1(suppressor of cytokine signaling 1, SOCS1)促进JAK/STAT信号通路活化从而增强固有免疫的抗HBV效应[8],而且外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)中基线miR-155表达水平能预测抗病毒治疗应答[6]。循环中的miRNAs能够以游离、核酸-蛋白复合物或包裹在外泌体的膜性囊泡等多种形式存在。随着检测技术的发展,外泌体源性miRNAs在诊断和预测疾病预后方面的价值逐渐得到显现[9,10]。循环中的miR-155-5p能否作为预测Peg-IFN治疗HBeAg阳性CHB疗效的指标尚不明确。为此,本研究回顾性分析了88例初次接受Peg-IFN治疗的HBeAg阳性CHB患者的临床资料,分别检测基线血清和血清外泌体miR-155-5p表达水平,探讨循环中的miR-155-5p及其他指标对于Peg-IFN疗效的预测效能,期望为临床治疗提供参考。
1 材料和方法
1.1 研究对象
纳入2016年6月至2019年6月在本中心肝病科初次接受Peg-IFN治疗且完成48周疗程的HBeAg阳性CHB患者88例。所有患者均符合《慢性乙型肝炎防治指南(2015年版)》[11]的诊断标准及Peg-IFN抗病毒治疗标准。排除标准包括:①HBeAg和抗-HBe同时阳性;②入选前曾接受过抗病毒治疗;③合并其他病毒感染,如丙型肝炎病毒(hepatitis C virus, HCV)、丁型肝炎病毒(hepatitis D virus, HDV)和戊型肝炎病毒(hepatitis E virus, HEV)等;④服用免疫抑制剂(包括糖皮质激素类药物)或免疫功能缺陷;⑤基线血清不足或不可获得;⑥未完成48周Peg-IFN治疗。同时,选取24例健康受试者作为对照。本研究通过了本中心伦理委员会批准,所有入组患者和健康受试者均签署了知情同意书,研究程序符合1975年《赫尔辛基宣言》。
1.2 治疗方案和判断标准
Peg-IFNα-2a (派罗欣®,180 μg/0.5 mL,上海罗氏制药有限公司) 180 μg皮下注射,每周1次,连续治疗48周。根据患者是否发生HBeAg血清学转换分为治疗应答组和治疗无应答组。
1.3 基线血清miRNA、血清外泌体总RNA提取及miR-155-5p表达水平检测
使用miRcute Serum/Plasma miRNA Isolation Kit(Cat No./ID:DP503, 北京天根生化科技有限公司)提取血清总miRNA。使用exoRNeasy Serum/Plasma Midi Kit (Cat No./ID:77044, 德国Qiagen公司)提取血清外泌体[12],经透射电子显微镜和蛋白质印迹法鉴定[13]后用QIAzol裂解外泌体并提取总RNA。使用miDETECT A TrackTMmiRNA qRT-PCR Starter Kit (Cat No./ID: C10712-1,广州锐博生物科技有限公司)通过加polyA尾反转录法分别获取总cDNA,再通过miR-155-5p特异的正向引物序列 (5′-AAGCGACCTTAATGCTAATCGTGAT-3′)和通用反向引物序列(5′-CAGTGCAGGGTCCG-AGGT-3′)进行聚合酶链反应(poly merase chain reaction, PCR)扩增。扩增程序为:95 ℃ 10 min预变性后,95 ℃ 2 s、60 ℃ 20 s、70 ℃ 10 s,重复40个循环。PCR仪器为StepOne PlusTM实时荧光定量PCR仪(美国Applied Biosystems公司)。每个样本均重复测定3次。以Cel-miR-39为标准化外参,使用2-ΔΔCT方法[14]计算miR-155-5p的相对表达水平。
1.4 常规实验室指标检测
血常规检测采用全自动血细胞分析仪BC-3000 Plus(深圳迈瑞生物医疗有限公司)。肝功能检测采用全自动生化分析仪7600 Series(日本日立公司)。HBV免疫标志物采用全自动化学发光免疫分析仪ARCHITECTi 2000SR及配套专用试剂(美国雅培公司)。HBV DNA检测采用HBV核酸定量检测试剂盒(湖南圣湘生物科技有限公司),使用ABI 7500实时荧光定量PCR仪(美国Applied Biosystems公司)进行扩增检测,最低检测下限为 100 IU/mL。
1.5 统计学分析

2 结果
2.1 入组患者基线特征
入组患者基线资料见表1。88例CHB患者中,男性57例,女性31例,Peg-IFN治疗48周发生HBeAg血清学转换20例(22.73%)。以健康受试者为对照, CHB患者基线血清miR-155-5p(图1A,P=0.046)和血清外泌体miR-155-5p(图1B,P=0.011)均有不同程度升高。根据Peg-IFN治疗结局将CHB患者分为治疗应答组与无应答组,两组间的年龄、性别、白细胞计数、血红蛋白、血小板计数、天冬氨酸转氨酶(aspartate aminotransferase, AST)、碱性磷酸酶、γ-谷氨酰胺转肽酶、总胆红素、白蛋白、球蛋白、HBV基因型、HBsAg定量(表1)和血清miR-155-5p表达水平(图1A)无统计学差异(P值均>0.05)。治疗应答组与治疗无应答组相比,前者基线ALT(P=0.027)和血清外泌体miR-155-5p表达水平 (图1B,P<0.001) 明显更高, 而基线HBeAg(P=0.011)和HBV DNA定量(P=0.007)明显更低。
2.2 基线指标与Peg-IFN疗效的关系
采用单因素logistic回归分析年龄、性别、ALT、AST、HBsAg、HBeAg、HBV DNA、血清miR-155-5p及血清外泌体miR-155-5p与Peg-IFN疗效的相关性,筛查有统计学意义的预测因子,然后共同纳入多因素logistic回归模型。结果发现,基线血清外泌体miR-155-5p(OR=2.193,95%CI1.315~3.655,P=0.003)和HBV DNA(OR=0.398,95%CI0.163~0.976,P=0.036)是Peg-IFN治疗48周后发生HBeAg血清学转换的独立预测因子(表2)。

表1 入组患者基线特征 (n=88)

表2 Logistic回归分析与干扰素治疗应答的相关指标
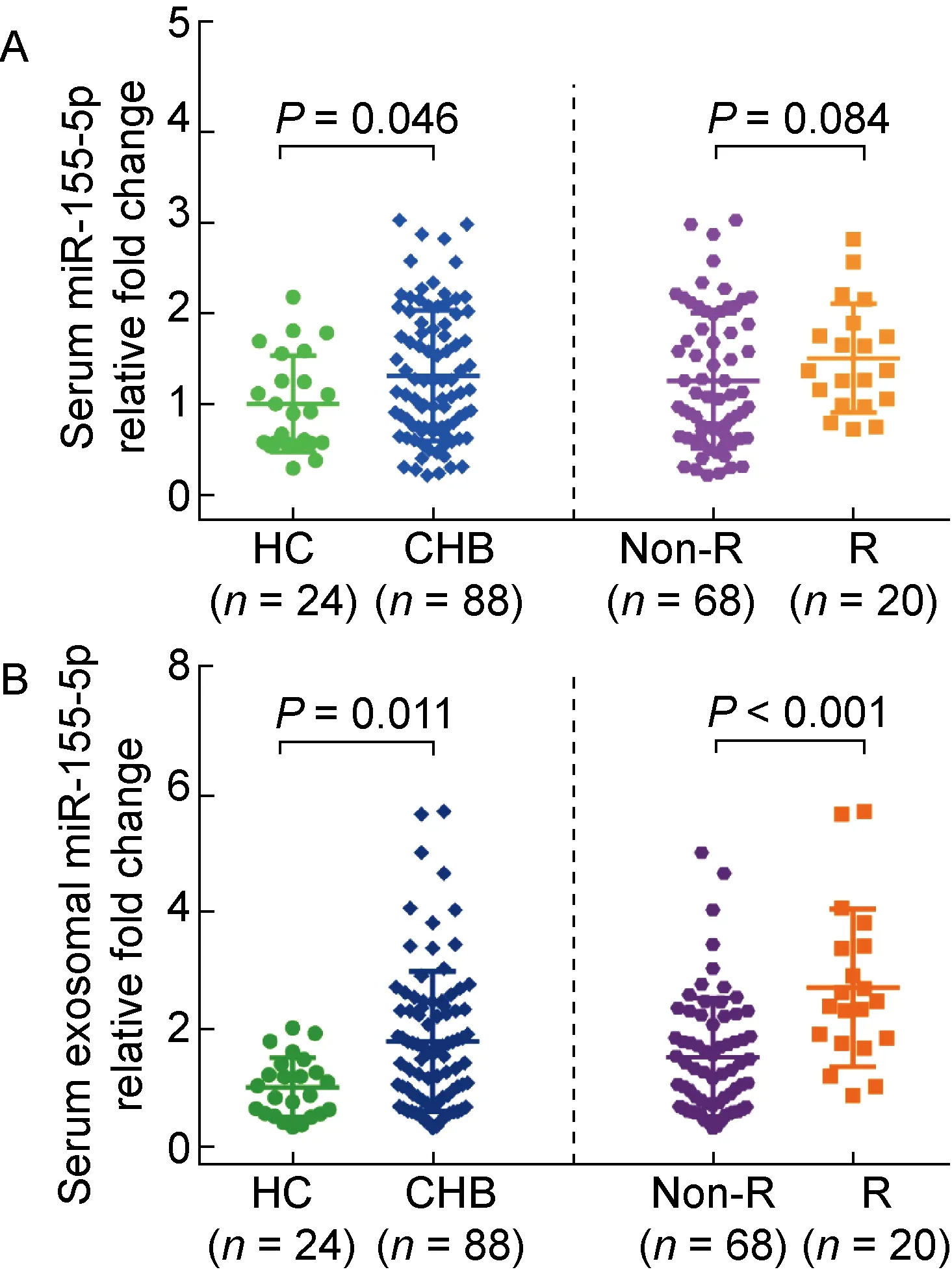
A: Comparison of baseline serum miR-155-5p expression levels between healthy controls and total CHB patients, treatment non-response and response group. B: Comparison of baseline serum exosomal miR-155-5p expression levels between healthy controls and total CHB patients, treatment non-response and response group. Healthy controls were normalized to 1. HC, healthy controls; CHB, chronic hepatitis B; Non-R, non-response; R, response.
2.3 基线血清外泌体miR-155-5p和HBV DNA对Peg-IFN疗效的预测效能
采用ROC曲线下面积评估基线血清外泌体miR-155-5p表达水平和HBV DNA定量水平对HBeAg血清学转换的预测效能,并根据约登指数选择最佳截断值。结果发现,基线血清外泌体miR-155-5p表达水平在2.3时,ROC曲线下面积为0.788(95%CI0.682~0.893),相应的灵敏度、特异度、阳性预测值和阴性预测值分别为65.0%、82.4%、52.0%和88.9%(表3)。当基线HBV DNA定量水平在7.2 log10IU/mL时,ROC曲线下面积为0.704(95%CI0.577~0.824),相应的灵敏度、特异度、阳性预测值和阴性预测值分别为80.0%、57.4%、35.6%和90.7%(表3)。两者联合后的ROC曲线下面积将增加到0.823(95%CI0.721~0.924)(图2)。
2.4 不同基线特征CHB患者的HBeAg血清学转换率比较
根据基线血清外泌体miR-155-5p表达水平(截断值2.3)和HBV DNA定量水平(截断值 7.2 log10IU/mL)的不同,将入组CHB患者分为不同亚组,比较各亚组经Peg-IFN治疗48周后的HBeAg血清学转换率。结果发现,基线血清外泌体miR-155-5p表达水平≥2.3且HBV DNA定量≤7.2 log10IU/mL的15例患者中,有10例发生了HBeAg血清学转换(66.67%);基线血清外泌体miR-155-5p表达水平≥2.3但HBV DNA定量>7.2 log10IU/mL的10例患者中,有3例发生了HBeAg血清学转换(30.00%);基线血清外泌体miR-155-5p表达水平<2.3但HBV DNA定量≤7.2 log10IU/mL的30例患者中,有6例发生了HBeAg血清学转换(20.00%);而基线血清外泌体miR-155-5p表达水平<2.3且HBV DNA定量>7.2 log10IU/mL的33例患者中,仅1例发生了HBeAg血清学转换(3.03%)(图3)。

表3 基线血清外泌体miR-155-5p和HBV DNA对治疗应答的预测效能

图2 基线血清外泌体miR-155-5p、HBV DNA以及联合应用对Peg-IFN疗效的预测效能

“Y” denotes yes, and “N” denotes no.
3 讨论
对于HBeAg阳性CHB患者而言,经Peg-IFN治疗后实现HBeAg血清学转换标志着部分免疫控制和长期病毒学抑制,是抗病毒治疗应答的关键指标。在临床实践中,根据早期参数预测Peg-IFN的疗效,有助于对CHB患者的抗病毒方案进行优化。本研究发现,基线血清外泌体miR-155-5p表达水平和HBV DNA定量水平均可作为Peg-IFN治疗48周发生HBeAg血清学转换的独立预测因子。基线血清外泌体miR-155-5p预测Peg-IFN疗效的最佳截断值是2.3,相应的 ROC曲线下面积为0.788,灵敏度、特异度、阳性预测值和阴性预测值分别为65.0%、82.4%、52.0%和88.9%。基线HBV DNA预测Peg-IFN疗效的最佳截断值是 7.2 log10IU/mL,相应的ROC曲线下面积为0.704,灵敏度、特异度、阳性预测值和阴性预测值分别为80.0%、57.4%、35.6%和90.7%。
miR-155位于人类21号染色体B细胞整合簇(B-cell Integration Cluster,BIC)基因的第3个外显子内,它在血细胞发育、肿瘤生成、免疫应答和炎症反应等方面发挥调控作用[15]。Wang等[16]研究发现口腔疱疹病毒感染能诱导巨噬细胞产生miR-155,并能直接靶向SOCS1激活IFN信号通路来增强固有免疫系统抗病毒能力。此外,对于免疫耐受或免疫缺陷患者来说,因免疫细胞功能障碍造成的SOCS1表达增加和miR-155表达下调,可能是他们对IFN抗病毒或抗肿瘤治疗反应不佳的原因。Sarkar等[17]发现HBV感染者miR-155表达和Toll样受体7(Toll-like receptor 7,TLR7)表达呈正相关,体外实验表明miR-155通过靶向CCAAT/增强子结合蛋白 β(CCAAT/enhancer binding protein β,C/EBP-β)抑制HBV复制。Ge等[6]发现miR-155表达下调与CHB患者外周血自然杀伤(natural killer,NK)细胞的功能障碍密切相关,在活化的NK细胞中过表达miR-155能明显促进IFN-γ和肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)的生成。Fang等[7]则发现miR-155表达水平与CHB患者CD4+和CD8+T细胞的活化呈正相关,提示前者可能是慢性HBV感染者免疫激活的潜在标志物。本研究同样发现,免疫活动期的CHB患者机体免疫耐受被打破,肝脏炎症反应明显,血清miR-155-5p和血清外泌体miR-155-5p表达水平均有不同程度升高。因此,miR-155-5p在病毒与宿主相互作用,尤其是在慢性HBV感染与机体免疫应答过程中发挥重要调控作用。
既往研究表明CHB患者PBMCs、循环以及肝组织中存在特异变化的miRNAs,并且基线PBMCs和循环中差异表达的miRNAs可以作为Peg-IFN疗效的预测因子[18,19]。然而,基线循环中的miR-155-5p是否存在差异表达以及能否作为Peg-IFN 治疗HBeAg阳性CHB患者的疗效预测因子尚不明确。为此,本研究以健康受试者为对照,检测了治疗应答和无应答组基线血清miR-155-5p表达水平,结果并未发现两组间的表达有统计学差异(P=0.084)。进一步检测基线血清外泌体miR-155-5p的表达水平,结果发现两组间表达存在显著差异(P<0.001),并且能够用于预测Peg-IFN的疗效。虽然HBeAg阳性CHB患者的血清和血清外泌体miR-155-5p表达水平均有不同程度升高,但基线血清外泌体miR-155-5p对于预测Peg-IFN的疗效更具优势。分析原因如下:①外泌体的囊泡结构能保护miRNA分子免受循环中RNA酶的降解[20],从而增强了其作为标志物的稳定性和诊断潜能。②外泌体的内容物与血清或血浆样本并不完全一致,有些差异表达miRNAs可能在外泌体中富集[21]。在CpG联合脂多糖诱导的肝损伤模型中,血浆外泌体源性miR-155表达明显增加,而血浆蛋白结合的miR-155表达明显减少[22]。Matsuura等[23]也发现慢性丙型肝炎患者的肝组织、血浆和血浆外泌体中的let-7s表达水平无相关性。③基于外泌体的生物标志物分析与血清或血浆样本相比,前者样本内容物的复杂性明显降低,一定程度上减少了血清或血浆复杂背景所造成的干扰[24]。④miRNAs并非随机包裹进入外泌体,机体在不同病理生理状态下具有引导特异miRNAs进入外泌体的分选机制[25]。因此,我们推测HBeAg阳性CHB患者血清外泌体miR-155-5p的高表达,一定程度上反映了宿主免疫耐受的打破和免疫功能的重建,活化的免疫细胞合成的miR-155-5p会优先分选进入外泌体,而治疗应答组CHB患者处于相对较高的免疫激活状态,体内免疫细胞合成并释放外泌体miR-155-5p的能力更强,在此基础上应用IFN治疗相对容易实现HBeAg血清学转换。
基线HBV DNA定量在预测Peg-IFN疗效中的价值已得到多个研究证实。对于HBV 基因型B型或C型的CHB患者来说,基线低水平HBV DNA(<2×108IU/mL)和基线高水平ALT(≥2ULN)的患者更可能对Peg-IFN治疗产生应答[3]。Fan等[26]研究表明基线低水平HBV DNA(<9 log10copies/mL)和基线高水平乙型肝炎核心抗体(hepatitis B core antibody, HBcAb)(≥ 4.4log10IU/mL)的CHB患者,经Peg-IFN治疗后有65.8%(50/76)发生HBeAg血清学转换。本研究同样发现,将基线血清外泌体miR-155-5p和HBV DNA联合分析,能进一步提高对Peg-IFN疗效的预测效能。基线血清外泌体miR-155-5p表达水平≥2.3且HBV DNA定量≤7.2 log10IU/mL的患者,Peg-IFN治疗48周后的HBeAg血清学转换率最高,达到66.67%(10/15),而基线血清外泌体miR-155-5p表达水平<2.3且HBV DNA定量>7.2 log10IU/mL的患者,Peg-IFN治疗48周后的HBeAg血清学转换率最低,仅为3.03%(1/33)。
本研究也存在一定局限性。首先,本研究属于单中心的回顾性队列研究,纳入的患者数量有限,部分患者因信息缺失或治疗中断而排除,这可能会对研究结果造成偏倚,因此需要大样本的前瞻性队列研究来验证现有结论的真实性和可靠性。其次,基线血清外泌体miR-155-5p预测Peg-IFN疗效的具体作用机制以及Peg-IFN治疗过程中血清外泌体miR-155-5p的动态变化情况有待进一步研究。
综上所述,基线血清外泌体miR-155-5p联合HBV DNA定量可以预测Peg-IFN 治疗HBeAg阳性CHB 患者48周发生的血清学转换。研究对于优化HBeAg阳性CHB患者的抗病毒治疗方案及提高Peg-IFN抗病毒治疗效果可能有积极作用。
