新型冠状病毒肺炎合并妊娠病例的临床与实验室指标分析
2020-05-29张丽霞费安兴
李 胜,张丽霞,费安兴,何 松,江 鸿
(鄂东医疗集团黄石市妇幼保健院检验科,湖北黄石 435000)
继2002年暴发的严重急性呼吸综合征冠状病毒(SARS-CoV)和2012年暴发的中东呼吸综合征冠状病毒(MERS-CoV)之后,新型冠状病毒(SARS-CoV-2)是引发人类重症肺炎的第3种跨物种屏障的致病冠状病毒[1]。2020年3月11日,世界卫生组织宣布新型冠状病毒肺炎(COVID-19)是全球性流行病事件。
根据国家卫生健康委员会办公厅国家中医药管理局办公室发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》,COVID-19患者的临床表现以发热、咳嗽、乏力为主,疾病早期白细胞计数及淋巴细胞计数正常或减少,肺部呈特征性影像学改变。危重型COVID-19患者可出现休克、呼吸衰竭、多器官功能衰竭。本文通过对3例妊娠合并COVID-19病例的临床特征、实验室检查结果、干预策略及妊娠结局进行分析,以期为临床医生诊断和治疗妊娠合并COVID-19患者提供参考。
1 资料与方法
1.1一般资料 截至2020年2月23日,本院收治妊娠合并COVID-19患者入院行剖宫产或清宫术患者3例。结合流行病学史、临床症状、影像学表现、实验室检查结果,2例妊娠合并COVID-19患者被诊断为普通型COVID-19,1例患者被诊断为重型COVID-19。
1.2SARS-CoV-2核酸检测 SARS-CoV-2核酸检测采用实时荧光定量PCR(qPCR)方法,试剂为SARS-CoV-2检测核酸释放试剂和SARS-CoV-2 Orf1ab/N基因位点qPCR检测试剂(购自中国湖南圣湘公司),仪器为全自动核酸提取仪(购自中国上海宏石公司)及PCR扩增仪(购自中国上海宏石公司),检验者需严格按照操作规程操作。
1.3其他实验室检测 血常规采用迈瑞BC6800仪器及其配套试剂检测;肝功能等生化指标采用BS-2000仪器及其配套试剂检测;C-反应蛋白(CRP)采用Astep仪器及中国深圳国赛生物CRP试剂检测。所有检测均严格按照厂家说明书操作。
2 结 果
2.1妊娠合并COVID-19患者临床特征及妊娠结局 2例妊娠合并COVID-19患者表现出发热伴咳嗽或打喷嚏的症状,1例患者无明显COVID-19症状。3例患者均未出现阴道出血、腰酸、腹痛等先兆流产症状。CT影像检查显示,3例患者的肺部多发斑片状或磨玻璃密度影,提示病毒性肺炎。2例新生儿生命体征(心跳、脉搏、体温及呼吸)正常,咽拭子SARS-CoV-2核酸检测均为阴性,转入新生儿病房观察。见表1。
2.2妊娠合并COVID-19患者的实验室检测结果 入院检测时,3例患者的咽拭子SARS-CoV-2核酸检测结果均为阳性,3例患者均无明显白细胞计数减少,1例患者淋巴细胞计数减少,3例患者丙氨酸氨基转移酶(ALT)及天门冬氨酸氨基转移酶(AST)值正常,1例患者CRP明显升高,见表2。

表1 3例妊娠合并COVID-19患者的临床特征及妊娠结局

续表1 3例妊娠合并COVID-19患者的临床特征及妊娠结局
注:-表示该项无数据。
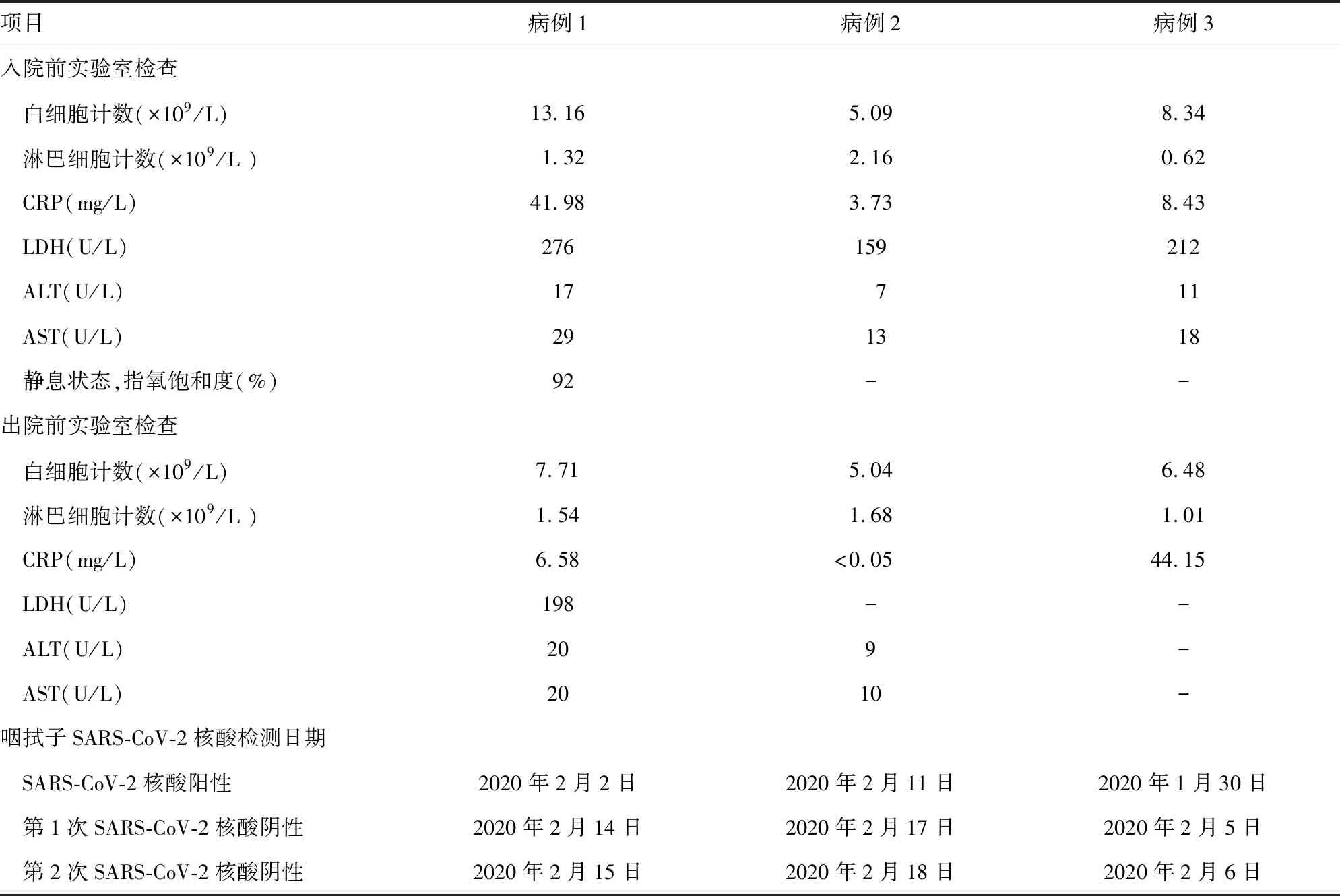
表2 3例妊娠合并COVID-19患者的实验室检测结果
注:LDH表示乳酸脱氢酶;实验室各项指标参考值范围,白细胞计数(3.5~9.5)×109/L,淋巴细胞计数(1.1~3.2)×109/L,CRP 0~5 mg/L,ALT 5~50 U/L,AST 15~40 U/L,LDH 120~250 U/L;-表示该项无数据。
3 讨 论
本文回顾性分析了3例妊娠期感染COVID-19孕妇的临床特征、实验室检查结果、干预策略及妊娠结局。基于上述3个病例,笔者发现COVID-19孕妇患者的临床表现与未怀孕成年患者类似,无严重母婴不良结局。但是,本研究中3例患者均术后恢复良好,也可能与患者及时就诊及早期积极临床干预相关。本研究可为临床医生对妊娠合并COVID-19患者的诊疗提供参考。
由于妊娠期孕妇白细胞计数会出现生理性增加[2],所以妊娠合并COVID-19患者血常规改变可能会不明显。本研究中3例患者的白细胞计数均没有低于实验室参考范围下限,仅1例存在淋巴细胞计数低于实验室参考范围下限的情况。CT因其辐射可能影响胎儿的发育[3],而导致CT在疑似COVID-19孕妇的临床诊断中易受到患者及家属的心理排斥。在疾病的早期或轻症患者,口/鼻咽部病毒载量低,使咽拭子SARS-CoV-2核酸检测得到假阴性结果[4]。因此,妊娠合并COVID-19比普通患者群更容易漏诊。对疑似COVID-19的孕妇,应及时进行单人单间隔离,避免交叉感染。
ZHANG等[5]分析并报道了武汉大学中南医院收治的221例COVID-19患者临床特征及实验室检查结果,发现55例重型COVID-19患者的血清LDH值均明显升高,而ALT、AST水平可轻度升高或正常。本研究中1例重型COVID-19孕妇LDH水平升高,ALT、AST水平正常,2例普通型COVID-19孕妇LDH、ALT、AST水平均正常,与其报道的未怀孕成年COVID-19患者血清生化指标的变化趋势一致。此外,XU等[6]也报道了20例依赖气管插管进行辅助通气的危重症COVID-19患者的LDH达397.1(342.2~523.8)U/L。值得注意的是,曾有研究报道临床干预前的血清LDH水平是影响SARS-CoV预后的独立因素[7-8],而SARS-CoV与SARS-CoV-2基因组有82%序列同源。因此,推测LDH与COVID-19的进展及预后密切相关。
CHEN等[9]对9例妊娠合并COVID-19患者的新生儿进行研究,羊水、脐带血及新生儿咽拭子的SARS-CoV-2核酸检测结果均为阴性。LIU等[10]对11例妊娠合并COVID-19患者分娩的新生儿进行新生儿咽拭子核酸检测,也未发现母婴垂直传播。本研究中,2例新生儿咽拭子核酸检测为阴性。基于目前有限的数据,笔者并未发现母婴垂直传播的直接证据。目前,国内已确诊数例COVID-19新生儿患者,但这些新生儿羊水、脐带血等分娩时相关标本均未进行病毒核酸检测。因此,不能排除为出生后被SARS-CoV-2携带者通过呼吸道飞沫或密切接触传播而感染。
妊娠期孕妇免疫功能处于相对抑制状态,如淋巴细胞增殖能力下降、CD4+T细胞应激分化能力下降等,使母体对外来病原体的防御功能下降[11]。此外,通气量增加、耗氧量增加、膈肌抬高、胸廓横径扩大等,使妊娠妇女呼吸道机能的负荷增加[12]。因此,与未妊娠的成年人相比,妊娠期孕妇面临更高的COVID-19感染风险。建议妊娠期孕妇应当积极自我防护以最大限度地预防COVID-19。
