弥漫大B细胞淋巴瘤患者TLR4、NF-κB蛋白的表达及临床意义*
2020-05-29李新霞王新有孙明玲范文霞张凯乐王秀娟郭新红
王 蕾,刘 颖,李新霞,王新有,孙明玲,范文霞,张凯乐,王秀娟,郭新红△
(新疆医科大学第一附属医院:1.血液三科;2.病理科,新疆乌鲁木齐 830054)
弥漫大B细胞淋巴瘤(DLBCL)作为一种极为常见的恶性淋巴瘤[1],在中国的发病率约占非霍奇金淋巴瘤患者的45%[2]。DLBCL无论是在组织形态学、临床表现,还是在预后上均具有显著的特异性[3]。Toll样受体4(TLR4)作为一种被研究最多的Toll样受体之一,在天然免疫系统及肿瘤的发生、发展中均发挥着积极的作用[4]。核因子κB(NF-κB)作为一种细胞核转录因子,一般存在于多种肿瘤细胞中,能够异质性地与免疫球蛋白κ链相结合,是一种在肿瘤形成过程中发挥重要作用的活化因子[5]。然而有关DLBCL 的发生、发展及预后与TLR4、NF-κB细胞通路相关分子的研究仍较少。本研究通过检测并分析118例DLBCL患者的TLR4、NF-κB蛋白表达情况,旨在为DLBCL患者的预后与治疗提供一定的理论依据。
1 资料与方法
1.1一般资料 选取2015年4月至2017年1月本院就诊的118例DLBCL患者作为观察组。纳入标准:(1)均符合中华医学会血液学分会2013年制订的DLBCL诊断标准[6];(2)人类免疫缺陷病毒、血液、肝脏、心脏等检查结果均正常;(3)年龄18~<80岁。排除标准:(1)心、肝等器官功能严重损害者;(2)长期进行激素药物治疗者;(3)有药物过敏史者。其中,男61例,女57例;年龄19~72岁,平均(44.3±13.7)岁。选取同期本院118例体检健康者纳入健康对照组,其中男59例,女59例;年龄21~77岁,平均(45.3±12.8)岁。2组研究对象在性别和年龄等一般资料上差异均无统计学意义(P>0.05),具有可比性。该项目所有参与试验的研究者及家属均签署知情同意书,并已通过本院伦理委员会审查。
1.2仪器与试剂 0.3%H2O2、甲醛、二甲苯及磷酸盐缓冲溶液等均购自中国上海生工公司;TLR4、NF-κB均为多克隆抗体,购自美国Sigma公司。
1.3方法 采用10%甲醛溶液将标本组织固定后,用石蜡包埋制成4 μm的切片,采用二甲苯进行石蜡脱化,并加入0.3%H2O2去除过氧化物酶,正常山羊血清工作液封闭,添加一抗稀释溶液,4 ℃过夜,磷酸盐缓冲溶液清洗后,苏木精复染、乙醇脱水、二甲苯透明、树胶封片,并在显微镜下查看。以磷酸盐缓冲液一抗染色作为阴性对照,以DLBCL患者淋巴组织染色作为阳性对照[7]。TLR4、NF-κB蛋白为阳性的主要判断标准,细胞质或细胞核表现为黄色或棕黄色,否则为阴性。然后随机选择5个高倍视野区,在显微镜下查看具有代表性的视野,统计每100个细胞中阳性细胞数,从而确定细胞的阳性率[8]。

2 结 果
2.12组研究对象TLR4、NF-κB蛋白阳性表达率的比较 结果显示,观察组的TLR4、NF-κB蛋白阳性表达率均明显高于健康对照组(P<0.05),见表1。
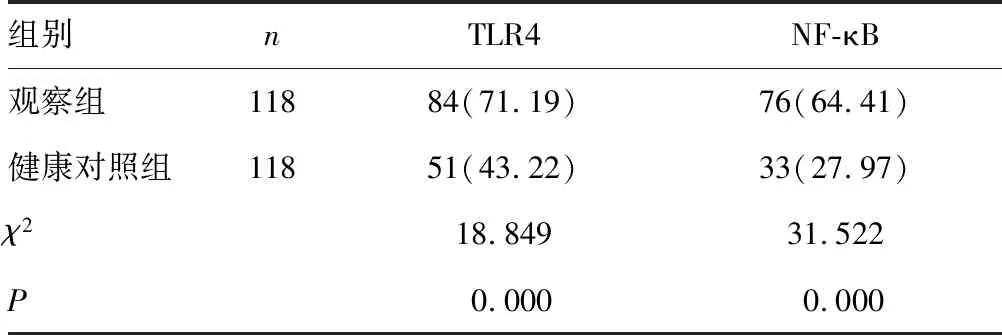
表1 2组研究对象TLR4、NF-κB蛋白阳性表达率的比较[n(%)]
2.2不同病理学特征的DLBCL患者TLR4、NF-κB蛋白阳性表达率比较 DLBCL患者的临床分期、乳酸脱氢酶(LDH)及国际预后指数(IPI)均与TLR4及NF-κB蛋白阳性表达率有关(P<0.05),年龄、性别、结外累及、B症状等指标均与TLR4、NF-κB蛋白阳性表达率无关(P>0.05),见表2。
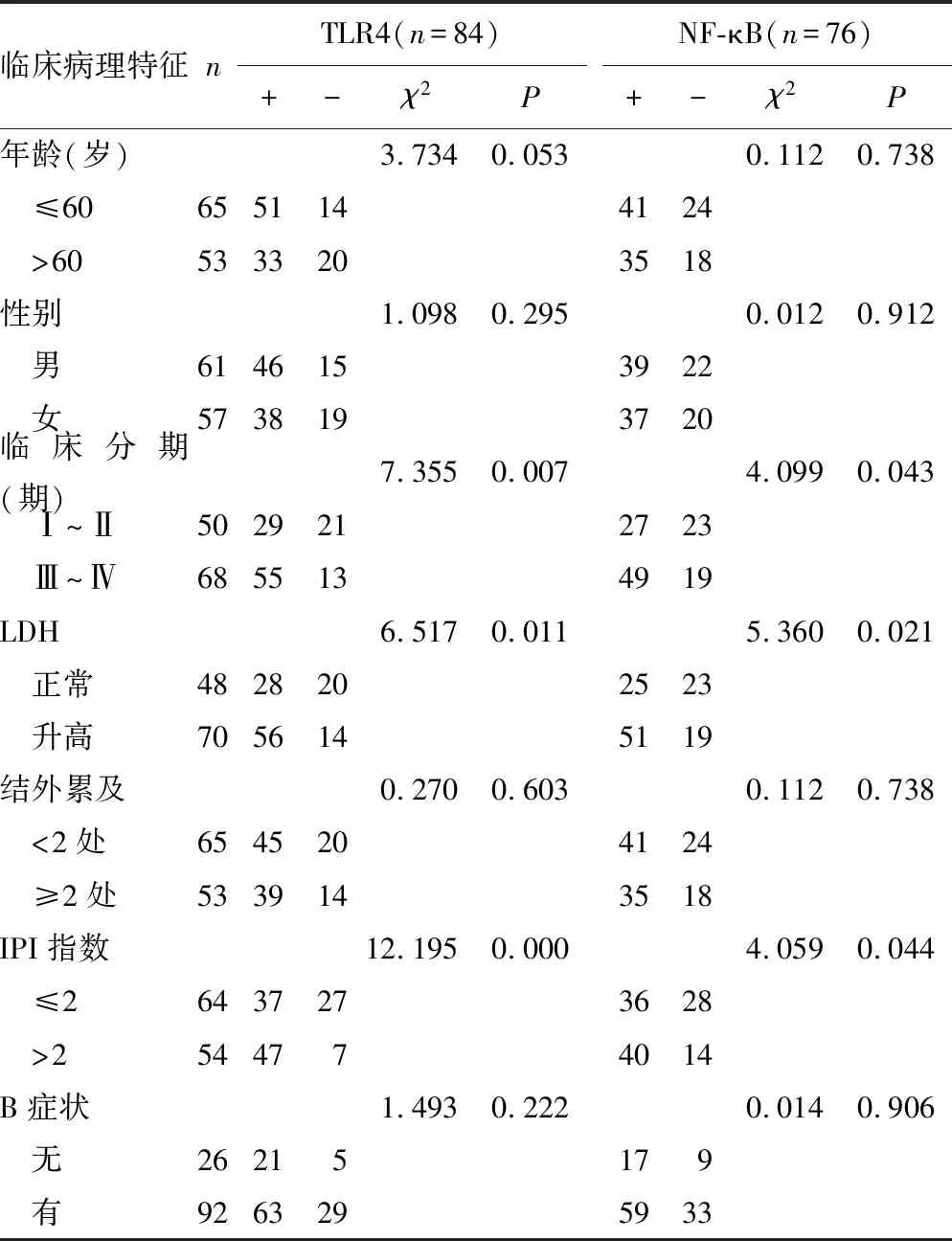
表2 不同病理学特征的DLBCL患者TLR4、NF-κB蛋白阳性表达率比较(n)
2.3TLR4、NF-κB蛋白表达与DLBCL患者预后的关系 DLBCL患者的生存时间从纳入研究开始统计,通过定期电话随访和门诊复诊等了解患者的预后情况。结果显示,TLR4、NF-κB蛋白表达为阳性的患者生存率显著低于阴性表达的患者(P<0.05),见图1。
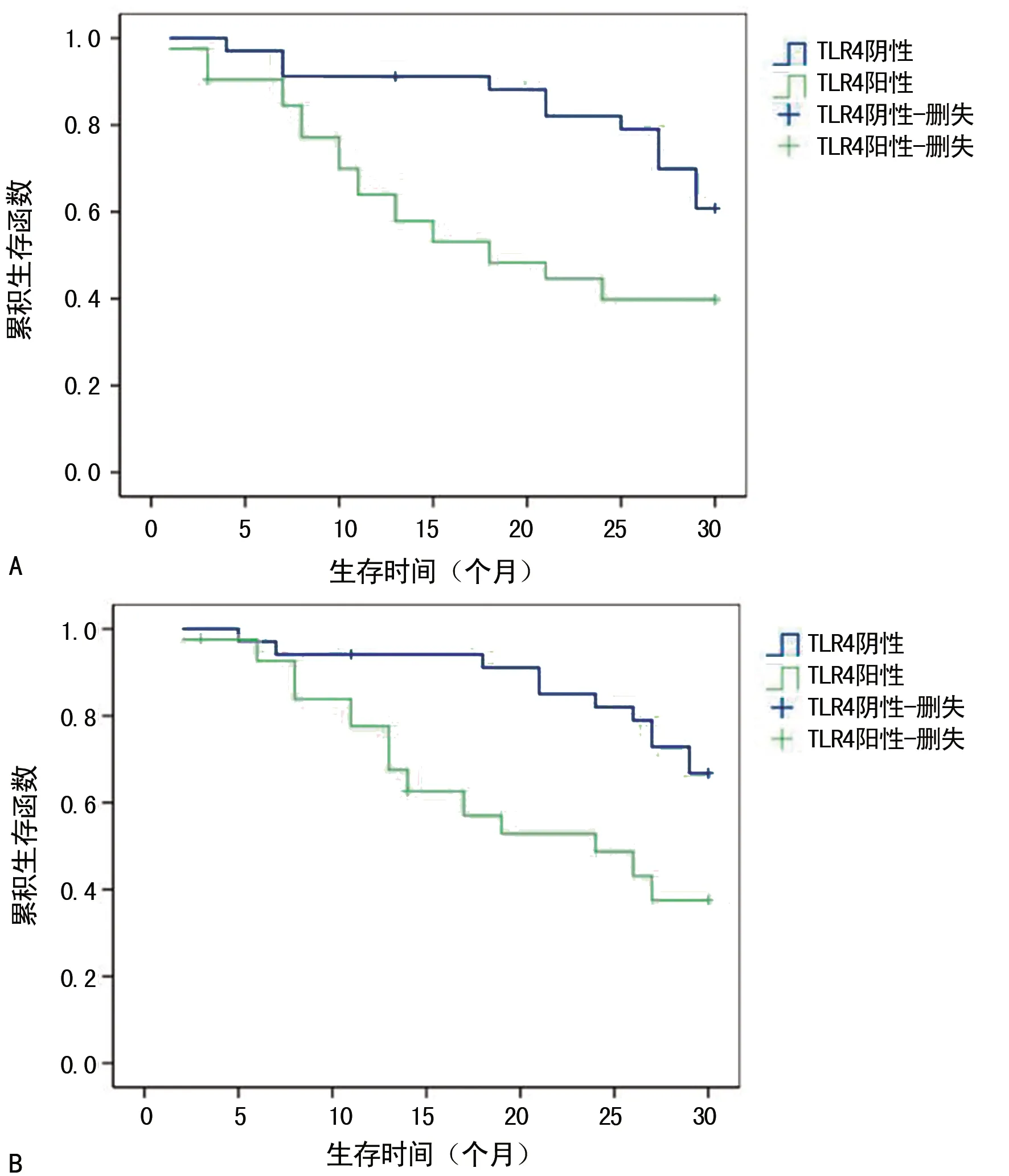
注:A表示DLBCL患者TLR4蛋白表达的总生存曲线;B表示DLBCL患者NF-κB蛋白表达的总生存曲线。
图1 不同DLBCL患者TLR4、NF-κB蛋白表达的总生存曲线
3 讨 论
DLBCL作为一种大B淋巴细胞弥散性恶性增生疾病,具有很强的异质性[10]。该病属于侵袭性淋巴瘤,病情初期不易发现,而且病情发展较迅速,在患者发病时淋巴结快速肿大,常伴发淋巴结外病和骨髓侵犯等疾病,一旦确诊即是晚期,病死率较高[11]。
TRL通过从病毒及各种内源性分子中识别出不同的病原相关分子模式,主要在单核细胞、巨噬细胞、树突状细胞等固有免疫系统细胞表面表达[12]。已有研究证实,TLR4作为TRL家族被研究较深入的一员,不仅广泛表达于自然杀伤细胞等免疫原性细胞,而且也常见于宫颈癌等恶性肿瘤[13]。YANG等[14]报道TRL4在人乳腺癌细胞中具有明显的高表达。NF-κB蛋白因子通过与核内增强子κB部位特异性结合从而促进相关蛋白的转录,在体液免疫及肿瘤的发生中发挥重要作用[15]。
研究发现多种淋巴瘤细胞中都有TLR4表达[16],但其具体作用机制及与淋巴瘤侵袭作用的相关性仍尚不明确。NF-κB作为TLR4的经典下游分子,在肺癌、淋巴瘤、乳腺癌中高表达[17]。本研究结果显示,观察组的TLR4、NF-κB蛋白阳性表达率均明显高于健康对照组(P<0.05),本研究证实了TLR4在DLBCL患者肿瘤细胞增殖、迁移、侵袭中有着显著的高表达,而高表达的TLR4又可显著增强DLBCL患者细胞增殖、迁移与侵袭,TLR4激活后可促进肿瘤生长和抵抗化学治疗。另外作为TLR4下游的NF-κB信号分子,其会随着TLR4表达的改变而改变,TLR4信号途径能够激活NF-κB促进炎症因子的产生。通过激活TLR4受体,NF-κB也随之激活,研究显示当NF-κB活性增强后,癌细胞活性也随之激活,同时诱导调控白细胞介素-6等肿瘤生长因子[18],表明TLR4及NF-κB可作为DLBCL发展及预后的评定指标之一,这与本文的研究结果相一致。
此外,本研究表明不同DLBCL患者的临床分期、LDH及IPI均与TLR4及NF-κB蛋白阳性表达率有关(P<0.05)。DLBCL属于高侵袭性淋巴细胞瘤,肿瘤的增殖指数等病理学参数一般也较高,TLR4及NF-κB蛋白在淋巴瘤组织中的表达强度也较高,提示TLR4及NF-κB蛋白在DLBCL疾病的发生、发展中起重要作用。此外,TLR4、NF-κB蛋白表达为阳性的患者生存率显著低于阴性表达的患者(P<0.05)。这表明,TLR4及NF-κB蛋白的高表达加快了DLBCL的进展,对患者预后存在一定影响,TLR4能够识别包括脂多糖在内的多种外源性配体,从而促进肿瘤细胞增殖和细胞繁殖等,因此,阻止TLR4及NF-κB的激活能减缓DLBCL肿瘤生长及延长患者的生存期。
4 结 论
综上所述,TLR4及NF-κB蛋白在DLBCL患者中高表达,且与DLBCL患者的临床分期、LDH及IPI相关,可作为DLBCL发展及预后评定指标之一,有望成为治疗及改善淋巴瘤预后的新靶点。
