基于石墨烯/离子液体的牛血红蛋白分子印迹材料的制备
2020-05-29田文锠陈毅挺林晓森沈开泽柯雪君
田文锠,陈毅挺,林晓森,沈开泽,林 静,柯雪君
(闽江学院海洋学院,福建 福州 350108)
分子印迹技术是一种分离纯化技术,针对选定的模板分子制备对其有特异性识别能力的聚合物,可从复杂的介质中吸附分离目标物[1-5]。该技术具有构效可预定与选择性识别等优点[6-9],已成为分析化学、生物医药等领域的前沿技术,被广泛地应用于生物传感[10-12]、药物的检测[13-14]、固相萃取[15-17]等诸多领域。研究适合蛋白质等大分子的分子印迹材料可以对医药学、蛋白质组学等研究的开展提供一定的帮助[18-22]。但由于生物分子的特殊性质,如大的分子尺寸、复杂的空间结构、大量的功能基团、水溶性等,使得对应的印迹技术出现了诸如所形成的较大的印迹空穴容易塌陷、聚合效率不高等问题,而离子液体的引入可以有效地改善分子印迹膜的性质[23-26]。
离子液体是由有机阳离子和无机或有机阴离子构成的、在室温或室温附近的温度下呈液体状态的盐类[27-28]。离子液体具有液体温度范围较宽,化学性质稳定,且易于改性等特点[29]。离子液体内部分子之间的作用主要有阴阳离子的静电引力、范德华力、氢键力等[30-31],尤其是阴阳离子的静电力对分子印迹聚合物的制备有着特殊的影响。离子液体相比传统的有机溶剂,具有极佳的溶解性,而相比于水相溶剂,则不易破坏模板分子和功能单体间的特异性相互作用[32-33]。因此,用离子液体取代常规溶剂制备分子印迹聚合物是有前景的。
牛血红蛋白(bovine hemoglobin,BHb)是红细胞内运输氧的特殊蛋白质,并协助参与二氧化碳的运载,调节血液的酸度,具有显著的生理作用[34-35]。以纳米材料为载体的分子印迹技术,吸附容量大,且利于目标蛋白的分离与富集[36-39]。本论文以功能化石墨烯(Grapheneoxide,GO)为基质,牛血红蛋白为模板分子,离子液体和丙烯酰胺(Acrylamide, AAM)为复合功能单体,N,N’-亚甲基双丙烯酰胺(N,N’-methylenebisacrylamide,NNMBA)为交联剂进行聚合,以制备对BHb具有特异识别的分子印迹材料。
1 实验部分
1.1 试剂与仪器
牛血红蛋白购自上海源叶生物科技有限公司;氧化石墨烯购自苏州碳丰科技;碘化-1-乙烯基-3-甲基咪唑购自上海成捷化学有限公司;N, N’-亚甲基双丙烯酰胺(NNMBA)购自国药集团化学试剂有限公司;丙烯酰胺、氯乙酸购自天津市福晨化学试剂厂;四甲基乙二胺(Tetramethylethylenediamine,TEMED)购自上海谱振生物科技有限公司;所用试剂未注明的均为分析纯,实验用水为去离子水。
F380荧光光谱仪(天津港东),is5傅立叶变换红外光谱仪(美国赛默飞),SU8010场发射扫描电镜(日本日立),THZ-82水浴恒温振荡器(易晨仪器制造有限公司),DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司)。
1.2 分子印迹聚合物的制备过程
制备过程示意图如图1所示。首先在200 mL氧化石墨烯超声分散液(1 mg·mL-1,超声10 min)加入10 g NaOH和10 g 氯乙酸,水浴超声反应3 h,用稀HCl中和后用超纯水反复离心冲洗至中性,冷冻干燥,从而得到羧基化石墨烯[40]。向干燥烧瓶中加入600 mg羧基化石墨烯,60 mL二氯亚砜,8 d DMF,70 ℃回流24 h后,将剩余的二氯亚砜用NaOH溶液吸收。将产物蒸干后,加入6 g AAM,50 mL DMF,超声10 min,于45 ℃回流24 h后,用超纯水洗至中性,真空干燥2 h,得到丙烯酰胺化石墨烯[41]。
在锥形瓶中加入5 mg BHb,25 mg碘化1-乙烯基-3-甲基咪唑和7.5 mL磷酸缓冲溶液(PBS,pH 6.8),搅拌2 h。接着加入37.5 mg NNMBA并搅拌30 min,随后将10 mg 丙烯酰胺化石墨烯和200 mg 丙烯酰胺加入上述溶液当中,反应20 min后依次加入7.5 mg 过硫酸钾和25 μL TEMED,通氮除氧后密封,水浴震荡反应48 h。将产物过筛加入洗脱液(10%(体积分数)乙酸+0.1 g·mL-1十二烷基硫酸钠)进行洗脱(每次加洗脱液后都要超声2 min),再用去离子水洗脱至无蛋白质残留,冷冻干燥,得到分子印迹聚合物(MIP)。
制备空白印迹聚合物(NIP)无需加入BHb作为模板分子,其余步骤同MIP。

图1 印迹材料合成示意图Fig.1 Schematic diagram of imprinted material synthesis
1.3 吸附性能评价
称取3 mg的MIP,加入5 mL浓度为0.25 mg·mL-1的BHb溶液,静置吸附24 h后测其上清液牛血红蛋白浓度,按照以下公式[26]计算BHb的吸附容量:
Q= (Ci-Cf)V/m
式中:Q为单位质量分子印迹材料吸附的蛋白量(mg·g-1);Ci为蛋白原始浓度(mg·mL-1);Cf为吸附后剩余蛋白浓度(mg·mL-1);V为混合液的体积(mL);m为所用印迹材料的质量(g)。
MIP与NIP的专属性可以通过印迹因子(IF)进行评价[42],其计算公式为:
IF=△QMIP/△QNIP
式中:△QMIP和△QNIP分别为MIP与NIP的吸附容量。
2 结果与讨论
2.1 分子印迹聚合物合成条件优化
2.1.1 牛血红蛋白标准曲线

图2 牛血红蛋白标准曲线图Fig.2 Bovine hemoglobin standard curve
配制一系列不同浓度的BHb溶液,测量各溶液在406 nm处的吸光度[43],每份溶液平行测量3次后取平均值,绘制得到BHb的标准曲线(图2)。
如图2所示,吸光度与BHb的浓度呈现良好的线性关系,所得曲线方程为A=0.005 7×C(mg·L-1)-0.009 6,相关系数R2为0.999 9。
2.1.2 离子液体用量的选择
向10 mL容量瓶中分别加入5 mg离子液体,15 mg离子液体,25 mg离子液体,50 mg离子液体,75 mg离子液体,5 mg Bhb和7.5 mL磷酸缓冲溶液(pH=6.8),按照1.2中步骤合成MIP与NIP,并测得各自的吸附容量,如图3所示。
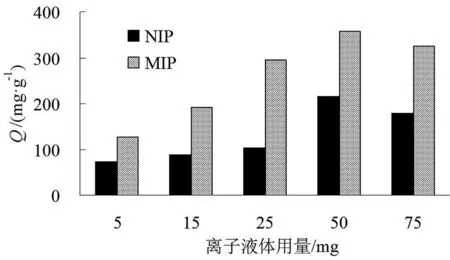
图3 离子液体用量对吸附容量的影响Fig.3 Effect of ionic liquid dosage on adsorption capacity
由图3可见,随着离子液体添加量的增多,虽然MIP和NIP吸附容量都有所增加,在功能单体的用量为25~75 mg,合成的MIP有比较高的吸附容量,但当离子液体用量为50、75 mg时,NIP的吸附容量也比较大,因此选择分子印迹材料制备中离子液体的用量为25 mg。
2.1.3 交联剂用量的选择
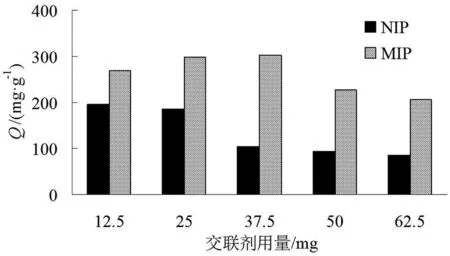
图4 交联剂用量对吸附容量的影响Fig.4 Effect of crosslinking agent dosage on adsorption capacity
按照1.2中步骤合成MIP与NIP,分别加入12.5、25、37.5、50、62.5 mg NNMBA,以考察交联剂对分子印迹材料吸附能力的影响,结果如图4所示。
从图4可以看出,当交联剂NNMBA用量为25 mg与37.5 mg时,MIP的吸附性能最强,此后随着交联剂用量的增加,MIP的吸附容量明显下降,说明过多的交联剂会造成分子印迹材料内针对于模板分子的空穴减少,不利于分子印迹材料对BHb的识别。而NIP在NNMBA用量为37.5~62.5 mg时均较小,因此,确定交联剂NNMBA的用量为37.5 mg。
2.2 分子印迹聚合物性能表征
2.2.1 扫描电镜图
制备出来的MIP和NIP进行扫描电镜表征,得到的结果如图5所示。
由图5可见,MIP的表面形态粗糙、有空隙,而NIP表面形态就平整得多,其造成MIP表面凹凸不平的原因是它有模板分子参与形成聚合物,之后表面蛋白质被洗脱后留下空穴,从侧面说明模板分子得到了洗脱。

图5 MIP(左)和NIP(右)的电镜图Fig.5 SEM images of MIP(left)and NIP(right)

图6 红外光谱图Fig.6 Infrared spectrogram
2.2.2 红外光谱
分别扫描离子液体、未加入离子液体的MIP与加入离子液体的MIP的红外光谱,结果如图6所示。
从图6可以看出有加离子液体的MIP上,3 452.438 cm-1为- N- H的振动吸收峰;2 934.644 cm-1为C=C- H的振动吸收峰;1 681.141 cm- 1为- C=O的振动吸收峰;1 653.660 cm-1为C=C的振动吸收峰;2 967.910 cm- 1为- CH2的振动吸收峰;1 240.486 cm-1为- C- N的振动吸收峰[44],上述这些特征吸收峰都是交联剂所产生的。2 993.945 cm-1为咪唑阳离子上 C-H的吸收峰;1 580.379 cm-1为咪唑环骨架所产生的振动吸收峰源,1 457.439 cm-1为甲基 C-H 的振动吸收峰。1 158.044 cm-1为咪唑环的吸收峰[45],这些峰为离子液体的特征吸收峰。这说明离子液体已成功连接到聚合物上,而没有随着洗脱过程流失。
2.3 吸附性能评价
2.3.1 缓冲液pH值的影响
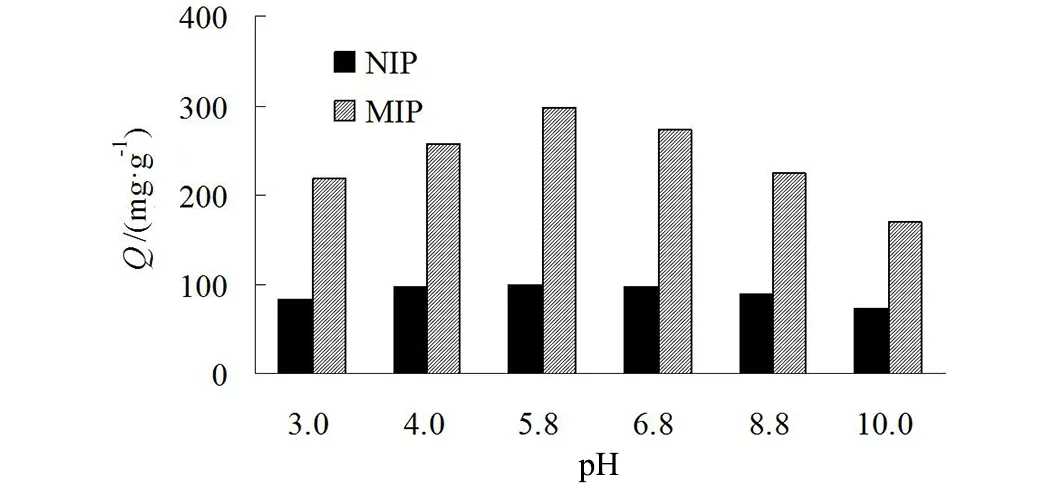
图7 缓冲液pH值的优化图Fig.7 Optimization diagram of buffer pH value
吸附过程中环境的酸度对于吸附量会有明显的影响,控制溶液pH分别为3.0、4.0、5.8、6.8、8.8、10.0,按照1.3中的步骤得到各pH值下BHb的吸附容量(图7)。
从图7可以看出,添加的缓冲液PBS的pH值不相同,对聚合物吸附Bhb的量和吸附特异性会造成影响,当pH为5.8时,NIP的吸附量较小而MIP的吸附量最大,因此选择缓冲液的pH为5.8。
2.3.2 等温吸附实验
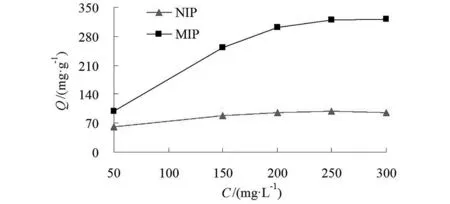
图8 等温吸附曲线Fig.8 Isothermal adsorption curve
吸附等温线可有效评价MIPs对模板蛋白的饱和吸附容量。将MIPs和NIPs加入不同浓度的BHb蛋白溶液中吸附后测量上印迹材料对蛋白的吸附量,所得结果如图8所示。
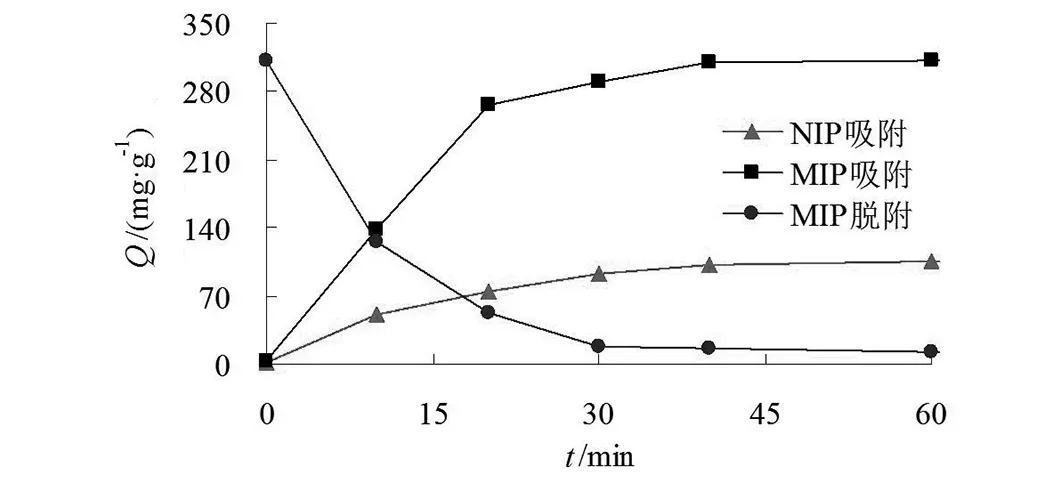
图9 吸附与脱附曲线Fig.9 Adsorption and desorption curves
从图8中可以看出,在50~250 mg·L-1的范围内,MIP的吸附容量随BHb浓度的增加而增大,同时NIP与MIP的吸附容量差距显著增大。这是由于NIP本身具有一定的非特异性吸附容量,在溶液中较快达到吸附平衡。当BHb浓度较低时,MIP与NIP的吸附容量差距无法拉开,而当BHb浓度较高时,由于MIP具有对应BHb的三维空穴和结合位点,MIP对BHb的选择性逐渐显现。
2.3.3 吸附与洗脱
模板分子的吸附和洗脱是印迹材料的关键因素,考察了不同吸附和洗脱时间下印迹材料对BHb的吸附量,结果如图9所示。
MIPs对BHb的印迹形式可能有表面印迹或埋在表面聚合物里面的印迹[46]。由图9可见,当吸附时间为20 min之前,MIP吸附动力学曲线的斜率较大,此时印迹形式主要为表面印迹,传质阻力较低。吸附时间达到20 min后,MIP的吸附量变化减小,此时印迹形式主要为埋在表面聚合物里面的印迹,BHb进入MIP的传质阻力增大。40 min后MIP吸附量趋于平稳状态。而NIP的吸附速率明显低于MIP,说明NIPs虽对BHb具备一定的吸附能力,但吸附容量低于MIP。吸附40 min,印迹因子(IF)为3.03,说明MIPs对模板分子的吸附量主要是由于印迹聚合物形成许多三维空穴和结合位点,从而实现BHb的特异性识别。同时,对吸附达到饱和后的MIP进行洗脱,当洗脱时间达到30 min时,印迹材料中的BHb几乎完全被洗脱。
2.3.4 竞争性与重复利用实验
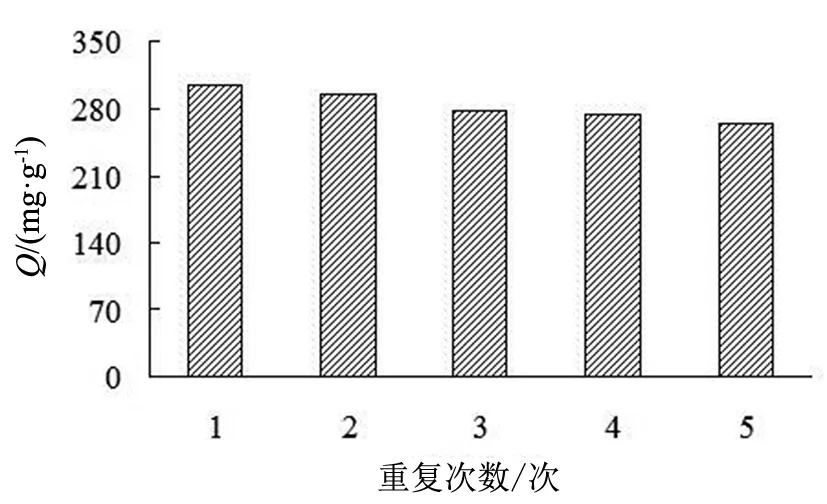
图10 重复性实验Fig.10 Repeated experiments
为考察印迹材料对模板蛋白和干扰蛋白的选择性识别,将MIP置于BHb、细胞色素C(Cyt C)、卵清白蛋白(OVA)与牛血清白蛋白(BSA)中,各自的吸附容量分别为305、65、139、73 mg·g-1,说明制备出的MIP对Bhb有较好的选择性识别。
利用MIP对BHb进行了5次吸附-解吸-再吸附实验,结果如图10所示。5次吸附容量无明显变化,其中第3、5次吸附容量分别为首次的91.35 %与86.56 %,说明合成的印迹聚合物的再生性能良好。吸附容量略有减小可能是由于洗脱液不能将血红蛋白洗脱充分,造成再吸附的时候,结合血红蛋白的印迹位点减少。
3 结论
以丙烯酰胺化石墨烯为基质,BHb为模板分子,离子液体和丙烯酰胺为功能单体,N-N亚甲基双丙烯酰胺为交联剂,所制备的分子印迹聚合物对BHb具有特异性吸附,并且重复利用性较高。
