己酸菌对高产酯酿酒酵母酒精发酵及酯醇代谢的影响
2020-05-29张华东李霄霄任雪张颖肖冬光
张华东,李霄霄,任雪,张颖,肖冬光
(天津市微生物代谢与发酵过程控制技术工程中心,工业发酵微生物教育部重点实验室, 天津科技大学 生物工程学院,天津 300457)
己酸菌是一类革兰氏阴性菌,厌氧或者兼性厌氧[1],在白酒生产中己酸菌多栖息在窖泥中,己酸菌产生的己酸可以与乙醇酯化成为己酸乙酯,白酒中的己酸乙酯大部分是由乙醇和己酸酯化生成[2],己酸乙酯是我国浓香型白酒的主体香味成分[3],己酸菌在浓香型白酒中的地位不言而喻。己酸菌液在灌窖、养护窖池、做人工窖泥方面都有重要的作用[4,5]。在窖泥中筛选的己酸菌多为克氏梭状芽孢杆菌,该菌多利用乙醇和乙酸为碳源,丁酸为前体物合成己酸,也有学者筛选到能利用乳酸为碳源合成己酸的瘤胃菌CBP6菌株[6-8]。
白酒的生产需要众多微生物菌群的参与,其中酵母菌是酒精发酵的主体菌,特别是酿酒酵母,随着发酵的进行,酿酒酵母在白酒生产过程中逐渐成为优势菌群。有研究表明酿酒酵母可以提高己酸菌的己酸产量[9],向己酸菌培养基中添加生香酵母有利于己酸菌的生长及代谢[10]。但是,己酸菌的主要代谢产物己酸对微生物的毒害作用也比较明显。
白酒生产从本质上说就是微生物相互作用的结果,研究微生物间相互作用对探究白酒生产机理及白酒生产技术的进步具有重大意义[11]。实验室前期通过分子手段获得了一株高产酯酿酒酵母MY-15,该菌株不仅能够高产乙酸乙酯和乙酸异戊酯,而且生长及酒精发酵性能与普通酿酒酵母没有区别。将己酸菌与高产酯酿酒酵母MY-15进行混合发酵,研究两株菌之间的相互作用,探究己酸菌对高产酯酿酒酵母酒精发酵及酯醇代谢的影响,为高产酯酿酒酵母的实际应用提供了理论依据。
1 材料与方法
1.1 菌株
己酸菌复合液:某酒厂提供;高产酯酿酒酵母MY-15(CGMCC No.5635):天津市工业微生物重点实验室保存。
1.2 主要试剂
硫酸镁、硫酸铵、磷酸氢二钾(均为分析纯):天津市北方天医化学试剂厂;乙酸钠、酵母膏、硫酸镁、硫酸铵、碳酸钙、乙醇:天津市风船化学试剂科技有限公司;耐高温α-淀粉酶(1×105U/mL)、糖化酶(2.9×105U/mL)、酸性蛋白酶(5×104U/mL):诺维信(中国)生物技术有限公司;玉米粉:购于超市;澳洲高粱:北京红星二锅头有限公司。
1.3 培养基
己酸菌培养基:乙酸钠5 g,酵母膏5 g,磷酸氢二钾0.4 g,硫酸镁0.2 g,硫酸铵0.5 g,去离子水1 L,121 ℃高压灭菌20 min,接菌时添加2%乙醇和1%经干热灭菌的碳酸钙。
高产酯酿酒酵母种子培养基:玉米粉与水按1∶4(g/mL)混合,添加耐高温α-淀粉酶(10 U/g原料)90 ℃水浴1 h,然后继续加热煮沸,维持 30 min,在之后补水至原体积,立即降温到60 ℃,添加糖化酶(250 U/g原料)在60 ℃水浴4 h,然后用4层纱布过滤,调节糖度为12 °Bx,添加硫酸铵6 g/L,硫酸镁1.2 g/L,磷酸氢二钾2.4 g/L,115 ℃高温灭菌20 min备用。
高粱汁发酵培养基:高粱粉与按水1∶3(g/mL)混合,液化糖化步骤同玉米粉水解液,糖化完成后降温到40 ℃,添加酸性蛋白酶(30 U/g原料)水浴4 h,然后用4层纱布过滤,在115 ℃高温灭菌20 min备用。
1.4 主要仪器与设备
MS204S电子天平 梅特勒-托利多仪器有限公司;1200系列高效液相色谱仪、7890B型气相色谱仪 美国安捷伦科技有限公司;XMTB型电热恒温水浴锅 天津市中环实验器材有限公司;H1650-W型高速冷冻离心机 湖南湘仪科技有限公司;BX43型生物显微镜 日本OLYMPUS会社;LDZM-60KCS立式压力蒸汽灭菌器 上海申安医疗器械厂。
1.5 试验方法
1.5.1 己酸菌菌悬液对高产酯酿酒酵母的影响
将4 ℃冰箱保存的己酸菌液按照10%(V/V)的接种量接种到新鲜的己酸菌培养基中,在35 ℃培养96 h,取150 mL培养液,于4 ℃离心,弃掉上清液后添加无菌水补充体积至150 mL重悬菌体,制成己酸菌菌悬液。
将己酸菌菌悬液按照0,5,10,15,20 mL的接种量接种到高粱汁培养基中,高产酯酿酒酵母接种量为10 mL,发酵总体积为130 mL/250 mL,在30 ℃静置发酵72 h。
1.5.2 己酸菌发酵液对酿酒酵母的影响
己酸菌厌氧培养9 d,获得己酸菌发酵液,离心取上清,上清液过膜除菌,测定己酸含量(9.53 g/L),然后用己酸发酵上清液配制含有不同己酸浓度(45,90,150,220 mg/L)的高粱汁发酵培养基,高产酯酿酒酵母MY-15接种量为10 mL,发酵总体积为130 mL/250 mL,在30 ℃静置发酵72 h。
1.6 分析方法
己酸检测:将样品离心并用0.22 μm的滤膜过滤到液相分析小瓶中,使用Agilent 1200SL 液相色谱仪,色谱柱HPX-87H(300 mm×7.8 mm×9 μm),UV检测器,流动相为5 mmol/L 的硫酸溶液,柱温为60 ℃,流速为0.6 mL/min,检测时间为48 min,进样量为20 μL。
高级醇、乙酸酯检测:发酵液经蒸馏后的样品使用气相色谱法测定,色谱条件:Agilent 7890B气相色谱仪,氢火焰离子检测器(FID),载气为高纯氮气,LZP930白酒分析专用毛细管柱(50 m×0.32 mm×0.25 μm),进样量1 μL,分流比10∶1,进样口温度200 ℃,检测器温度230 ℃,氢气流量40 mL/min,空气流量300 mL/min,柱流量0.8 mL/min。程序升温:50 ℃保持8 min,然后以5 ℃/min速率升温到200 ℃保持5 min。
残糖的测定:斐林试剂法[12]。
高产酯酿酒酵母RNA提取:取发酵对数期的发酵液2 mL,在4 ℃条件下以12000 r/min高速离心3 min,弃掉上清液,立即放入液氮中冷冻2 min,然后立即放入-80 ℃冰箱中备用。高产酯酿酒酵母RNA由诺禾致源生物信息科技有限公司提取。
2 结果与分析
2.1 己酸菌菌悬液对高产酯酿酒酵母酒精发酵及酯醇代谢的影响
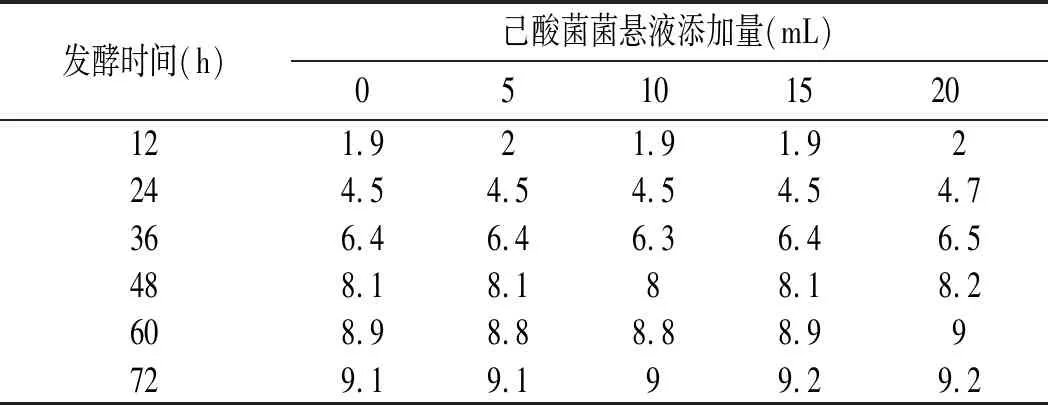
表1 己酸菌菌悬液不同添加量下MY-15的CO2排放量Table 1 CO2 emission load of MY-15 under different additive amount of caproic acid bacteria suspension g
酿酒酵母在限氧条件下,在酒化酶的作用下将葡萄糖发酵生成酒精和二氧化碳[13],二氧化碳失重变化可以反映酿酒酵母的发酵速度,发酵过程中每隔12 h称重一次。由表1可知,与对照相比,己酸菌菌悬液各添加量下高产酯酿酒酵母的发酵速度没有受到影响,总失重都在9.1~9.3 g之间。
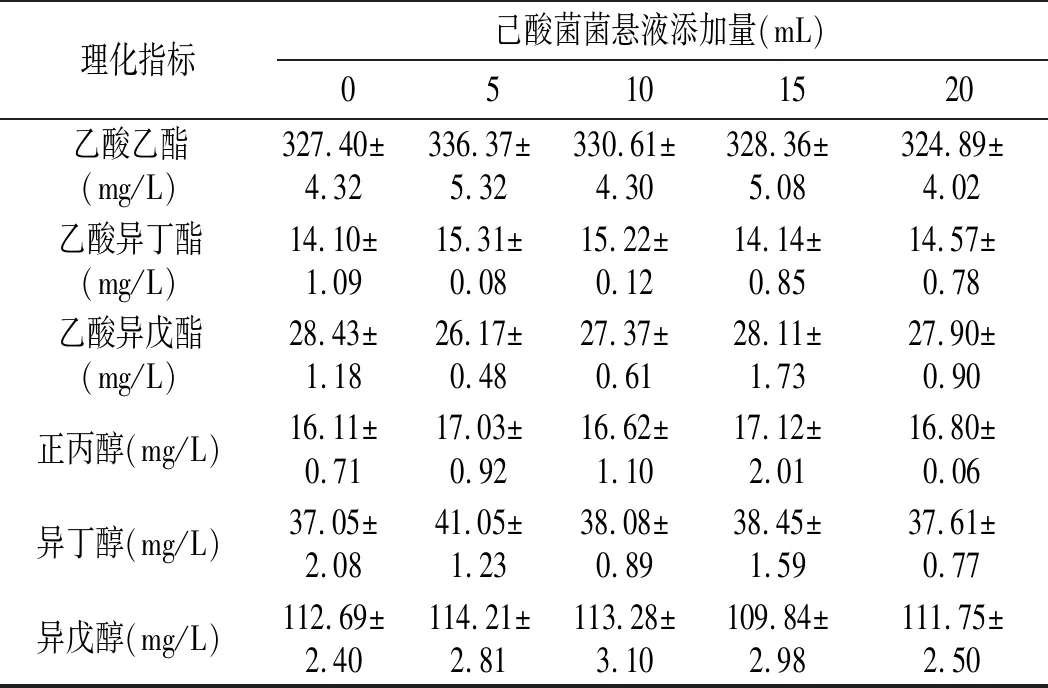
表2 己酸菌菌悬液不同添加量下高产酯酿酒酵母理化指标Table 2 Physicochemical indices of Saccharomyces cerevisiae with high-yield ester under different additive amount of caproic acid bacteria suspension
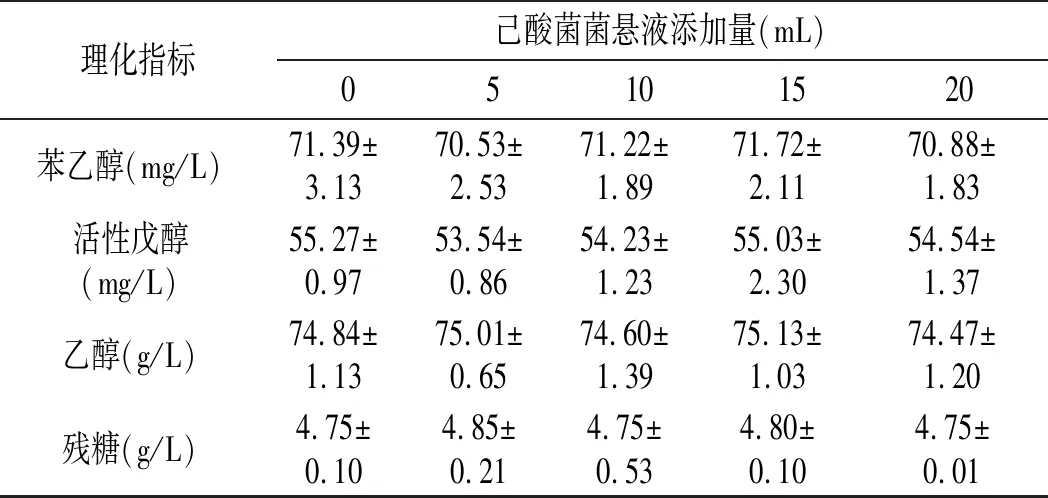
续 表
由表2可知,添加己酸菌菌悬液对高产酯酿酒酵母酯醇代谢及酒精发酵没有直接影响,主要原因可能是高粱汁发酵培养基不适合己酸菌生长代谢,或者是与发酵时间过短有关系。
2.2 己酸菌发酵液对高产酯酿酒酵母酒精发酵及酯醇代谢的影响
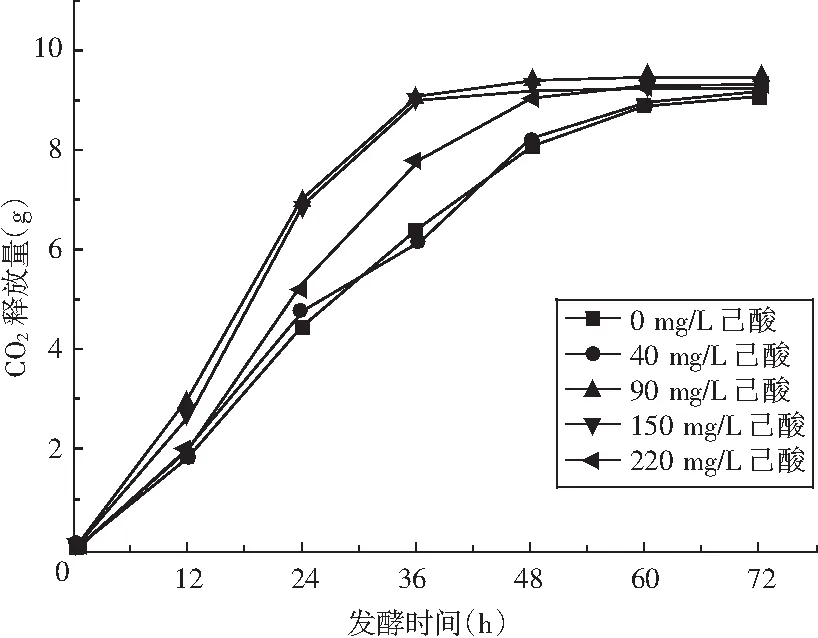
图1 不同己酸浓度下高产酯酿酒酵母的CO2排放量Fig.1 CO2 emission load of Saccharomyces cerevisiae with high-yield ester under different additive amount of caproic acid
由图1可知,随着高粱汁发酵培养基内己酸浓度的升高(0~220 mg/L己酸),高产酯酿酒酵母的发酵速度呈现先增加后降低的趋势,当培养基内己酸浓度为90,150 mg/L时,高产酯酿酒酵母的发酵速度有明显提高,说明培养基内含有适量的己酸菌发酵液能促进高产酯酿酒酵母的生长。
由图2可知,培养基内己酸浓度为45~220 mg/L时,高产酯酿酒酵母发酵72 h后的乙醇有略微提高,在己酸浓度为220 mg/L时高产酯酿酒酵母的乙醇为81.13 g/L,比己酸浓度为0 mg/L时增加了6.64%。发酵72 h后的残糖呈现降低的趋势,在己酸浓度为0,45,90,150,220 mg/L时,残糖分别为5.4,5.3,5.2,5,5 g/L。说明培养基内含有少量己酸菌代谢产物可以促进高产酯酿酒酵母的乙醇代谢。
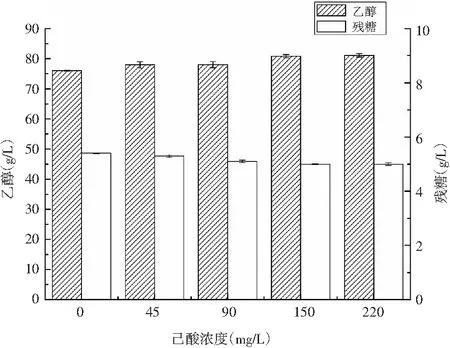
图2 不同己酸浓度下高产酯酿酒酵母的乙醇及残糖差异Fig.2 Differences in ethanol and residual sugar content of Saccharomyces cerevisiae with high-yield ester under different concentration of caproic acid
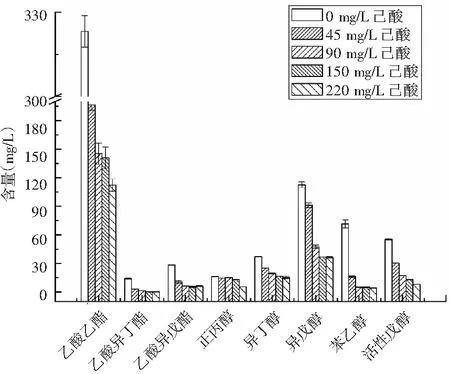
图3 不同己酸浓度下高产酯酿酒酵母主要风味物质含量Fig.3 Content of main flavor substances in Saccharomyces cerevisiae with high-yield ester under different concentration of caproic acid
由图3可知,培养基内的己酸浓度微量时(45 mg/L)对酿酒酵母酯醇代谢的影响很大,乙酸乙酯分别下降39.18%、55.1%、56.35%、65.32%。乙酸异丁酯在己酸浓度为45 mg/L时下降78.57%,己酸浓度为90 mg/L时,乙酸异丁酯含量下降91.32%,在己酸浓度为150,220 mg/L时没有检测到乙酸异丁酯。乙酸异戊酯含量也随着培养基内己酸浓度的升高而降低,分别下降64.28%、78.05%、80.79%、82.14%。正丙醇含量在己酸浓度为220 mg/L时变化最大,下降了65.85%,在其他己酸浓度下正丙醇分别下降10.24%、7.07%、18.55%。异丁醇在培养基己酸浓度为45,90,150,220 mg/L时分别下降32.43%、48.64%、56.76%、58.13%。异戊醇在培养基己酸浓度为45,90,150,220 mg/L时分别下降18.75%、58.03%、67.85%、67.55%。随着培养基内己酸浓度的增加,苯乙醇的含量下降最为明显,在己酸浓度为45 mg/L时,苯乙醇已经下降了77.46%,在培养基己酸浓度为90,150,220 mg/L时分别下降92.95%、92.97%、94.36%。活性戊醇在培养基己酸浓度为45,90,150,220 mg/L时分别下降27.27%、69.09%、76.36%、85.47%。
2.3 己酸菌代谢产物对高产酯酿酒酵母转录组的影响
选取己酸浓度为220 mg/L为实验组(编号Cap),不添加己酸浓度的为对照组(编号MY-15)。对数期取样送达诺禾致源生物有限公司进行转录组测序。
火山图可直观展示每个比较组合的差异基因分布情况,见图4。图4中横坐标表示基因在处理和对照两组中的表达倍数变化(log2 Fold Change),纵坐标表示基因在处理和对照两组中表达差异的显著性水平。右侧1.301域值线表示上调基因数,左侧1.301域值线表示下调基因数,域值线以下表示没有明显变化的基因数。
由图4可知,在培养基内含有己酸菌代谢产物时(己酸浓度为220 mg/L),高产酯酿酒酵母共有1032个基因上调,有1037个基因下调。
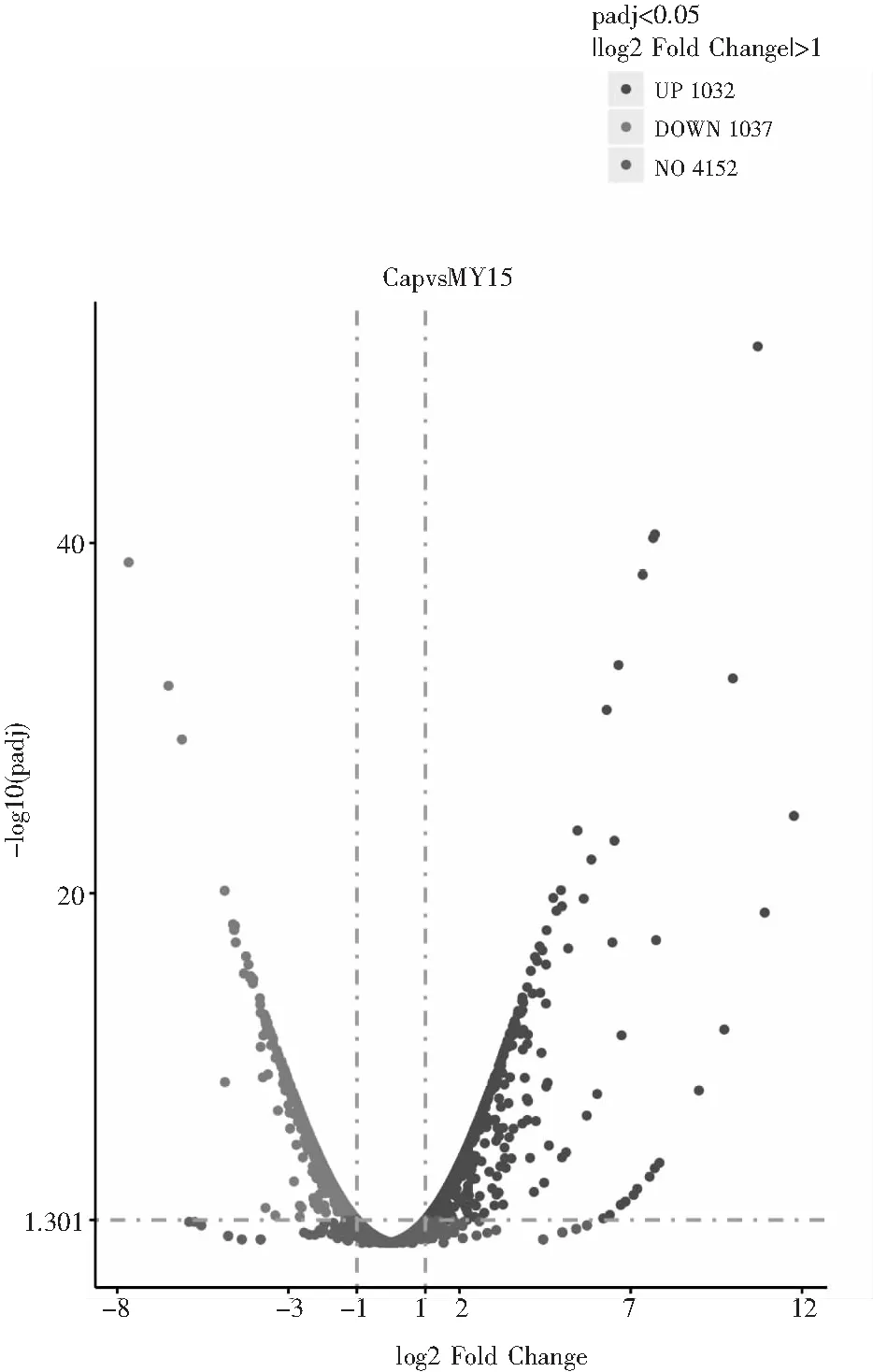
图4 差异基因火山图Fig.4 Differential gene volcano map
GO(Gene Ontology,基因本体)是描述基因功能的综合性数据库,主要是利用基因的本质功能对基因进行分类,从而限定和描述基因和蛋白质的功能。GO数据库把基因的本体分为3种:生物过程(Biological Process,BP)、细胞组成(Cellular Component,CC)和分子功能(Molecular Function,MF)。从GO富集分析结果中,选取最显著的30个Term绘制柱状图进行展示,若不足30个,则绘制所有Term,见图5。图5中横坐标为GO Term,纵坐标为GO Term富集的显著性水平,数值越高越显著,从左到右分别代表BP、CC、MF 3个GO子类。
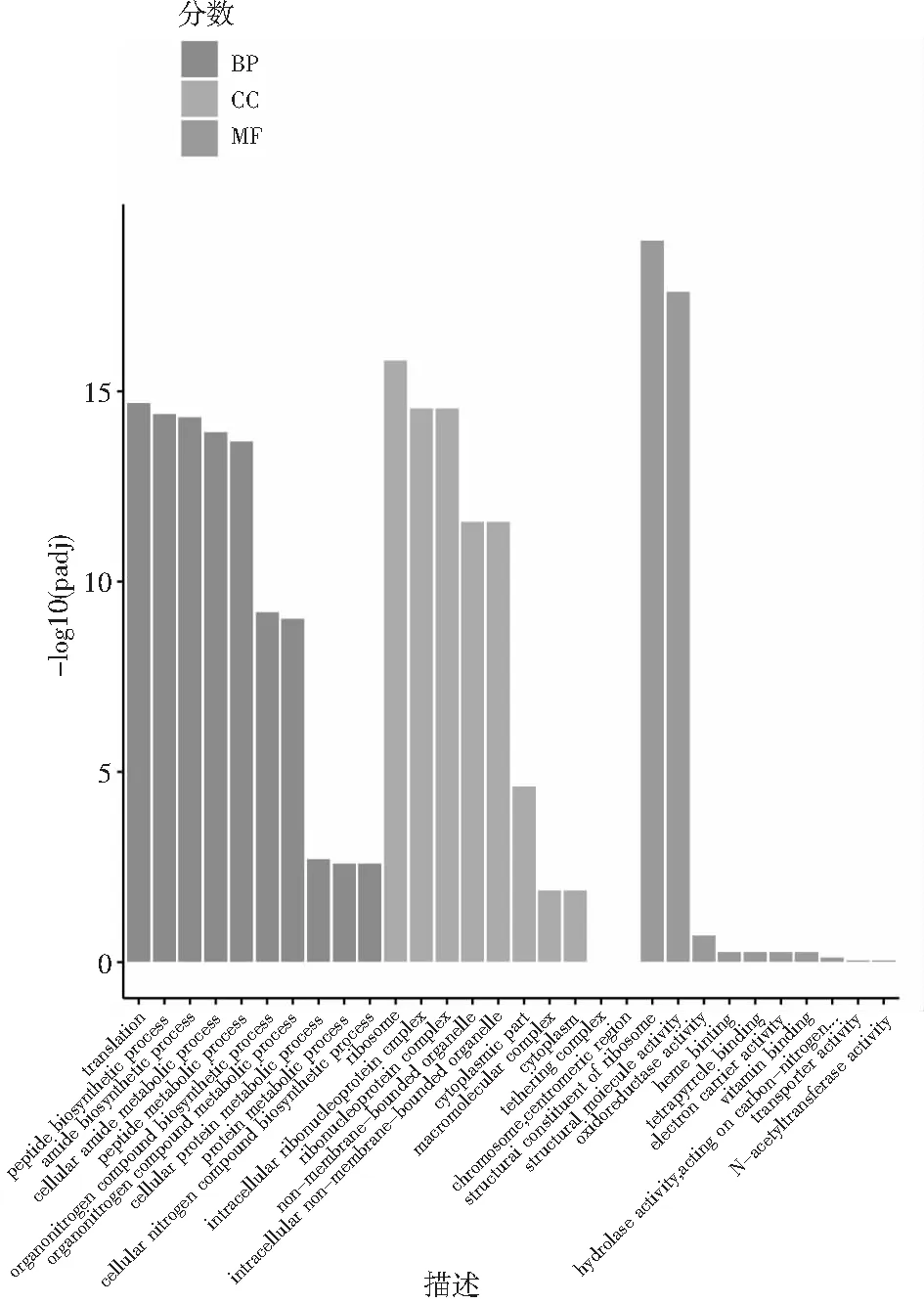
图5 GO富集分析柱状图Fig.5 GO enrichment analysis histogram
由图5可知,添加己酸菌代谢产物后,主要影响了翻译、肽生物合成过程、酰胺生物合成过程、细胞酰胺代谢过程、肽代谢过程、有机氮化合物生物合成工艺、有机氮化合物代谢过程、细胞蛋白质代谢过程、蛋白质代谢过程、细胞复合氮生物合成过程、细胞大分子生物合成过程等生物过程;主要影响了核糖体、细胞内核糖核蛋白复合物、核糖核蛋白复合物、无膜细胞器、细胞内无膜细胞器、细胞质部分、高分子络合物、细胞质的细胞组成等;主要影响了核糖体的结构组成、结构分子活性等分子功能。
KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因与基因组百科全书),是一个整合了基因组、化学和系统功能信息的数据库。从KEGG富集结果中,选取最显著的20个KEGG通路绘制散点图进行展示,见图6。图6中横坐标为注释到KEGG通路上的差异基因数与差异基因总数的比值,纵坐标为KEGG通路,点的大小代表注释到KEGG通路上的基因数。
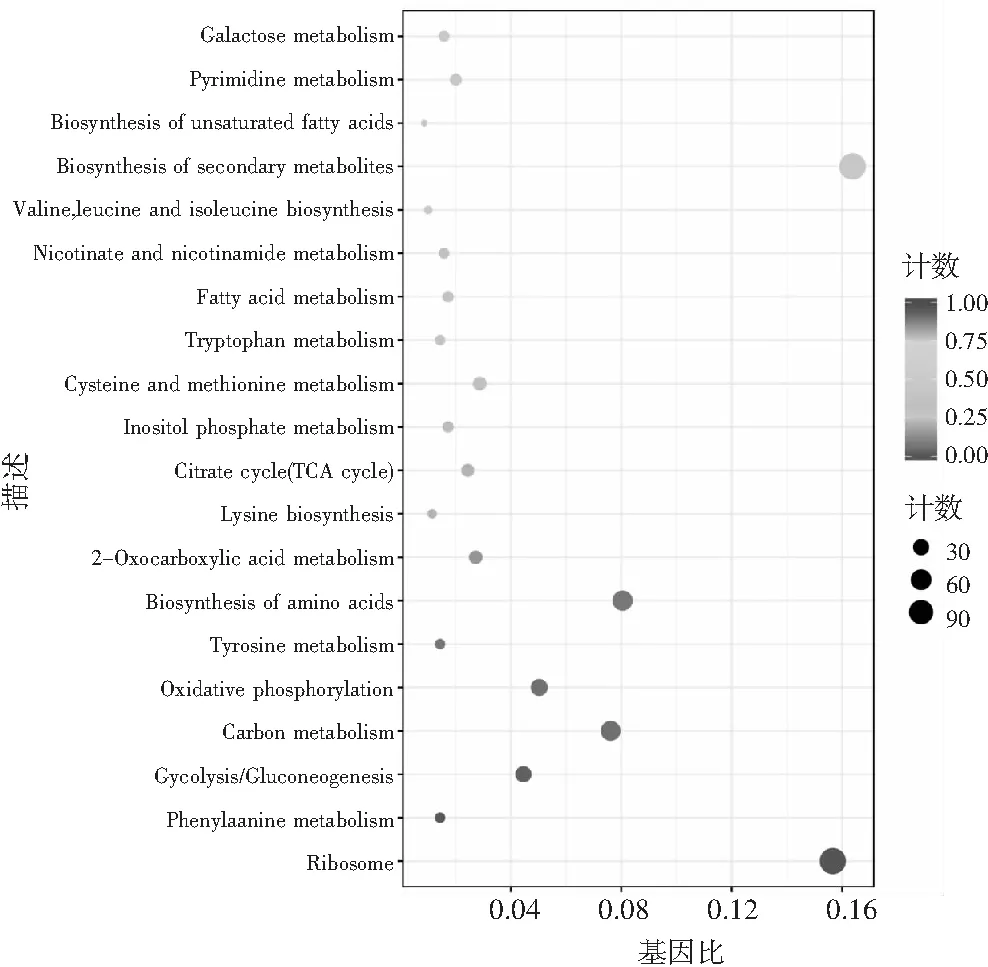
图6 KEGG富集散点图Fig.6 KEGG enrichment scatter plot
由图6可知,添加己酸菌发酵液至培养基中己酸浓度为220 mg/L时,与不添加己酸菌发酵液相比,高产酯酿酒酵母的核糖体、苯丙氨酸代谢、糖酵解、碳代谢、氧化磷酸化、酪氨酸代谢、氨基酸的生物合成、2-氧羧酸代谢过程受到显著影响。
3 结论
己酸菌菌悬液对高产酯酿酒酵母的生长、酒精发酵及酯醇代谢没有直接影响,但是己酸菌的代谢产物对高产酯酿酒酵母的影响显著,少量己酸浓度(90~220 mg/L)能促进高产酯酿酒酵母的生长及酒精发酵,酒精产量最多提高了6.63%,但是在己酸浓度为45~220 mg/L时,高产酯酿酒酵母的乙酸酯和主要高级醇的代谢被显著抑制,且随着己酸浓度的提高,抑制作用越来越强烈。
将己酸浓度为220 mg/L的高产酯酿酒酵母与不添加己酸的高产酯酿酒酵母进行转录组测序表明,高产酯酿酒酵母共有1032个基因上调,有1037个基因下调,主要涉及到高产酯酿酒酵母的氮代谢、糖酵解、苯丙氨酸代谢、碳代谢等生物过程。
