厚味γ-Glu-Ile肽的谷氨酰胺酶酶法合成
2020-05-29梁天一曾晓房董浩白卫东杨娟
梁天一,曾晓房,董浩,白卫东,杨娟*
(1.仲恺农业工程学院 轻工食品学院,广州 510225;2.哈尔滨商业大学 食品工程学院,哈尔滨 150028)
厚味(thick taste)指的是食物中的厚味物质和基本的味道物质之间的相互作用,使食物中盐的味道、鲜味和甜味等基本的味觉感受更加明显,并且使食物本身具有厚实、持久、饱满、鲜明的综合味道,常用mouthfulness,long-lastingness,complexity等表达[1]。目前为止,能引起食物厚味风味的这类γ-谷氨酰肽主要有γ-Glu-Leu、γ-Glu-Ile、γ-Glu-Glu、γ-Glu-Met等[2]。研究表明,γ-谷氨酰肽的合成通常是γ-谷氨酰二肽的配位,并且是最常见的酶进入方法。 与γ-谷氨酰胺转肽酶(GGT,EC 2.3.2.2)和谷氨酰胺酶(EC 3.5.1.2)显著相关[3-7]。GGT酶和谷氨酰胺酶用于合成γ-谷氨酰肽的最佳转肽温度均为37 ℃,最佳pH值在9~10.5之间,以谷氨酰胺为γ-谷氨酰的供体,氨基酸作为γ-谷氨酰的受体,其中苦味氨基酸通过催化转化为γ-谷氨酰化形式后,其苦味消失、厚味生成。几乎所有的GGT酶均可以用于合成γ-谷氨酰肽,包括γ-Glu-Val、γ-Glu-Leu和γ-Glu-Glu等已被成功合成。只有部分谷氨酰胺酶的微生物来源可用于捕获γ-谷氨酰肽合成,如米曲霉源谷氨酰胺酶、硝基还原假单胞源谷氨酰胺酶和解淀粉芽孢杆菌源谷氨酰胺酶等,包括γ-Glu-Gln、γ-Glu-Glu、γ-Glu-Val、γ-Glu-Gly等γ-谷氨酰二肽的合成。几乎所有苦味氨基酸均通过GGT酶或者谷氨酰胺酶催化转化为γ-谷氨酰二肽,而尚未见异亮氨酸通过γ-谷氨酰基化合成γ-Glu-Ile的反应。所以,本研究试图用一株商用的解淀粉芽孢杆菌源谷氨酰胺酶进一步催化异亮氨酸转化为厚味γ-Glu-Ile。
1 材料与方法
1.1 材料和仪器
1.1.1 材料与试剂
谷氨酰胺酶:日本天野酶制品株式会社;缬氨酸、苯丙氨酸、酪氨酸、色氨酸、甲硫氨酸:购于精科试剂公司;γ-Glu-Ile:购于上海雅心生物技术有限公司;乙腈、纯甲醇:购于天津市百世化工有限公司;商用的鸡肉汤粉、各种调味品、感官标准品(食品级):购于佛山市海天调味食品股份有限公司。
1.1.2 主要仪器设备
SHZ-88水浴恒温振荡器 江苏省金坛市国旺仪器厂;MF1204C型电子天平 上海欧莱博实验室器材供应商;PHS-3E pH计 杭州美尼特仪器自动化仪表有限公司;LGJ-12立式真空冷冻干燥机 北京松源华兴生物技术股份有限公司;AVANCE III HD 600超导核磁共振波谱仪 德国Bruker 公司;岛津LC 20-A型高效液相色谱仪 杭州瑞析科技有限公司;Biochrom 30+ 全自动氨基酸分析仪 大昌洋行(上海)有限公司;岛津LC10ATVP高效液相色谱仪 岛津公司。
1.2 实验方法
1.2.1 解淀粉芽孢杆菌源谷氨酰胺酶酶法合成γ-Glu-Ile
考虑将GGT酶作为合成γ-谷氨酰肽底物参数的催化剂:将200 mmol/L谷氨酰胺(供体氨基酸)与100 mmol/L异亮氨酸混合,调节pH至10.0,加入0.05 U/mL谷氨酰胺酶作为反应的起始点。 反应在友联 HH-4恒温水浴中于37 ℃进行4 h,然后将酶用沸水浴在100 ℃下悬浮20 min灭活。采用LGJ-12立式真空冷冻干燥机对反应液进行冷冻干燥,备用。酶法合成γ-Glu-Ile的方法优化:变化底物浓度比、pH值和温度等条件,获得最佳的γ-Glu-Ile酶促反应条件。
1.2.2 酶促反应液中氨基酸含量的测定
使用Biochrom 30+自动氨基酸分析仪测定每种酶促反应溶液中游离氨基酸的含量。 将适当的样品体积溶解在超纯水中,搅拌并均匀混合,使氨基酸在室温下静置30 min,然后置于50 mL容量瓶中; 定容后取4 mL样品,取样品∶磺基水杨酸(15%)为 4∶1加入磺基水杨酸,混合均匀,并在4 ℃冷藏60 min;将溶液在4 ℃下以1000 r/min离心15 min,然后将上清液进行再次离心,将上清液通过0.22 μm过滤器过滤并在氨基酸分析仪上检测。
1.2.3 HPLC法定性定量检测产物
参考Suzuki等人的方法,采用岛津LC10ATVP高效液相色谱仪对可在每个反应中合成的γ-谷氨酰肽进行进一步实验。通过XSelect HSS T3 柱(5 μm, 4.6 mm×250 mm,Waters,USA)分离γ-谷氨酰肽。标准方法是0.1%甲酸-乙腈(A)和0.1%甲酸-水溶液(B)。洗脱梯度,操作参数为90% B+10% A,然后以85% B+15% A,再次洗脱5 min,如果20% B+80% A,在5 min之后,回到90% B+10% A并将此等级设定为25 min;日立L-7100紫外扫描仪(Hitachi,Tokyo,Japan)用于检测。在220 nm处,将柱温设定为40 ℃以将进样量体积增加至10 μL。扩增的γ-谷氨酰肽片段,使用LGJ-12冷冻干燥反应序列以检测同一性。
1.2.4 NMR鉴定γ-Glu-Ile结构
参考Suzuki等人的方法,采用布鲁克AVANCE III HD 600型超导核磁共振波谱仪对γ-谷氨酰肽进行进一步的结构鉴定。将5 mg冻干样(高效液相色谱分离后馏分中的目标γ-谷氨酰肽)溶入适量的重水里,之后送入超导核磁共振波谱仪进行氢谱鉴定。利用MestReNova 9.0 Reader 核磁共振分析专用软件对图谱进行分析。
1.2.5 γ-Glu-Ile改善和增强常见食品的呈味效果
将一定浓度的γ-Glu-Ile溶液分别添加到适度稀释的商用鸡汤、牛肉汤或者酱油中。通过五分评分制评价γ-Glu-Ile对这3种食物的鲜味、厚味、酸味和甜味的增加效果。在专业敏感评估小组中,选出了15名经过专业培训的感官评估人员(8男7女,年龄在23~35岁之间,其中7人的感官评估经验超过2年)。对于味道评估,感官评估室的温度固定在(23±2) ℃。每个评估员品尝10 mL的样品,将样品放入口中25 s,然后慢慢吞咽。评估样品后,评估员应用纯水冲洗口腔,然后品尝下一个样品,记录每个样品的原始味道分数。
采用滋味稀释分析法和三选一实验(three-alternative forced-choice)对γ-Glu-Ile在鸡汤、牛肉汤和酱油中的厚味阈值进行评价。
2 结果与分析
2.1 γ-Glu-Ile的定性定量检测
采用岛津LC 20-A型高效液相色谱仪对反应液进行分离鉴定,结果见图1。
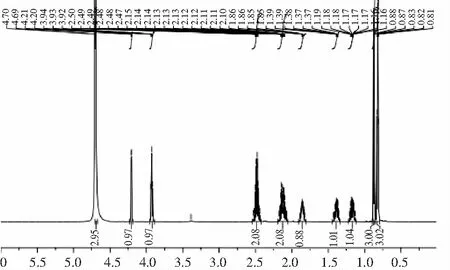
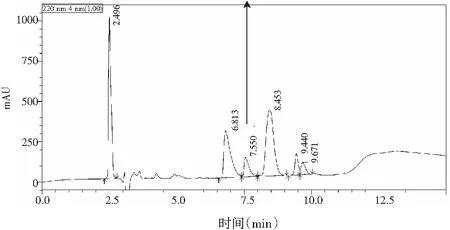
图1 反应混合物的HPLC色谱图,插入目标产物的NMR光谱Fig.1 HPLC chromatogram of the reaction mixture, inserted NMR spectrum of the target product
注:在pH 7.5和37 ℃的条件下用100 mmol/L Ile,200 mmol/L Gln和0.05 U/mL谷氨酰胺酶进行反应。
由图1可知,酶促反应液中目标组分均在10 min内得到良好分离。其中,目标产物γ-Glu-Ile的出峰时间为7.550 min,分辨率均大于2.0,分离度大于99.7%。由结果得出解淀粉芽孢杆菌源谷氨酰胺酶可以催化γ-谷氨酰二肽的合成,与米曲霉源谷氨酰胺酶催化γ-谷氨酰二肽合成的转化率接近。通过外标法对各产物进行了定量分析,各个标准品的回收率在96%~105%之间,精密度测定的结果显示低于1%,说明此方法可用于γ-谷氨酰二肽的定量分析。
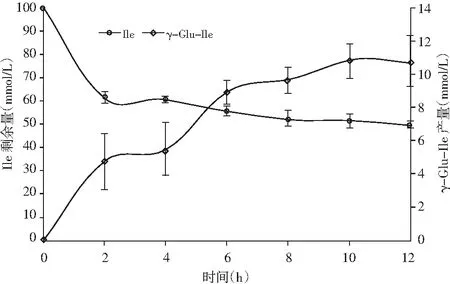
图2 谷氨酰胺酶催化的γ-Glu-Ile合成Fig.2 The synthesis of γ-Gln-Ile catalyzed by glutaminase
注:将含有200 mmol/L Gln和100 mmol/L Ile(pH 10.0)和谷氨酰胺酶(0.05 U/mL)的反应混合物在37 ℃下孵育12 h。 通过HPLC测定反应混合物中γ-Glu-Ile和Ile的量随时间的变化。
由图2可知,在反应的前10 h内,γ-Glu-Ile的产量随着反应时间的延长而不断增加,而后随着反应时间延长,产率基本不变,最大产量为10.79 mmol/L。底物(异亮氨酸)的含量随着反应时间延长而减少,到反应结束,异亮氨酸残余量为49.43 mmol/L。底物残余量与产物产量间存在极大差异,暗示有副产物的产生。GGT酶在催化γ-谷氨酰二肽合成的过程中,类似γ-Glu-γ-Glu-Tau或聚谷氨酸等物质通常被定义为副产物检出[8]。谷氨酰胺酶在催化底物氨基酸转化为γ-谷氨酰二肽的过程中也有γ-[Glu]n-AA的产生[9]。
对目标产物(γ-Glu-Ile)冻干样进行超导核磁共振波谱仪分析,结果见图1。(1H NMR (600 MHz, D2O) ):δ 4.21 (d, J = 5.9 Hz, 1H, α-CH Ile),3.93 (t, J=6.5 Hz, 1H, α-CH Glu),2.54~2.42 (m,2H,γ-CH2Glu), 2.19~2.06 (m, 2H, β-CH2Glu),1.91~1.81 (m,1H,β-CH Ile),1.44~1.34 (m, 1H),1.22~1.12 (m,1H),0.87 (d, J =6.9Hz,3H),0.82 (t, J=7.4 Hz, 3H)。以上数据中γ-谷氨酰二肽的核磁数据与Suzuki团队利用GGT酶合成的γ-谷氨酰二肽结构一致。
2.2 γ-Glu-Ile产量的优化
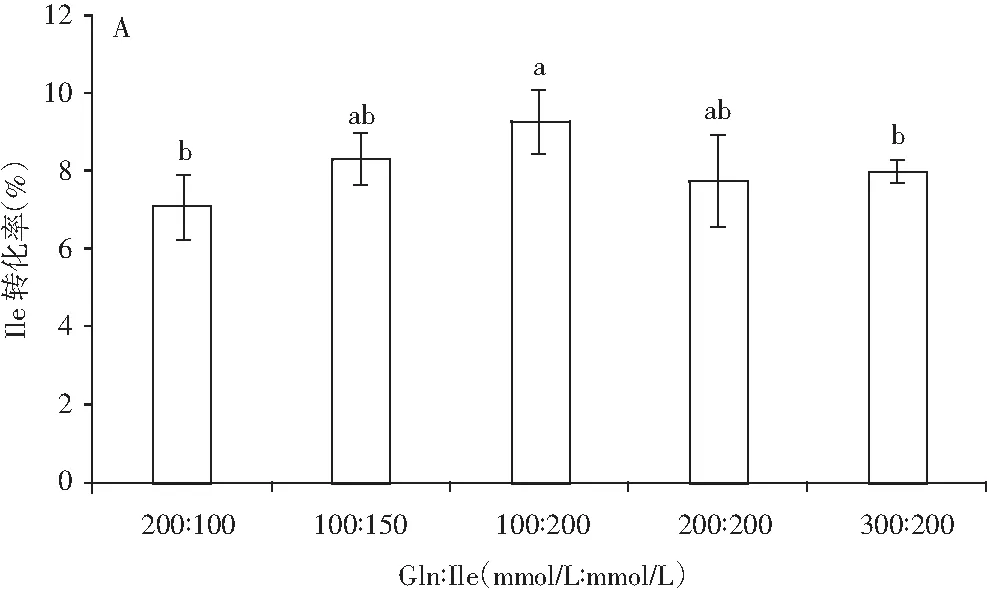
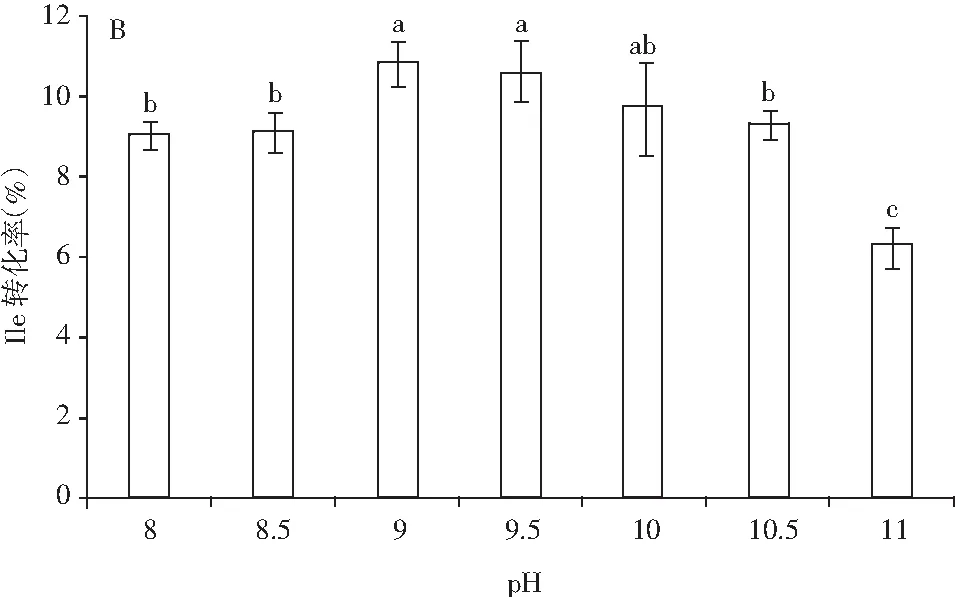
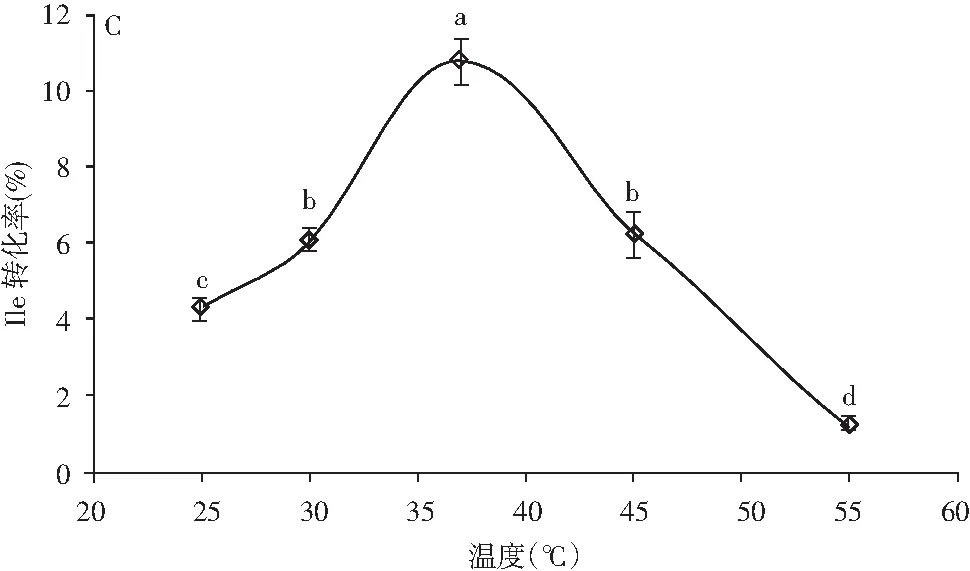
图3 底物浓度(A)、pH值(B)和温度(C) 对γ-Glu-Ile合成的影响Fig.3 The effect of substrate concentration (A), pH value (B) and temperature (C) on γ-Glu-Ile synthesis
注:A表示Gln∶Ile,0.05 U/mL谷氨酰胺酶在pH 9.5和37 ℃下反应10 h。B表示Gln∶Ile 为100∶200(mmol/L∶mmol/L),0.05 U/mL谷氨酰胺酶,pH 9.5,10 h;C表示Gln∶Ile为100∶200(mmol/L∶mmol/L),0.05 U/mL谷氨酰胺酶,pH 9.5,10 h。
由图3中A可知,Gln与Ile的摩尔浓度比对γ-Glu-Ile的产量具有一定的影响,根据Suzuki等人的试验,设定Gln和Ile的浓度比为:200∶100、100∶150、100∶200、200∶200、300∶200 (mmol/L∶mmol/L)。由图3中A可知,随着异亮氨酸含量的增加,γ-Glu-Ile产量增加,而γ-Glu-Ile的含量不随谷氨酰胺酶含量的变化而变化,说明受体氨基酸的变动对γ-Glu-Ile的产生具有一定的决定作用。最佳的Gln∶Ile为100∶200(mmol/L∶mmol/L),γ-Glu-Ile的最大产量为18.57 mmol/L,此结果与米曲霉源谷氨酰胺酶催化合成γ-谷氨酰二肽的结果接近。由图3中B可知,γ-Glu-Ile的产生表现出pH 8~11范围内的依赖性,最适pH值在9~10之间,高于或低于此区间均不利于γ-Glu-Ile的产生,γ-Glu-Ile的产量为21.58 mmol/L。 由图3中C可知,温度对酶活的影响导致其催化γ-Glu-Ile产生量的差异,由结果可知,此酶催化γ-Glu-Ile合成的最适温度为37 ℃,最高产量为21.58 mmol/L。综上可知,此解淀粉芽孢杆菌源谷氨酰胺酶催化γ-Glu-Ile合成的最适底物浓度比为Gln∶Ile为100∶200(mmol/L∶mmol/L),最适pH值在9~10之间,最适温度为37 ℃,反应时间为10 h,最大产量为21.58 mmol/L。
2.3 γ-Glu-Ile对食物的增味效果
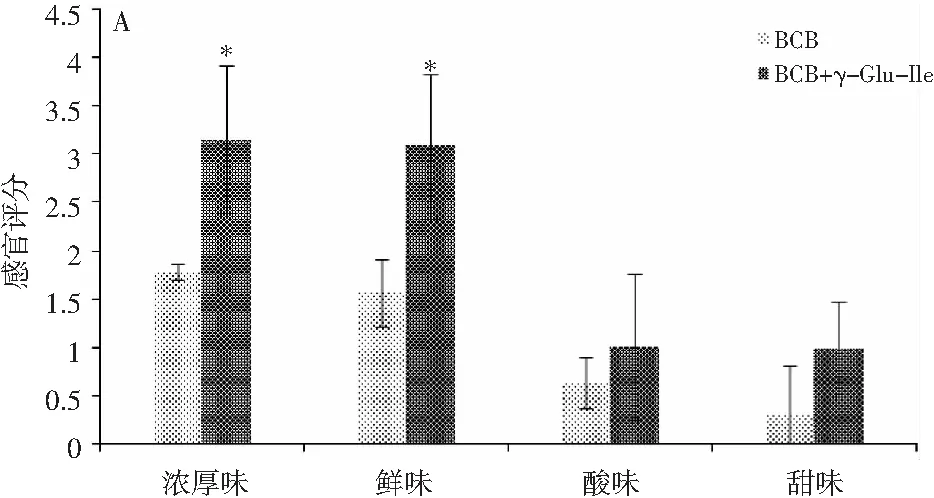
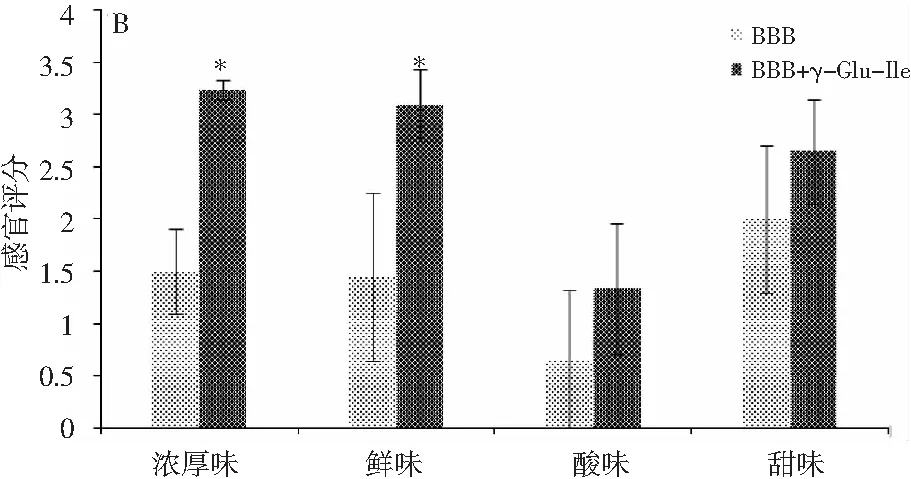
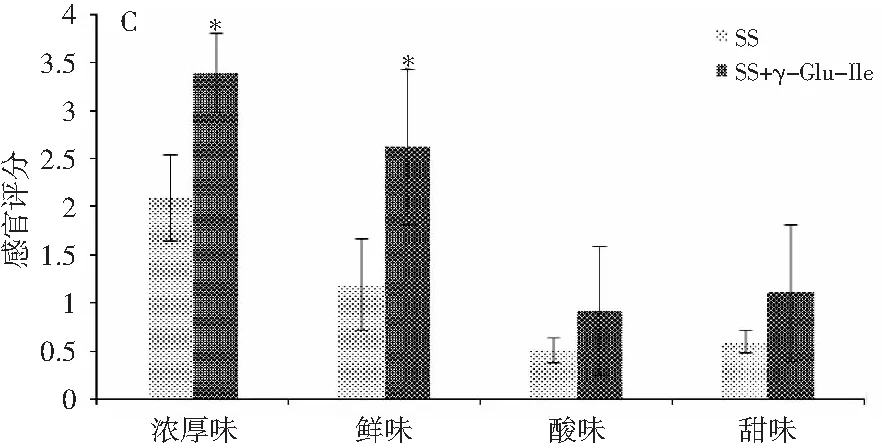
图4 γ-Glu-Ile对A空白鸡肉汤(BCB)、B空白 牛肉汤(BBB)和C酱油(SS)的影响Fig.4 The effect of γ-Glu-Ile on A blank chicken broth (BCB), B blank beef broth (BBB) and C soy sauce (SS)

表1 γ-谷氨酰肽的Kokumi阈值浓度Table 1 Kokumi threshold concentration of γ-glutamyl peptides
γ-Glu-Ile已被报道具有厚味,在发酵面团和酱油中均有发现[10,11]。众所周知,将厚味γ-谷氨酰肽添加到食物中,可以增加食物的鲜、甜、咸等基本味和浓厚味[12,13]. 因此,本文试图将厚味γ-Glu-Ile添加到鸡汤、牛肉汤等物质中,用以评价γ-Glu-Ile对这些食物滋味的改善效果,以判断γ-Glu-Ile是否可以被用作食品添加剂。由图4可知,将适量γ-Glu-Ile添加到鸡汤、牛肉汤或者酱油中,评价鸡汤、牛肉汤和酱油的鲜味、厚味、酸味和甜味的改变情况,得出γ-Glu-Ile可以增加鸡汤、牛肉汤和酱油的鲜味、厚味、酸味和甜味(p<0.05),此结果说明厚味γ-Glu-Ile可以作为呈味添加剂用于增加鸡汤、牛肉汤和酱油等食物的味感。事实上,类似的厚味γ-谷氨酰肽,如γ-Glu-Gly、γ-Glu-Glu、γ-Glu-Gln、γ-Glu-His、γ-Glu-Val、γ-Glu-Leu、γ-Glu-Met、γ-Glu-Val-Gly和γ-Glu-Cys-β-Ala能够增加鸡汤和牛肉汤的鲜味和浓厚味[14,15]。此外,采用滋味稀释分析法和三选一实验(three-alternative forced-choice)对γ-Glu-Ile在鸡汤、牛肉汤和酱油中的厚味阈值进行评价,见表1。γ-Glu-Ile在鸡汤、牛肉汤和酱油中的厚味阈值分别为(0.62±0.20),(0.83±0.37),(0.91±0.29)mmol/L,结果与γ-Glu-Val、γ-Glu-Phe、γ-Glu-Met等厚味阈值接近。
3 结论
解淀粉芽孢杆菌源谷氨酰胺酶可催化γ-Glu-Ile的合成,其最佳反应条件为:最适底物浓度比Gln∶Ile为100∶200(mmol/L∶mmol/L),最适pH值在9~10之间,最适温度为37 ℃,反应时间为10 h,最大产量为21.58 mmol/L。γ-Glu-Ile可以增加鸡汤、牛肉汤和酱油的鲜味、厚味、酸味和甜味,且γ-Glu-Ile在鸡汤、牛肉汤和酱油中的厚味阈值分别为(0.62±0.20),(0.83±0.37),(0.91±0.29) mmol/L。
