多酚氧化酶的固定化及其酶学性质研究
2020-05-29刘苑皓赵兴秀舒梨何义国
刘苑皓,赵兴秀,舒梨,何义国
(四川轻化工大学 生物工程学院,四川 宜宾 644000)
多酚氧化酶(polyphenol oxidase,PPO)是一种化学性质稳定并广泛存在于植物、菌类、昆虫及哺乳动物体内的氧化还原酶[1]。在有氧条件下,单酚类化合物羟基化反应生成儿茶酚,儿茶酚脱氢反应后与O2结合形成醌并自发发生非酶反应在水中聚合,最终形成水不溶性聚合物而被除去[2]。游离酶在水溶液中有稳定性差、易流失、不可回收等缺点,导致处理成本过高,限制了其实际应用[3]。同时,100余种真菌产多酚氧化酶统计结果表明,绝大部分酶作用的最适pH在3.0~5.0之间[4],而工业染料废水一般呈现高温、高pH和高盐等特点[5]。酶在此条件下容易因剧烈的外部环境导致活性部位结构失活变性,无法起到催化作用。固定化酶(immobilized enzyme)是指利用物理或者化学手段固定在载体上或者束缚在一定区域内保持催化活性并能连续反应和反复使用的酶制剂[6]。固定化酶的优点主要是热稳定性好,在碱性条件下具有较好的稳定性和贮存稳定性且能够实现多次重复利用等[7]。
在实际应用中,Yagüe 等研究了PPO降解高单宁含量的啤酒工业废水的能力,热解气相质谱分析显示多酚热解产物(主要是苯酚和邻甲基苯酚)都有所降低[8]。但未经过固定化的酶存在稳定性差、易流失、不能重复利用等缺点,导致处理成本过高。油橄榄压榨废水(OMW)是生产橄榄油工业中特有的副产物,Alessandro采用固定化PPO处理OMW,可以脱除多酚聚合物,如儿茶酚和二羟基苯乙烯酸的脱除率分别达到了95%和 99%,还能促进 OMW流体的部分脱色及降低污水毒性[9]。同时固定化提高了酶的稳定性,使酶多次重复利用,降低了处理成本[10]。
以海藻酸钠包埋法(polyphenol oxidase immobilized by sodium alginate,A-PPO)和戊二醛交联法(polyphenol oxidase immobilized by glutaraldehyde crosslinking, C-PPO)两种固定化方法制备固定化多酚氧化酶。海藻酸钠包埋法中将戊二醛的使用次序提前到酶液与海藻酸钠混合振荡过程中,使多酚氧化酶与戊二醛之间能够形成化学键稳定结合,以期能有更好的固定化效果。戊二醛交联法中,采用成本低廉的戊二醛作为交联剂,使戊二醛与酶和载体之间都能够形成稳定的化学键来提高固定化效果。试验考察了固定化酶的最佳制备条件及其酶学性质,比较了固定化方法对固定化酶性质的影响,为利用固定化酶处理食品工业废水提供了一定的理论数据参考。
1 材料与仪器
多酚氧化酶(polyphenol oxidase,PPO)、海藻酸钠(sodium alginate,SA)、壳聚糖(chitosan,CTS ):购于Bomei(USA)公司;钠基蒙脱土(montmorillonite,MMT): 购于浙江三鼎科技有限公司;戊二醛(50%):分析纯,购于南京化学试剂股份有限公司;其他试剂:均为分析纯。
TG-16型医用离心机 四川蜀科仪器有限公司;201-3AB型电热恒温干燥箱 天津市泰斯特仪器有限公司;HH-6B型数显恒温水浴锅 常州普天仪器制造有限公司;SHZ-A型水浴恒温振荡器 上海贺德实验设备厂;V-1000型可见分光光度计 翱艺仪器(上海)有限公司。
2 试验方法
2.1 游离酶酶活测定
将多酚氧化酶母液(1 mg/mL)稀释至10 mg/L,取1 mL 10 mg/L多酚氧化酶液加入到12 mL邻苯二酚溶液(10 mmol/L)中,在25 ℃条件下反应5 min,在410 nm波长下测定其吸光度,以1 mL pH 6.8磷酸缓冲盐溶液(phosphate buffered saline,PBS)作空白对照。在410 nm吸光度下每毫升样品每分钟变化0.001为一个酶活单位U[11]。固定酶活以每组最高吸光度为100%酶活,其余值与最高值的百分比为相对酶活。
2.2 海藻酸钠包埋法
将一定量海藻酸钠与pH 6.8 PBS混合,60 ℃加热溶化,冷却至室温后备用;将10 mg/L多酚氧化酶液与海藻酸钠按照体积比1∶1混合振荡,添加少量戊二醛(体积分数4%),常温振荡40 min。用注射器吸取上述混合液,匀速滴入氯化钙溶液中,形成海藻酸钠凝胶珠;更换氯化钙溶液,将凝胶珠置于氯化钙溶液中4 ℃环境下硬化2 h,滤出凝胶珠,蒸馏水洗涤数次,4 ℃贮存备用[12]。
2.2.1 单因素试验
2.2.1.1 海藻酸钠浓度对A-PPO酶活力的影响
设置海藻酸钠的浓度分别为1.5%、2.0%、2.5%、3.0%,CaCl2溶液浓度为2%(V/V),制备A-PPO,测定酶活。
2.2.1.2 CaCl2浓度对A-PPO酶活力的影响
设置CaCl2的浓度分别为1.5%、2.0%、2.5%、3.0%,海藻酸钠溶液浓度为2%,制备A-PPO,测定酶活。
2.2.1.3 硬化固定时间对A-PPO酶活力的影响
设置固定化时间分别为1,2,3,4 h。海藻酸钠溶液浓度为2%,CaCl2溶液浓度为2%,制备A-PPO,测定酶活。
2.2.2 正交试验
根据2.2.1单因素试验结果,得到正交试验因素水平,见表1。

表1 A-PPO正交试验因素水平表Table 1 Orthogonal experimental factors and levels of A-PPO
按照正交表设计标准制定L9(33)正交试验方案,参考其结果进一步完善A-PPO的制备方案。
2.3 戊二醛交联法
2.3.1 蒙脱土/壳聚糖插层复合物的制备
称取3.3 g壳聚糖置于250 mL乙酸溶液(体积分数1%)中,室温搅拌,缓慢加入NaOH溶液(质量分数20%),用pH计检测调节pH到4.9。称取4.0 g蒙脱土于100 mL蒸馏水中搅拌溶胀2 h,再将其在恒温水浴锅中预热至60 ℃,待预热完成后将壳聚糖缓慢滴入蒙脱土悬液中搅拌,静置6 h,5000 r/min离心8 min,倾倒废液后将产物用蒸馏水洗涤至上清液呈中性并于60 ℃烘干,在研钵中将壳聚糖/蒙脱土插层复合材料研磨至200目,在干燥皿中保存备用[13]。
2.3.2 戊二醛交联多酚氧化酶
将0.02 g CTS/MMT插层复合物加入到10 mL 1.0%戊二醛溶液中,30 ℃振荡交联2 h,交联完成后用蒸馏水洗涤抽滤,用PBS(0.05 mol/L,pH 7.0)反复洗涤至上清液中无戊二醛残留,再次抽滤,于60 ℃干燥后备用。取2 mL多酚氧化酶酶液(0.1 mg/mL,pH 4.0)加入CTS/MMT插层复合物中,室温下振荡固定6.5 h。固定化完成后以8000 r/min离心10 min,抽滤,用PBS(0.05 mol/L,pH 7.0)反复洗涤,离心抽滤,直至上清液中检测不到PPO,常温干燥过夜,制成C-PPO[14]。
2.3.3 壳聚糖/蒙脱土插层复合物表征分析
制备得到的壳聚糖/蒙脱土插层复合物需要进行表征分析,用以确定插层的效果以及确定其能否作为固定化酶的载体使用。
2.3.3.1 X-射线衍射(X-RD)分析
X射线衍射(X-RD)图谱采用Cukα辐射源,管电压40 kV,管电流500 mA,扫描范围3°~40°[15]。
2.3.3.2 红外光谱法
红外光谱法采用Nicolet-iNIO+iZIO FTIR显微红外光谱仪记录,KBr压片法,扫描范围4000~500 cm-l。
2.3.4 单因素优化
2.3.4.1 戊二醛浓度对C-PPO酶活力的影响
取5份CTS/MMT插层复合物各0.0133 g,将CTS/MMT插层复合物与浓度分别为0.50%、0.75%、1.00%、1.25%、1.50%的戊二醛溶液混合,30 ℃振荡交联2 h,余下操作同2.3.2。分别取5份 1 mL 0.1 mg/mL PPO酶液(pH 4.0)加入CTS/MMT插层复合物,常温振荡固定6 h制备不同戊二醛浓度的C-PPO。
2.3.4.2 振荡固定pH对C-PPO酶活力的影响
取5份pH分别为3.0,4.0,5.0,6.0,7.0 (0.1 mg/mL)PPO酶液到5份质量为0.0133 g搅拌交联干燥的CTS/MMT插层复合物中(操作同2.3.2),制成不同振荡固定pH的C-PPO。
2.3.4.3 酶与载体质量比对C-PPO酶活力的影响
取5份1 mL(0.1 mg/mL)PPO酶液(pH 4.0)加入5份质量分别为0.0154,0.0143,0.0133,0.0125,0.0118 g 搅拌交联干燥的CTS/MMT插层复合物中(操作同2.3.2),制成不同酶与载体质量比的C-PPO。
2.3.4.4 固定化反应时间对C-PPO酶活力的影响
取5份1 mL(0.1 mg/mL)PPO酶液(pH 4.0)加入到搅拌交联干燥的C-PPO中,常温振荡固定时间分别为3,4,5,6,7 h,制备不同固定化时间的C-PPO。
2.3.5 正交试验
根据2.3.4单因素试验结果,得到正交试验因素水平,见表2。

表2 C-PPO正交试验因素水平表Table 2 Orthogonal experimental factors and levels of C-PPO
按照正交表设计标准制定L9(33)正交试验方案,参考其结果进一步完善C-PPO的制备方案。
2.4 游离及固定化酶酶学性质探究
酶学性质的探究是关于游离多酚氧化酶和两种不同方法固定化多酚氧化酶关于pH稳定性、热稳定性、贮藏稳定性和固定化酶重复使用率的探究,以及总蛋白含量和米氏常数的测定[16],在测定游离酶及固定化酶酶活力过程中所涉及的反应温度、pH参考文献[17,18]。
2.4.1 游离及固定化酶的单因素优化
2.4.1.1 pH稳定性
分别取0.005 g C-PPO固体、游离PPO 1 mL(0.1 mg/mL)、A-PPO 1 mL各5份分别置于pH值为4.0,5.0,6.0,7.0,8.0的缓冲溶液中2 h,固定化酶用pH 6.8的PBS洗涤至中性,抽滤常温干燥,测定酶活。
2.4.1.2 热稳定性
取0.005 g C-PPO固体、游离PPO 1 mL(0.1 mg/mL)、A-PPO 1 mL各5份分别置于20,30,40,50 ℃ 4个环境温度下2 h,冷却至室温,测定酶活。
2.4.1.3 贮藏稳定性
将同批次制备的C-PPO固体0.005 g、游离PPO 1 mL(0.1 mg/mL)、A-PPO 1 mL各5份于4 ℃避光保存,分别在0,5,10,15,20,25 d测定酶活。
2.4.1.4 重复使用率测定
取0.005 g C-PPO固体、A-PPO 1 mL测定酶活,测定后用pH 6.8 的PBS洗涤抽滤,再次测定,反复操作,至测得相对酶活低于50%停止。
2.4.2 固定化率测定
配制考马斯亮蓝溶液及1 mg/mL牛血清蛋白,制作标准曲线[19]。分别取C-PPO固体0.005 g、游离PPO 1 mL(0.1 mg/mL)、A-PPO 1 mL测定A595 nm处的吸光度值,参照标准曲线方程计算各样品的蛋白质浓度(mg/mL)。
2.4.3 米氏常数测定
配制浓度为5,10,15,20,25 mmol/L的邻苯二酚溶液,取0.005 g C-PPO固体、游离PPO 1 mL(0.1 mg/mL)、A-PPO 1 mL各5份,参照2.3.2、2.2、2.1中测定酶活操作添加试剂,每分钟测定一次吸光度,每组测定5次,对5次测定值作散点图,以趋势线斜率为反应速度,分别以[1/V]为横坐标、[1/S]为纵坐标作图,得到Lineweaver-Burk方程,直线横截距为-1/Km,纵截距为1/Vmax[20]。
2.5 数据处理
试验操作重复3次,每个样品设3个平行,采用Origin 8.5软件进行数据分析。
3 结果与分析
3.1 海藻酸钠包埋法结果
3.1.1 CaCl2浓度对A-PPO酶活力的影响

图1 CaCl2浓度对A-PPO酶活力的影响Fig.1 Effect of CaCl2 concentration on A-PPO enzymatic activity
由图1可知,在制备过程中发现,当CaCl2浓度为1.5%时,制备的凝胶珠成型效果较差,导致测定酶活时易破裂。在CaCl2浓度达到3%时,凝胶珠外部的CaCl2易溶解在水相中,A-PPO在CaCl2浓度为1.5%和3%时相对酶活数值较高,实质上是因为CaCl2释放溶解在水相中,导致测定值偏高,不具有参考性。只有当CaCl2浓度为2.5%左右时,形成的凝胶珠形状固定保存时间较长,相对酶活较高。
3.1.2 海藻酸钠浓度对A-PPO酶活力的影响
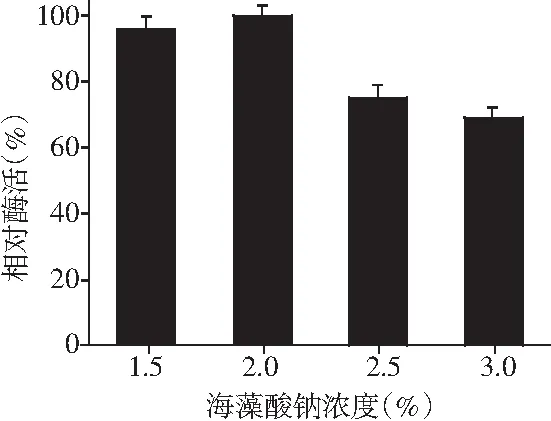
图2 海藻酸钠浓度对A-PPO酶活力的影响Fig.2 Effect of sodium alginate concentration on A-PPO enzymatic activity
由图 2可知,在制备过程中发现,当海藻酸钠浓度大于2.5%时,凝胶珠粘度过大,导致凝胶珠成型缓慢且形状不规则。而当海藻酸钠浓度在1.5%左右时,虽然凝胶珠成型较快且形状规则,但是交联后的成珠效果不好,多数凝胶珠有破裂现象,这是因为海藻酸钠浓度过低,导致凝胶珠粘度低,物理强度小,无法有效形成稳定的结构。海藻酸钠浓度在2.0%时,A-PPO的相对酶活较高且凝胶珠成型速度适中、形状规则、结构稳定,能够有效包埋多酚氧化酶。
3.1.3 固定化时间对A-PPO酶活力的影响

图3 固定化时间对A-PPO酶活力的影响Fig.3 Effect of immobilization time on A-PPO enzymatic activity
由图 3可知,固定化3 h的A-PPO相对酶活比固定化2 h的降低30%。低温环境有利于CaCl2硬化,但是固定化时间越长,凝胶珠硬化效果越好,可能会导致固定化酶的空间位阻越大,酶与底物的接触减少,酶活降低,另一个原因可能是固定化时间过长导致酶的部分结构改变,活性降低。因此,选择固定化2 h继续后续试验。
3.1.4 正交分析

表3 海藻酸钠包埋法正交试验结果表Table 3 The results of orthogonal experiment for sodium alginate embedding method

续 表
由表 3可知,最佳试验组合为试验号6,因素条件为2.0% CaCl2、2.5%海藻酸钠、固定化时间2 h。参照方差分析中的极差顺序排列可知各单因素对A-PPO酶活力大小影响的顺序为CaCl2浓度>固定化时间>海藻酸钠浓度,各单因素的最优值分别为2.5% CaCl2、2.5%海藻酸钠、固定化时间2 h。最终确定最优组合为2.5% CaCl2、2.5%海藻酸钠和固定化时间2 h。
3.2 戊二醛交联法
3.2.1 壳聚糖/蒙脱土插层复合物表征分析

图4 CTS/MMT(a)、蒙脱土(MMT)(b)、 壳聚糖(CTS)(c)X-RD图谱Fig.4 X-RD chromatograms of CTS/MMT(a), montmorillonite (MMT)(b) and chitosan(CTS)(c)
由图4可知,壳聚糖/蒙脱土复合插层物在2θ=5.62°出现特征衍射峰,蒙脱土在2θ=5.66°出现特征峰值,由Bragg方程(2dsinq=l,d表示硅酸盐片层间的平均距离,l表示入射X射线的波长,l=0.15416 nm)得出壳聚糖/蒙脱土复合插层物和蒙脱土的层间距分别为1.57 nm和1.55 nm,蒙脱土层间距增加,说明形成了插层结构。

图5 CTS/MMT(b)、蒙脱土(MMT)(a)、 壳聚糖(CTS)(c)红外光谱图Fig.5 IR spectra of CTS/MMT(b),montrnorillonite (MMT)(a)and chitosan(CTS)(c)
由图 5可知,蒙脱土在3619 cm-1处出现O-H的伸缩振动吸收峰,在3429 cm-1处出现吸收峰是由于层内和层内氢键的伸缩振动;在1637 cm-1处出现H-O-H的伸缩振动吸收峰;在1034 cm-1处出现Si-O伸缩振动吸收峰;在916 cm-1和623 cm-1处吸收峰为Al-OH的伸缩振动。在壳聚糖图谱中,由于O-H和N-H伸缩带的重叠在3436 cm-1处出现吸收峰。在2921 cm-1处的吸收峰为非芳香族的C-H的伸缩振动,在1605 cm-1吸收峰为N-H的弯曲,在1383 cm-1吸收峰为C-H的弯曲,在1151 cm-1和1087 cm-1为C-O的伸缩振动。在蒙脱土/壳聚糖插层复合物红外光谱中保留了部分壳聚糖和蒙脱土的伸缩振动吸收峰,在3622 cm-1和3430 cm-1处存在O-H的伸缩振动吸收峰,在2922 cm-1处吸收峰为链状烃基C-H变形振动,同时,由于壳聚糖的N-H弯曲振动与蒙脱土的H-O-H伸缩振动是壳聚糖/蒙脱土插层复合物波峰向低峰处移动,在1517 cm-1处出现吸收峰,结果表明壳聚糖与蒙脱土片层间发生了插层,形成了插层复合物。因此,该壳聚糖/蒙脱土插层复合物可以用于多酚氧化酶的固定。
3.2.2 戊二醛浓度对C-PPO酶活力的影响

图6 戊二醛浓度对C-PPO酶活力的影响Fig.6 Effect of glutaraldehyde concentration on C-PPO enzymatic activity
由图 6可知,在戊二醛浓度低于1.25%时,C-PPO的相对酶活随着戊二醛浓度的增大而上升;在戊二醛浓度达到1.25%时,相对酶活达到最大;在戊二醛浓度大于1.25%之后,C-PPO酶活力开始下降,这是因为戊二醛本身醛基具有较大的范德华力,与壳聚糖形成共价键的游离醛基可与酶上的-OH、-NH3等基团共价结合形成共价键,导致酶蛋白所含有的有效基团被占用无法与底物有效结合,催化底物的氧化变化,导致C-PPO的酶活力降低。当戊二醛浓度在1.00%~1.50%时,C-PPO的相对酶活相差较小,因此设计正交试验时将戊二醛浓度因素设置3个水平梯度1.00%、1.25%、1.50%。
3.2.3 pH值对C-PPO酶活力的影响

图7 固定化pH对C-PPO酶活力的影响Fig.7 Effect of immobilization pH on C-PPO enzymatic activity
由图 7可知,在多酚氧化酶固定化过程中,C-PPO的酶活力受到固定化pH的影响较大。在固定化pH低于4.0时C-PPO的相对酶活仅为14%左右,这是因为过酸环境中大量的H+与酶和CTS/MMT插层复合物中的-OH结合,占用载体中的基团,同时,过酸环境对酶本身的结构和CTS/MMT插层复合物内部结构及其与戊二醛的交联共价键造成破坏,降低了酶的催化能力和CTS/MMT插层复合物对酶蛋白的固定能力。在固定化pH大于4.0之后,C-PPO的相对酶活一直呈现下降趋势,这是由于多酚氧化酶本身适用于偏酸环境反应,随着pH增大,固定化环境中的OH-增多,破坏酶蛋白本身的结构并且作为抑制剂使酶出现钝化现象。由于pH对酶蛋白的结构和活性影响较大,且对CTS/MMT插层复合物的结构有影响,因此在设计正交试验时应使pH值之间的梯度尽可能小,因此设计固定化pH值为3.5,4.0,4.5。
3.2.4 酶与载体质量比对C-PPO酶活力的影响
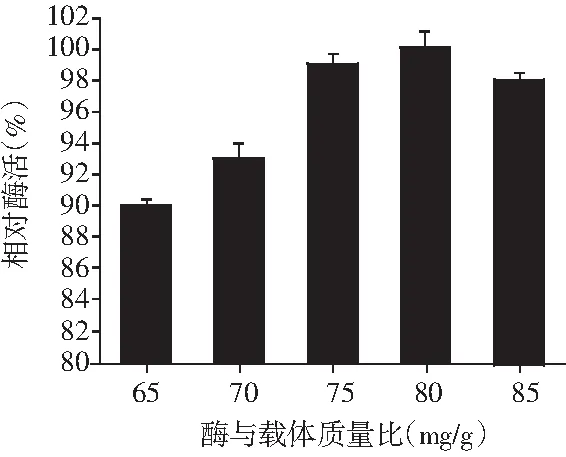
图8 酶与载体质量比对C-PPO酶活力的影响Fig.8 Effect of the mass ratio of enzyme to carrier on C-PPO enzymatic activity
由图8可知,C-PPO的酶活力受酶与载体质量比的影响不是很大,在酶与载体质量比低于80(mg/g),C-PPO的相对酶活随着酶与载体质量比的增大而缓慢上升,这是因为多酚氧化酶的量尚未达到CTS/MMT插层复合物对酶蛋白固定的饱和值,因此随着酶量的增大,C-PPO的相对酶活梯次上升。当酶与载体质量比大于80 (mg/g)之后,C-PPO的相对酶活反而呈现下降趋势,这是因为质量一定的CTS/MMT插层复合物上酶的结合固定位点的数目一定,当酶与载体质量比大于80 (mg/g)之后,这些结合位点出现过饱和现象,同一个载体位点因为有过多的酶蛋白存在而减少了酶与底物接触的表面积,酶的催化作用受到抑制,因而出现了酶量增加相对酶活反而降低的现象。由于测定酶与载体质量比对C-PPO酶活力的影响试验中各组相对酶活始终保持在90%以上,其对C-PPO酶活力的影响较小,因此设计正交试验方案时设定酶与载体质量比的3个水平为75,80,85(mg/g)。
3.2.5 固定化反应时间对C-PPO酶活力的影响

图9 固定化反应时间对C-PPO酶活力的影响Fig.9 Effect of immobilization time on C-PPO enzymatic activity
由图9可知,在固定化反应时间小于6.0 h时,C-PPO的酶活力随着固定化反应时间的增大而逐渐上升,这是因为固定化反应过程中的交联键固定反应尚未完成,随着固定化反应间的增大,酶的固定量逐渐上升并趋于饱和,使C-PPO的相对酶活逐渐上升。当固定化反应时间大于6.0 h之后,C-PPO的相对酶活开始略有下降,这可能是因为固定化反应时间过长,持续的振荡使部分固定不牢的酶蛋白掉落,C-PPO的酶含量低于饱和酶量。固定化反应时间在6.0~7.0 h时,C-PPO的相对酶活始终保持在90%以上,可见固定化反应时间在6.0~7.0 h时对C-PPO酶活力的影响基本一致,因此设计正交试验时固定化反应时间的3个水平分别设为6.0,6.5,7.0 h。
3.2.6 正交试验分析

表4 戊二醛交联法正交试验结果表Table 4 The results of orthogonal experiment for glutaraldehyde crosslinking method
由表 4可知,最优水平组合为试验号6,其因素组合为1.25%戊二醛、振荡固定pH 4.5、酶与载体质量比75(mg/g)、固定化反应时间6.5 h。参照方差分析中极差顺序可知,4个单因素对C-PPO酶活力影响的主次顺序依次为振荡固定pH>振荡固定时间>戊二醛浓度>酶与载体质量比。各单因素的最优值分别为1.25%戊二醛、振荡固定pH 4.5、酶与载体质量比80 (mg/g)、固定化反应时间6.5 h。依次参考直观分析和因素指标,确定四因素三水平正交试验最优组合为1.25%戊二醛、振荡固定pH 4.5、酶与载体质量比75(mg/g)、固定化反应时间6.5 h。
3.3 酶学性质的探究
3.3.1 pH稳定性

图10 游离及固定化酶pH稳定性探究Fig.10 Study on pH stability of free enzyme and immobilized enzymes
由图10可知,游离酶与两种固定化酶的pH稳定性差距较大,游离酶在环境pH为5.0~7.0之间始终保持90%以上的相对酶活,说明多酚氧化酶本身的结构性质都比较稳定,且最适的保存环境应是中性及弱酸性环境,这也解释了自然界中多酚氧化酶的来源遍及各种植物、哺乳动物、昆虫和真菌。海藻酸钠包埋法制备的A-PPO仅在环境pH为6.0~8.0时能够保持60%以上的相对酶活,与游离酶相比,其pH稳定性反而降低。海藻酸钠中含有大量的-COO-结构,酸性条件下转化为-COOH,抑制酶蛋白的活性,由此可见海藻酸钠包埋法制备固定化酶对酶的pH稳定性有抑制作用。戊二醛交联法制备的C-PPO在环境pH为4.0~8.0时均可保持50%以上的相对酶活,可见C-PPO的pH稳定性相比游离酶已经大幅提高,这是因为戊二醛中的醛基对H+和OH-有一定的中和能力,同时也因为CTS/MMT插层复合物与酶蛋白的结合减少了外界离子的进入,维持了微环境pH的相对稳定。
3.3.2 热稳定性
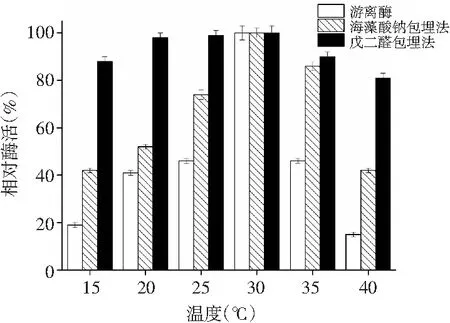
图11 游离酶及固定化酶热稳定性探究Fig.11 Study on thermostability of free enzyme and immobilized enzymes
由图 11可知,将游离及固定化酶分别在15~40 ℃的6个梯度温度下保存2 h,测定酶活。游离酶仅在25~35 ℃时可以保持较高活性,当温度低于25 ℃或者高于35 ℃时酶活性大幅下降,这是由于低温抑制其基团活性,而高温则破坏蛋白质结构,使酶失活。海藻酸钠包埋法制备的A-PPO在15~40 ℃均保持40%以上的相对酶活,可见固定化酶由于酶与载体之间的结合能够有效提高其热稳定性,有利于酶在较高温度的环境下依旧保持其酶活力。戊二醛交联法制备的C-PPO在15~40 ℃均能保持80%以上的相对酶活,可见此法固定多酚氧化酶对酶的热稳定性提高作用远大于海藻酸钠包埋法。海藻酸钠制备的凝胶珠中水是热的良导体,无法将内部环境与外界热源隔离开,而C-PPO由于酶的基团与CTS/MMT插层复合物之间的共价结合,有效提高了酶对环境温度变化的适应能力,提高了其热稳定性。
3.3.3 贮存稳定性
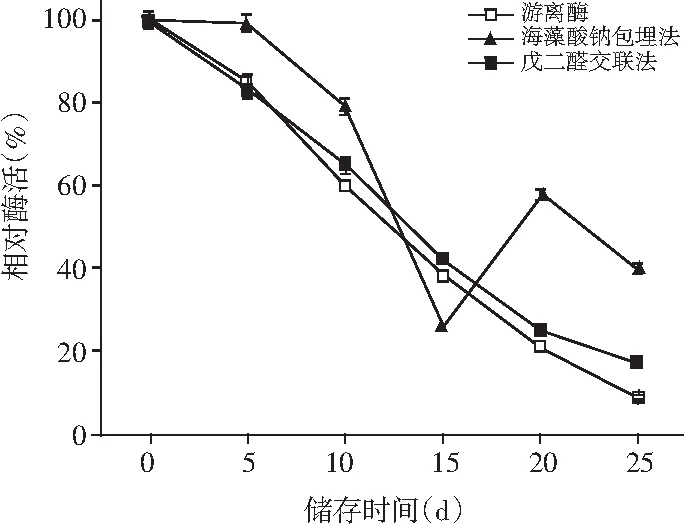
图12 游离酶及固定化酶贮存稳定性探究Fig.12 Study on storage stability of free enzyme and immobilized enzymes
由图 12可知,游离酶与C-PPO的贮存稳定性基本一致,在-4 ℃保存15 d时依旧能够保持40%以上的相对酶活。A-PPO约在12 d时能够保持40%以上的酶活力,在15 d之后反而出现上升趋势,实际上是因为海藻酸钠凝胶珠外面的CaCl2溶解,导致在A410 nm处测定吸光度时由于邻苯二酚溶液浑浊测定值较真实值偏大。综合来看,A-PPO在0~12 d时间内的贮藏稳定性优于游离酶和C-PPO,但是在12 d之后因为CaCl2溶解凝胶珠破裂释放多酚氧化酶等原因使其贮藏稳定性快速下降,导致相对酶活迅速降低,这表明短期贮存12 d海藻酸钠包埋法固定酶的贮存稳定性更好,时间延长则戊二醛交联法固定酶的贮存稳定性更好。总的来讲,固定化酶本身已经消耗大部分酶活力,短期贮存导致其相对酶活的持续降低将会大大增加在工业领域投入应用的难度。
3.3.4 重复使用次数测定

图13 固定化酶重复使用次数的测定Fig.13 Determination of reuse times of immobilized enzymes
由图13可知,固定化酶确实可以多次使用,但是不同固定化方法导致其使用次数不尽相同。海藻酸钠包埋法制备的A-PPO在第2次使用时其相对酶活已降低到50%以下,可见其重复利用的效率并不高,主要是因为海藻酸钠形成的凝胶珠并不具备较高的物理强度,使用1次之后便会破裂,导致内部固定的酶流失。由此可见,海藻酸钠包埋法由于载体本身的物理强度过低,不适合作为固定化酶的主要材料。
戊二醛交联法制备的C-PPO在第4次使用时依旧保持50%以上的相对酶活,可见其固定化效果较好,重复使用率也相对较高,这得益于CTS/MMT插层复合物本身的物理强度较高,戊二醛的交联作用有效固定酶蛋白,使C-PPO能够达到固定化以提高其使用次数。
3.3.5 固定化率测定
以标准牛血清蛋白浓度为横坐标,相应吸光值为纵坐标,测得考马斯亮蓝G250标准曲线回归方程y=8.6429x+0.0649(R2=0.9901)。通过回归方程计算游离酶及固定化酶的总蛋白含量,见表5。

表5 游离及固定化酶总蛋白量Table 5 Total protein content of free and immobilized enzymes
A-PPO比活力为游离酶的一半左右,这是由于被包埋法固定住的酶与底物的接触面积减少,戊二醛与酶的部分基团之间形成化学键,降低了酶活性。C-PPO比活力为游离酶的43%,一方面是由于多酚氧化酶被固定于插层物的微小空间中,与底物的接触面积减小;另一方面是因为戊二醛占用了部分活性基团。A-PPO与C-PPO的总酶活都仅有游离酶的1/10左右,一方面是因为固定化酶量少于游离酶;另一方面是由于上述两种原因对酶活性的限制。
海藻酸钠包埋法的酶活回收率为18.6%,戊二醛交联法的酶活回收率为24.0%,可见戊二醛交联固定酶的能力较好。海藻酸钠包埋法是通过海藻酸钠形成凝胶珠时将液相中的多酚氧化酶固定,其固定酶量取决于酶溶液的浓度,而戊二醛交联法是通过戊二醛分别与酶和载体之间形成的化学键将多酚氧化酶固定在壳聚糖与蒙脱土插层形成的微小空间内,此法固定酶量取决于壳聚糖与蒙脱土的插层效果。测定固定化酶量在制备A-PPO和C-PPO时酶液的浓度和用量都保持一致,可见通过形成化学键能够更好地固定酶。
3.3.6 米氏常数测定

图14 游离及固定化酶Lineweaver-burk图Fig.14 Lineweaver-burk figure of free and immobilized enzymes
由图 14可知,以游离及固定化酶米氏常数测定所作Lineweaver-burk图中的公式计算截距,再由截距计算Vmax和Km值,得到表 6。

表6 试验结果表Table 6 The result of experiment
游离PPO的Km值小于两种固定化酶,说明固定化酶与底物的亲和力均小于游离酶。这是因为多酚氧化酶固定化后,酶分子的空间结构受到限制,活性部位无法完全与底物接触。同时,载体的空间结构造成的空间障碍和底物的扩散限制也使酶与底物的亲和力降低。比较两种不同方法的固定化酶可知,A-PPO的Km与C-PPO相近,表明两种固定酶与底物亲和力相近。游离PPO的Vmax值远大于固定化酶,酶的固定化使其邻域的底物浓度与游离酶也明显不同,且固定化酶催化反应体系中扩散限制的存在,使得固定化酶的Vmax值均低于游离酶。同时,C-PPO的Vmax值高于A-PPO,表明包埋法固定多酚氧化酶载体上酶分子的自由度小于C-PPO,催化速率相对较低。
4 结论
采用海藻酸钠包埋和戊二醛交联两种方法固定多酚氧化酶,确定其最优固定化条件,分别为海藻酸钠包埋法:2.5% CaCl2、2.5%海藻酸钠、固定化时间2 h;戊二醛交联法:1.25%戊二醛、振荡固定pH 4.5、酶与载体质量比75 (mg/g)、固定化反应时间6.5 h。同时对游离多酚氧化酶和固定化多酚氧化酶的酶学性质进行了研究。结果表明:游离酶、A-PPO和C-PPO的比活力分别为864,490,371 U/mg,A-PPO和C-PPO的酶活回收率分别为18.6%和24.0%。同时,固定化酶在pH稳定性、热稳定性上优于游离酶,戊二醛交联法固定酶的效果优于海藻酸钠包埋法。戊二醛交联法固定化酶的能力更强,但是比酶活要牺牲50%左右。海藻酸钠包埋法中凝胶珠的结构大大限制了酶与底物的接触,同时由于凝胶珠本身的物理强度过低,限制了其重复利用的可能。可见,海藻酸钠并不是酶固定化的良好载体。戊二醛作为交联剂可以通过形成化学键来达到固定酶的目的,却需要占用一定数量的活性基团,对酶活力有一定的限制。就试验的两种固定化酶方法,戊二醛是固定化酶过程中较好的交联剂。食品及调味品行业的种类繁多,生产工艺及所用原材料各不相同,因此食品工业废水成分复杂,差异性较大,导致酶的需求量较大,处理成本较高。酶的固定化使酶的稳定性增加,对环境耐受性增强,可回收重复利用,大大降低了工业废水处理的成本。
