RSV感染毛细支气管炎患儿外周血单核细胞miR-21和FOXP3的表达关系及意义
2020-05-28陈岩岩张娜陈烨孙文鑫
陈岩岩 张娜 陈烨 孙文鑫
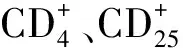
1 资料与方法
1.1 一般资料 选择2012年3月至2013年11月在上海交通大学医学院附属瑞金医院北院和广州医科大学附属第二医院儿科确诊为RSV 毛细支气管炎的患儿94例为病例组,经临床症状(出现持续性干咳和发热,体温以中、低度发热为常见,发作喘憋为其特点,病情以喘憋发生后2~3 d较严重,喘憋发作时呼吸明显增快,可达60~80次/min,并伴有呼气延长和呼气性喘鸣;重症患儿明显表现出鼻煸和“三凹征”(即吸气时出现锁骨上窝,胸骨上窝及上腹部凹陷),脸色苍白,口周发青(或出现紫绀),实验室检查(患儿血清特异性RSV抗体IgM阳性)确诊,符合《诸福棠实用儿科学(第7版)》毛细支气管炎诊断标准[11]。同期选择门诊健康体检患儿88例作为对照组,患儿无变应性疾病及其他慢性疾病史,家族内无过敏史及哮喘史,且2周内无呼吸道感染病史及服药史,无恶性肿瘤、6周内手术史、下肢外伤史、心功能不全、脑血管意外、长期卧床史。病例组收缩压、舒张压、性别比、年龄的水平与对照组比较,差异无统计学意义(P>0.05)。该研究的计划符合赫尔辛基文件,获医院伦理委员会的批准,签署的知情同意书来自所有自愿参加的患儿家属。见表1。
1.2 纳入与排除标准
1.2.1 纳入标准:①患儿血清RSV-IgM阳性;②未感染腺病毒、巨细胞病毒及肺炎支原体感染。

表1 2组基础资料比较
1.2.2 排除标准:①患儿有先天性心脏病、先天性肺发育不全、免疫缺陷、过敏性疾病等疾病史及长期用药史;②中枢或周围神经病变;③胆汁淤积、自身免疫性疾病;④肝酶升高者即肝脏疾病。
1.3 方法
1.3.1 CD44、Th17细胞水平检测:采用流式细胞仪检测。200 μl的抗凝血分别加入10 μl的抗CD44、Th17抗体(规格1 ml,批号:5632484、8546241,上海玉博生物科技有限公司),轻微混匀后,37℃避光静置30 min,加入PBS洗涤,离心弃上清,加入200 μl红细胞裂解液(规格 50 ml,货号:R1010,Solarbio),PBS洗涤2次,弃上清。流式细胞仪(型号:Attune NxT,美国热电)检测。
1.3.2 外周血单核细胞miR-21、FOXP3 mRNA水平检测:将5 ml静脉血吸入涂有EDTA的真空管中。 用磷酸盐缓冲盐水(PBS,pH值7.4)将血液稀释2倍。将4 ml稀释的血液分层到4 ml Ficoll-Hypaque Plus溶液(Amersham Pharmacia Biotech AB,Sweden)上,并在室温下以2 000 r/min离心20 min。从血浆-Ficoll界面移除外周血单核细胞并在PBS中洗涤3次以除去血小板,Ficoll-Hypaque和血浆。收集的外周血单核细胞在-80℃下冷冻保存,随后用于mRNA表达的定量。使用TRIzol试剂(Takara Bio,Shiga,Japan)根据制造商的说明从外周血单核细胞分离总RNA,并通过电泳评估RNA质量。使用Prime Scrip RT试剂盒(Takara Bio,Shiga,Japan)进行逆转录(RT)。每个cDNA扩增的RT条件是37℃15 min,85℃ 5 s和4℃ 15 s。使用SYBR green作为检测染料,通过定量PCR(qPCR)在StepOnePlusTM实时PCR系统(Applied Biosystems,Inc,Foster City,CA,USA)上进行基因表达分析。用于检测基因的引物序列被设计为:miR-21正向引物:5’-ATGACAGACCTCAGACAGA-3’;反向引物:5’-AATGTTGGCAGTGGCTCACG-3’;FOXP3正向引物:5’-ACCACAAGCATCCACCAA-3’;反向引物:5’-GCATTTATCCTTCCTCCCTA-3’;GAPDH用作对照管家基因,其正向为引物:5’-AGCCACCAGATCCGCGTGT-3’;反向引物:5’-TTGAAGTTCTGGATCAGGA-3’。循环条件为95℃ 30 s和95℃ 5 s,然后在64℃下进行40个循环34 s。通过用溴化乙锭染色的2%琼脂糖凝胶电泳确认PCR产物的预测大小。对与PCR直接相关的每个样品进行熔解曲线分析,以验证扩增的PCR产物的纯度。结果表示为每个靶基因的倍数表达与GAPDH作为内部对照的相比样品,使用2-ΔΔCt方法。所有样品一式两份进行。
1.3.3 酶联免疫吸附法检测血清白介素-4(IL-4)、白介素-8(IL-8)、白介素-10(IL-10)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、高敏C反应蛋白(hs-CRP)水平:分离血清,与酶标仪(Tecan Infinite Pro,瑞士帝肯)上检测血清IL-4、IL-8、IL-10、IFN-γ、TNF-α、hs-CRP(规格96孔,批号kit635487、kit149654、kit143256、kit654198、kit456298、kit659352,上海邦奕生物)水平。
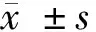
2 结果
2.1 2组MIR-21、FOXP3水平比较 病例组MIR-21、FOXP3水平高于对照组,差异有统计学意义(P<0.05)。见表2。
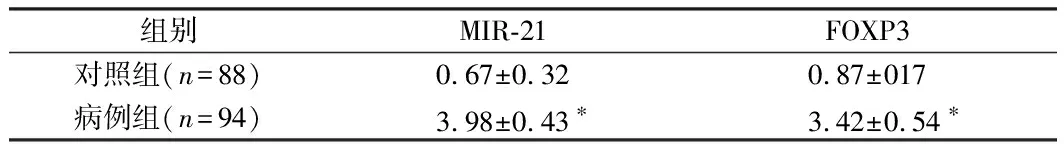
组别MIR-21FOXP3对照组(n=88)0.67±0.320.87±017病例组(n=94)3.98±0.43∗3.42±0.54∗
注:与对照组比较,*P<0.05
2.2 2组CD44、IL-4、IL-8、IL-10水平比较 病例组CD44、IL-4、IL-8、IL-10水平高于对照组,差异有统计学意义(P<0.05)。见表3。
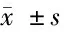

组别CD44(%)IL-4(pg/ml)IL-8(pg/ml)IL-10(pg/ml)对照组(n=88)82.57±3.868.54±4.325.43±2.345.49±0.92病例组(n=94)92.30±5.33∗17.56±3.54∗9.65±3.65∗10.23±2.23∗
注:与对照组比较,*P<0.05
2.3 2组IFN-γ、TNF-α、hs-CRP、TH17水平比较 病例组TNF-α、hs-CRP、TH17均高于对照组,IFN-γ低于对照组,差异有统计学意义(P<0.05)。见表4。
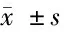

组别IFN-γ(pg/ml)TNF-α(pg/ml)hs-CRP(μmol/L)Th17(%)对照组(n=88)78.45±2.344.35±2.46328.16±10.152.65±0.54病例组(n=94)46.36±5.40∗39.32±5.90∗367.12±12.19∗3.93±0.78∗
注:与对照组比较,*P<0.05
2.4 MIR-21、FOXP3与各变量的相关性分析 MIR-21、FOXP3与CD44、IL-4、IL-8、IL-10、TNF-α、hs-CRP、TH17正相关关系明显,与IFN-γ负相关关系明显,差异有统计学意义(P<0.05)。见表5。
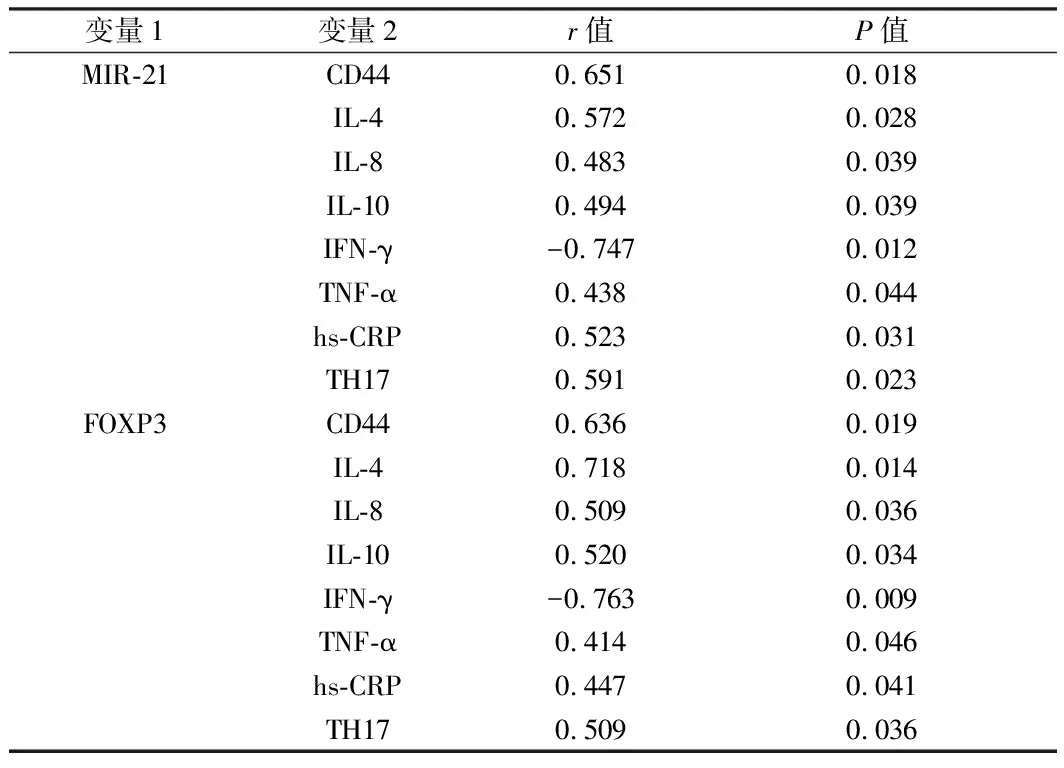
表5 MIR-21、FOXP3与各变量的相关性分析
2.5 RSV感染毛细支气管炎患儿发生小儿哮喘的多元Logistic回归分析 对RSV感染毛细支气管炎患儿进行5年随访,发生小儿哮喘17例。以RSV感染毛细支气管炎患儿是否发生小儿哮喘为应变量(是=1,否=0),单因素分析有意义的因素为自变量进行多因素logistic逐步回归分析,结果发现高水平的MIR-21、FOXP3、TH17均为RSV感染毛细支气管炎患儿发生小儿哮喘的危险因素(P<0.05)。见表6。
2.6 ROC曲线及灵敏度、特异度分析 受试者工作特征曲线提示,MIR-21+ FOXP3+ TH17、MIR-21、FOXP3 ROC曲线下面积(AUC)为0.832(95%CI 0.799~0.893)、0.801(95%CI 0.758~0.868)、0.793(95%CI 0.735~0.852);FOXP3、TH17两者的AUC相近,均小于MIR-21+ FOXP3+ TH17;TH17、MIR-21诊断RSV感染毛细支气管炎的灵敏度、特异度相近(χ2=1.219、1.695,P>0.05),均小于MIR-21+ FOXP3+ TH17(χ2=16.249、17.023,P<0.05)。见表7。
3 讨论
RSV是一种普遍存在的负义ssRNA病毒,可在感染后引起严重的肺病。 RSV是肺病毒属的副成员,副

表6 RSV感染毛细支气管炎患儿发生小儿哮喘的多元Logistic回归分析

表7 ROC曲线及灵敏度、特异度分析
粘病毒科具有非节段基因组,编码10个基因和11种蛋白质(NS1、NS2、N、P、M、SH、G、F、M2-1、M2-2和L)。RSV感染率很高,到2岁时,大多数幼儿至少经历过一次感染。高风险个体(如婴儿、幼儿、免疫功能低下的成人和老年人)的RSV感染可表现为严重的肺部炎症性疾病,包括细支气管炎和肺炎。还有大量证据表明,早期RSV感染可以介导气道重构,这是一种使个体易患哮喘发展和恶化的特征[12,13]。
RSV具有呼吸道上皮细胞的趋向性,因此人类Ⅱ型肺上皮细胞(A549)通常用于模拟宿主对RSV感染的反应。 RSV通过其两种主要表面蛋白附着于细胞,附着(G)和融合(F)蛋白,其与细胞糖胺聚糖结合。RSVF和G蛋白也与几种其他细胞成分结合,如CX3CR1分子,Toll样受体4(TLR4),细胞间粘附分子1和核仁蛋白[14]。miR-21在响应RSV感染的宿主基因的转录后调节中的作用尚不完全清楚。已知miR-21表达受多种过程调节,包括TLR4信号传导,IRF3活化,IFN刺激的基因转录物和病毒蛋白质如RSV G。 A549细胞的RSV感染促进miR-21的表达,主要由RSV G诱导。用纯化的A549细胞处理RSV G增强miR-21表达,这是RSV F治疗后未观察到的特征[15]。重要的是,用抑制剂调节miR-21影响RSV复制,表明RSV调节宿主miRNA表达以影响抗病毒宿主反应的结果,这在很大程度上由RSV G蛋白表达介导。近期研究表明,miR-21可调控转化生长因子(TGF)-b以及Kruppel样因子6(KLF6)的表达。(TGF)-b在肺上皮细胞的RSV感染期间高表达,且它在RSV引起哮喘中起重要作用,TGF-b还调节炎性细胞因子对RSV感染的反应和细胞周期停滞。 Kruppel样因子6(KLF6)是一种进化上保守且普遍表达的锌指蛋白,属于哺乳动物Sp1/KLF转录调节因子家族,是TGF-b所需的关键转录因子,RSV感染人肺上皮细胞时其基因高表达。FOXP3是RSV诱导表达的基因之一。研究表明,FOXP3可能是miR-21的靶基因,FOXP3可在RSV感染后通过miR-21增加的其激活[16]。Toll样受体(TLR)4是FOXP3调控的下游炎性因子,其受到RSV F蛋白的刺激。感染RSV的FOXP3沉默小鼠表现出TLR4水平降低,其整体免疫水平也被抑制。研究同时也发现,RSV感染的急性期诱导FOXP3高表达,而FOXP3可进一步促进IL-13、TGF-β和IL-6的表达,增加的IL-13产生刺激其受体IL-13RA1的表达,其进一步放大Th2应答,靶基因分析显示IL-13RA1是FOXP3的靶基因[17-19]。本研究结果发现,病例组MIR-21、FOXP3水平高于对照组,差异有统计学意义(P<0.05);病例组CD44、IL-4、IL-8、IL-10水平高于对照组,差异有统计学意义(P<0.05);MIR-21、FOXP3与CD44、IL-4、IL-8、IL-10、TNF-α、hs-CRP、TH17正相关关系明显,与IFN-γ负相关关系明显,差异有统计学意义(P<0.05)。这与上述讨论符合,同时也提示,RSV感染毛细支气管炎患儿外周血单核细胞miR-21、FOXP3水平高表达,其引发一系列炎性因子失衡可能是RSV感染毛细支气管炎的发病机制。
本研究同时发现,高水平的MIR-21、FOXP3、TH17均为RSV感染毛细支气管炎患儿发生小儿哮喘的危险因素;结合ROC曲线分析,MIR-21+ FOXP3+ TH17、MIR-21、FOXP3 ROC曲线下面积(AUC)为0.832 95%CI(0.799~0.893)、0.801(95%CI 0.758~0.868)、0.793(95%CI 0.735~0.852);FOXP3、TH17两者的AUC相近,均小于MIR-21+ FOXP3+ TH17;TH17、MIR-21诊断RSV感染毛细支气管炎的灵敏度、特异度相近,均小于MIR-21+ FOXP3+ TH17。这说明MIR-21+ FOXP3+ TH17诊断RSV感染毛细支气管炎具有较高的灵敏度、特异度。
综上所述,RSV感染毛细支气管炎患儿外周血单核细胞miR-21、FOXP3水平高表达,引发一系列炎性因子失衡可能是RSV感染毛细支气管炎的发病机制;MIR-21+ FOXP3+ TH17诊断RSV感染毛细支气管炎具有较高的灵敏度、特异度,值得推广应用。
