miR-130a-3p下调STAT3对恶性黑素瘤细胞增殖、凋亡、迁移和侵袭的影响
2020-05-28孙耀辉宋继权柯锦
孙耀辉 宋继权 柯锦
恶性黑色素瘤是一种由黑色素细胞恶化形成的肿瘤,在所有恶性肿瘤中其发病率相对较低,但增长速度最快[1]。传统治疗方法包括早期手术切除、放疗及化疗,目前靶向治疗在抗肿瘤领域中发挥重要作用,靶向治疗对晚期患者的治疗更准确、更有效[2]。研究发现,微小RNA(microRNA,miRNA)可通过靶向相关信号通路调控黑色素瘤的发生和发展,为临床防治恶性黑色素瘤提供新的视角和靶点[3]。研究发现,miR-130a-3p在黑色素瘤细胞中下调表达,其可能参与调控黑色素瘤细胞上皮-间充质细胞转化(epithelial-mesenchymal transition,EMT)过程[4,5]。信号转导子与转录激活子3(signal transducers and activators of transcription,STAT3)在皮肤恶性黑色素瘤中高表达,与肿瘤的细胞生长、浸润深度和淋巴结转移密切相关[6]。但miR-130a-3p是如何参与调控黑色素瘤细胞增殖、迁移等生物行为的具体机制目前还不清楚,本文旨在研究miR-130a-3p对恶性黑素瘤细胞增殖、凋亡、迁移和侵袭的影响及其作用机制是否和STAT3相关。
1 材料与方法
1.1 材料 黑色素瘤细胞A2058、WM239和正常人黑色素细胞HEMn均购自中国科学院上海细胞库;胎牛血清、RPMI-1640培养基、胰蛋白酶购自美国Gibico公司;LipofectamineTM2000转染试剂购自美国Invitrogen公司;二甲基亚砜(DMSO)、BCA试剂盒、PBS缓冲液购自Sigma公司;Trizol试剂、双荧光素酶报告基因检测试剂盒购自北京Solarbio公司;反转录试剂盒、荧光定量试剂盒购自日本TaKaRa公司;Transwell小室、Matrigel胶购于美国BD公司;CCK-8试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒、RIPA蛋白裂解液、SDS-PAGE试剂盒购自上海碧云天生物技术有限公司;抗体均购自上海煊翎生物科技有限公司。
1.2 方法
1.2.1 细胞培养:黑色素瘤细胞A2058、WM239和正常人黑色素细胞HEMn使用含10%胎牛血清的RPMI-1640培养基于37℃、5% CO2饱和湿度条件下培养,每天换液1次,待细胞融和至60%~70%时,加入胰蛋白酶进行消化传代,选取处于对数生长期的细胞进行实验。
1.2.2 细胞转染与分组:取常规培养的黑色素瘤细胞A2058用0.25%胰蛋白酶消化后接种于96孔板中,待细胞生长至80%融合,更换为无血清培养基同步化12 h,随后进行转染。将miR-NC、miR-130a-3p、anti-miR-NC、anti-miR-130a-3p分别转染至黑色素瘤细胞A2058中,记为miR-NC组、miR-130a-3p组、anti-miR-NC组、anti-miR-130a-3p组;将miR-130a-3p分别与pcDNA3.1和pcDNA3.1-STAT3共同转染至黑色素瘤细胞A2058中,记为miR-130a-3p+pcDNA3.1组和miR-130a-3p+pcDNA3.1-STAT3组,转染均按照LipofectamineTM 2000试剂盒进行操作。
1.2.3 MTT检测细胞活性:在miR-NC组、miR-130a-3p组、miR-130a-3p+pcDNA3.1组和miR-130a-3p+pcDNA3.1 -STAT3组细胞培养至24 h、48 h、72 h时加入20 μl(5 g/L)的MTT溶液,继续孵育4 h;弃去多余培养基并加入150 μl DMSO振荡反应10 min,酶标仪检测490 nm处吸光度(OD)值。细胞增殖活力(%)=ODth值/空白对照组OD值×100%。
1.2.4 Transwell检测细胞迁移和侵袭:收集miR-NC组、miR-130a-3p组、miR-130a-3p+pcDNA3.1组和miR-130a-3p+pcDNA3.1 -STAT3组细胞,用胰酶消化后使用无血清培养基重悬细胞,调整浓度为2×104个/ml。细胞迁移实验:取200 μl 细胞悬液接种于Transwell小室上室中,并置于含完全培养基的下室中,37℃、5% CO2条件下培养24 h,取出小室,去除培养基后用棉签轻轻擦去上层细胞,PBS洗涤,加入4%多聚甲醛固定30 min,0.1%结晶紫染色10 min,显微镜观察并随机选取6个视野拍照,计算结晶紫染色细胞数即为迁移细胞数。细胞侵袭实验:以1∶5比例加入RPMI-1640培养液稀释Matrigel后,铺于Transwell小室的上室,室温下干燥后,按照细胞迁移实验步骤操作。最后显微镜下观察结晶紫染色细胞数即为侵袭细胞数。
1.2.5 流式细胞术检测细胞凋亡:用不含EDTA的胰酶消化各组细胞,离心收集各组细胞,PBS漂洗2次,加结合缓冲液重悬细胞。依据试剂盒说明书,先后加入Annexin V-FITC和PI避光孵育。流式细胞仪检测激发波长488 nm和发射波长530 nm处的荧光强度。实验重复3次。
1.2.6 qRT-PCR检测miR-130a-3p和STAT3 mRNA表达水平:收集miR-NC组、miR-130a-3p组、miR-130a-3p+pcDNA3.1组和miR-130a-3p+pcDNA3.1 -STAT3组细胞,研磨充分后加入Trizol试剂提取总RNA,微量核酸测定仪检测RNA纯度和浓度。使用TaKaRa反转录试剂盒将RNA反转录成cDNA,按照TaKaRa 荧光定量试剂盒使用说明配制反应体系,以β-actin为内参进行PCR扩增,每个样品重复3次,循环条件为95℃ 30 s,60℃ 30 s;72℃ 30 s,共40个循环;60℃延长5 min。相对表达量采用2-ΔΔCt法计算。
1.2.7 Western blot检测蛋白表达:收集miR-NC组、miR-130a-3p组、anti-miR-NC组、anti-miR-130a-3p组、miR-130a-3p+ pcDNA3.1组和miR-130a-3p+pcDNA3.1-STAT3组细胞,加入RIPA裂解液进行裂解,4℃,12 000 g离心15 min,收集蛋白上清液,BCA试剂盒测定蛋白浓度。将蛋白样品进行SDS-PAGE电泳后转至PVDF膜上,5 %脱脂奶粉封闭液室温封闭1 h。分别加入一抗(1∶1 000),4℃孵育过夜,TBST洗膜;加入二抗(1∶2 000)室温下孵育2 h,TBST洗涤3次,每次10 min,之后在暗室中曝光显影,再浸入定影,最后洗去残液后晾干,将胶片用Quantity One凝胶分析软件处理,测定各组蛋白条带的吸光度,以目的条带和GAPDH条带的比值作为蛋白表达水平。每个蛋白样品重复3次。
1.2.8 荧光素酶报告基因检测实验检测miR-130a-3p对STAT3的靶向调控:TargetScan数据库显示STAT3 3′UTR区域有miR-130a-3p结合位点。构建野生型和突变型基因靶点STAT3的3′UTR-荧光素酶表达载体(WT-STAT3和MUT-STAT3),取对数生长期黑色素瘤细胞A2058接种于24孔板(5×104个/孔),待细胞生长至80%融合时,用LipofectamineTM2000将WT-STAT3和MUT-STAT3组细胞分别转染miR-NC和miR-130a-3p。依据说明书要求,使用荧光素酶报告基因检测仪进行双荧光素酶报告实验测定。实验结果以荧光素酶活性和Renilla活性的比值进行统计分析。实验重复3次。
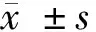
2 结果
2.1 miR-130a-3p在黑色素瘤细胞A2058、WM239和正常人黑色素细胞HEMn中的表达 qRT-PCR检测结果显示,与正常人黑色素细胞HEMn相比,黑色素瘤细胞A2058、WM239中miR-130a-3p的表达水平显著降低,且A2058细胞中降低更明显,差异有统计学意义(P< 0.05)。提示miR-130a-3p在黑色素瘤细胞A2058、WM239低表达。见表1。
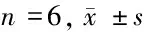

组别miR-130a-3pHEMn组2.13±0.18A2058组0.86±0.06∗WM239组1.37±0.11∗F值152.844P值0.000
注:与HEMn组比较,*P< 0.05
2.2 过表达miR-130a-3p对A2058细胞增殖、凋亡的影响 qRT-PCR检测结果显示,与miR-NC组相比,miR-130a-3p组A2058细胞中miR-130a-3p的表达水平显著升高(P< 0.05)。CCK-8法检测结果显示,在转染miR-NC和miR-130a-3p后,分别于24 h、48 h、72 h时检测细胞增殖,与miR-NC组相比,miR-130a-3p组A2058细胞活性显著降低(P< 0.05)。流式细胞仪检测结果显示,相较于miR-NC组,miR-130a-3p组A2058细胞的凋亡率显著升高(P< 0.05)。Western Blot检测结果显示,与miR-NC组相比,miR-130a-3p组A2058细胞中Bcl-2蛋白的表达水平显著降低,Bax蛋白的表达水平显著升高(P< 0.05)。提示过表达miR-130a-3p抑制A2058细胞增殖、促进其细胞凋亡。见表2,图1。
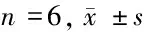

组别miR-130a-3pBax蛋白Bcl-2蛋白细胞活性(OD490 nm)24 h48 h72 h凋亡率(%)miR-NC组 0.82±0.070.31±0.030.62±0.050.43±0.040.77±0.071.36±0.127.89±0.38miR-130a-3p组1.66±0.130.84±0.070.23±0.020.29±0.020.38±0.030.56±0.0421.02±1.46t值13.93617.04717.7407.66812.54415.49221.318P值0.0000.0000.0000.0000.0000.0000.000
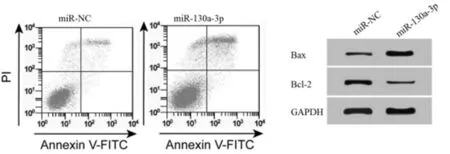
图1 过表达miR-130a-3p对A2058 细胞凋亡的影响
2.3 过表达miR-130a-3p对A2058细胞迁移、侵袭的影响 Western Blot检测结果显示,与miR-NC组相比,miR-130a-3p组A2058细胞中MMP-2蛋白的表达水平显著降低,E-cadherin蛋白的表达水平显著升高(P< 0.05)。Transwell 法检测结果显示,与miR-NC组相比,miR-130a-3p组A2058细胞迁移和侵袭数量显著降低(P< 0.05)。提示过表达miR-130a-3p抑制A2058细胞的迁移和侵袭。见表3,图2。
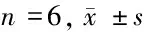
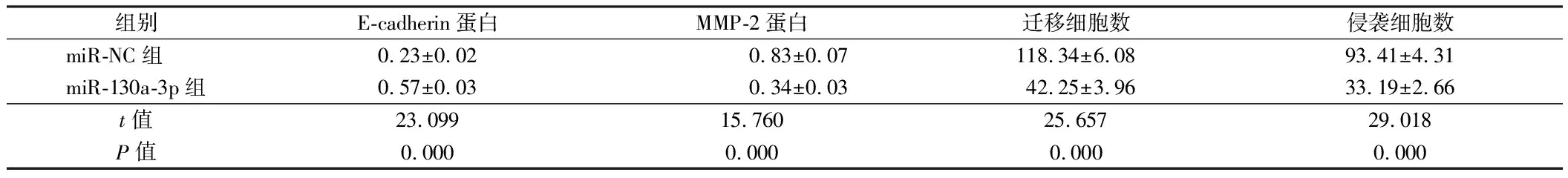
组别E-cadherin蛋白MMP-2蛋白迁移细胞数侵袭细胞数miR-NC组 0.23±0.020.83±0.07118.34±6.0893.41±4.31miR-130a-3p组0.57±0.030.34±0.0342.25±3.9633.19±2.66t值23.09915.76025.65729.018P值0.0000.0000.0000.000
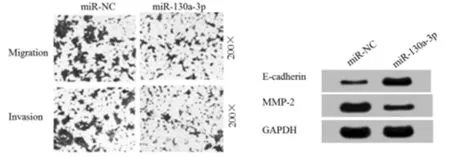
图2 过表达miR-130a-3p对A2058细胞迁移、侵袭的影响(结晶紫染色×200)
2.4 miR-130a-3p靶向调控STAT3 通过TargetScan数据库预测到STAT3与miR-130a-3p存在结合位点。荧光素酶报告基因检测实验结果显示,转染野生型STAT3基因表达载体WT-STAT3后,相较于miR-NC组,miR-130a-3p组WT-STAT3黑色素瘤细胞的荧光素酶活性显著降低(P< 0.05);而转染突变型STAT3基因表达载体MUT-STAT3后,相较于miR-NC组,miR-130a-3p组MUT-STAT3黑色素瘤细胞的荧光素酶活性差异不显著。qRT-PCR和Western Blot检测结果显示,相较相较于miR-NC组,miR-130a-3p组A2058细胞中STAT3 mRNA和蛋白的表达水平显著降低;相较于anti-miR-NC组,anti-miR-130a-3p组A2058细胞中STAT3 mRNA和蛋白的表达水平显著升高(P<0.05)。提示miR-130a-3p可靶向调控STAT3的表达。见表4、5,图3。
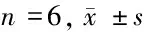
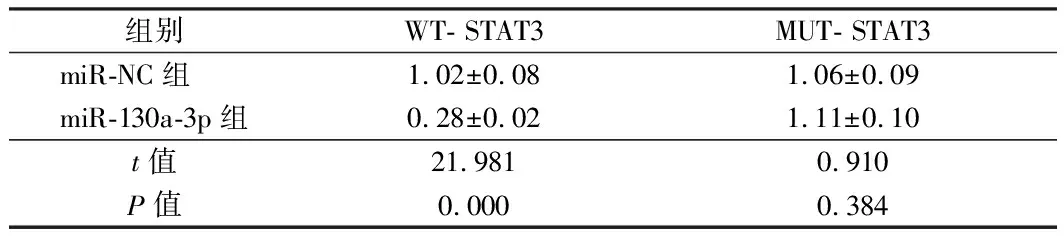
组别WT- STAT3MUT- STAT3miR-NC组 1.02±0.081.06±0.09miR-130a-3p组0.28±0.021.11±0.10t值21.9810.910P值0.0000.384
2.5 过表达STAT3能逆转miR-130a-3p对A2058细胞增殖、凋亡、迁移、侵袭的影响 Western Blot检测结果显示,与miR-NC组相比,miR-130a-3p组A2058细胞中STAT3、Bcl-2、MMP-2蛋白的表达水平显著降低,
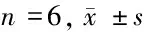
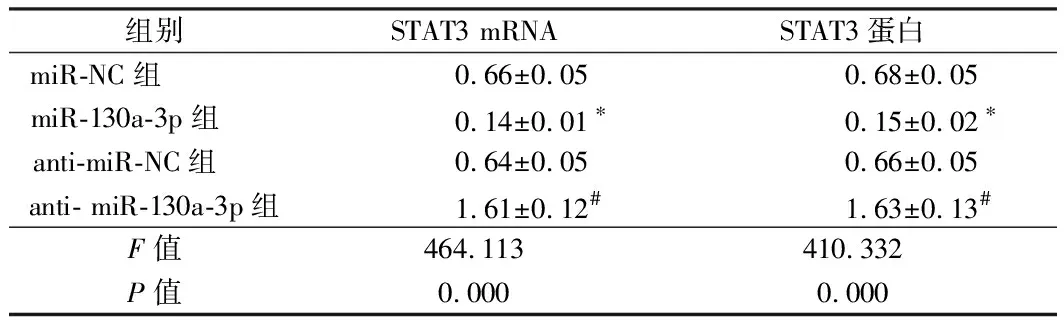
组别STAT3 mRNASTAT3蛋白miR-NC组 0.66±0.050.68±0.05miR-130a-3p组 0.14±0.01∗0.15±0.02∗anti-miR-NC组 0.64±0.050.66±0.05anti- miR-130a-3p组1.61±0.12#1.63±0.13#F值464.113410.332P值0.0000.000
注:与miR-NC组比较,*P< 0.05;与anti-miR-NC组比较,#P< 0.05
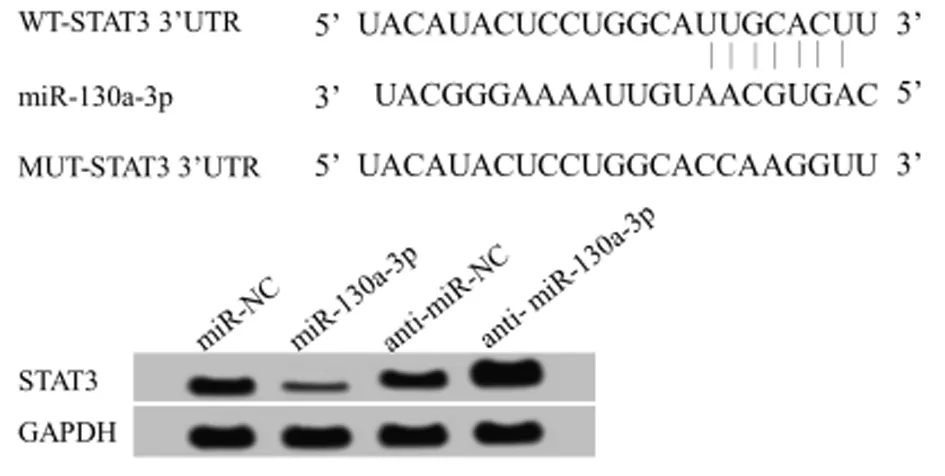
图3 miR-130a-3p靶向调控STAT3
Bax、E-cadherin蛋白的表达水平显著升高;与miR-130a-3p+pcDNA3.1组相比,miR-130a-3p+pcDNA3.1-STAT3组A2058细胞中STAT3、Bcl-2、MMP-2蛋白的表达水平显著升高,Bax、E-cadherin蛋白的表达水平显著降低(P< 0.05)。CCK-8法检测结果显示,与miR-NC组相比,miR-130a-3p组A2058细胞活性显著降低;与miR-130a-3p+pcDNA3.1组相比,miR-130a-3p+pcDNA3.1-STAT3组A2058细胞活性显著升高(P< 0.05)。流式细胞仪检测结果显示,与miR-NC组相比,miR-130a-3p组A2058细胞的凋亡率显著升高;与miR-130a-3p+pcDNA3.1组相比,miR-130a-3p+pcDNA3.1-STAT3组A2058细胞的凋亡率显著降低(P< 0.05)。Transwell 法检测结果显示,与miR-NC组相比,miR-130a-3p组A2058细胞迁移和侵袭数量显著降低;与miR-130a-3p+pcDNA3.1组相比,miR-130a-3p+pcDNA3.1-STAT3组A2058细胞迁移和侵袭数量显著升高(P< 0.05)。可见,过表达STAT3能逆转miR-130a-3p对A2058细胞增殖、迁移、侵袭的抑制和凋亡的促进作用。见表6、7,图4。
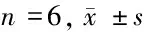

组别STAT3蛋白Bax蛋白Bcl-2蛋白细胞活性(OD490 nm)24 h48 h72 h凋亡率(%)miR-NC组 0.68±0.050.31±0.030.62±0.050.43±0.040.77±0.071.36±0.127.89±0.38miR-130a-3p组 0.14±0.02∗0.84±0.07∗0.23±0.02∗0.29±0.02∗0.38±0.03∗0.56±0.04∗21.02±1.46∗miR-130a-3p+pcDNA3.1组 0.15±0.020.86±0.080.22±0.020.25±0.020.36±0.020.53±0.0421.59±1.51miR-130a-3p+pcDNA3.1-STAT3组0.44±0.04#0.63±0.06#0.38±0.03#0.35±0.03#0.56±0.05#1.04±0.08#13.62±1.14#F值328.28699.139199.00044.606100.483160.225174.710P值0.0000.0000.0000.0000.0000.0000.000
注:与miR-NC组比较,*P< 0.05;与miR-130a-3p+pcDNA3.1组比较,#P<0.05
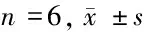
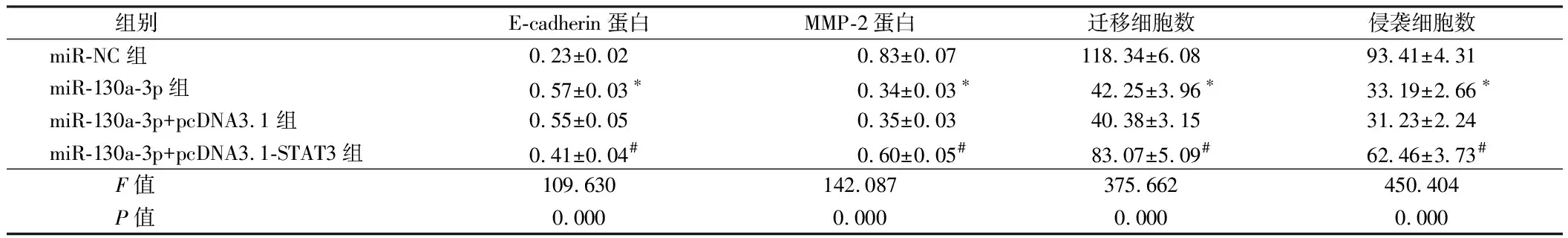
组别E-cadherin蛋白MMP-2蛋白迁移细胞数侵袭细胞数miR-NC组0.23±0.020.83±0.07118.34±6.0893.41±4.31miR-130a-3p组0.57±0.03∗0.34±0.03∗42.25±3.96∗33.19±2.66∗miR-130a-3p+pcDNA3.1组0.55±0.050.35±0.0340.38±3.1531.23±2.24miR-130a-3p+pcDNA3.1-STAT3组0.41±0.04#0.60±0.05#83.07±5.09#62.46±3.73#F值109.630142.087375.662450.404P值0.0000.0000.0000.000
注:与miR-NC组比较,*P<0.05;与miR-130a-3p+pcDNA3.1组比较,#P<0.05

图4 过表达STAT3对A2058细胞凋亡、迁移的影响
3 讨论
黑色素瘤是较常见的致死率高的恶性肿瘤,其转移早、病情隐匿,早诊断、早治疗是其治愈的关键[7]。许多特异性miRNA与恶性黑色素瘤的发生发展有关[8]。研究表明,miR-130a-3p通过抑制BACH2的表达,抑制鼻咽癌细胞的活力、增殖、侵袭和细胞周期,促进鼻咽癌细胞凋亡[9]。miR-130a-3p在肝癌组织中下调表达,通过调控靶基因smad 4的表达参与肝癌的发生发展[10]。过表达miR-130a-3p/301a-3p通过抑制TNF-α信号传导可减弱高葡萄糖诱导的MPC5足细胞功能障碍和细胞凋亡[11]。过表达miRNA-130a-3p通过下调RAB5B抑制乳腺癌干细胞增殖,迁移和侵袭[12]。miR-130a-3p可能通过TGF-β/SMAD信号通路直接靶向TGFBR1和TGFBR2,减弱非酒精性纤维化脂肪性肝炎中肝星状细胞的活化并诱导其凋亡[13]。而miR-130a-3p在恶性黑素瘤细胞中的作用机制尚不清楚,本研究结果显示,miR-130a-3p在黑色素瘤细胞A2058、WM239中下调表达,过表达miR-130a-3p可抑制A2058细胞增殖、迁移和侵袭,促进细胞凋亡,且miR-130a-3p能靶向调控STAT3的表达。
STAT3既是一种胞质信号分子又是胞核转录因子,参与细胞的增殖、转化及迁移等过程[14]。STAT3是多条致癌信号通路交汇点,在恶性肿瘤组织与细胞中普遍处于异常高活化状态,其过表达及磷酸化水平与肿瘤细胞的多种恶性生物学特征、患者不良预后密切相关[15]。有研究发现,STAT3信号通路的组成性激活可促进细胞增殖、促进组织细胞的癌变,从而参与皮肤恶性黑色素瘤的发生、发展[16]。STAT3在恶性黑色素瘤中高表达,其活化水平升高可促进恶性黑色素瘤细胞的侵袭和转移[17]。沉默STAT3能够明显抑制黑色素瘤细胞增殖、促进细胞凋亡[18]。没食子儿茶素没食子酸酯(EGCG)可通过抑制TGF-β1/STAT3信号通路来抑制TGF-β1诱导的黑色素细胞B16的EMT过程[19]。下调IGF-1R基因表达可通过抑制STAT3信号
通路降低黑色素瘤细胞增殖并诱导细胞凋亡[20]。本研究结果显示,过表达STAT3能逆转miR-130a-3p对A2058细胞增殖、迁移、侵袭的抑制和凋亡的促进作用。
综上所述,miR-130a-3p可抑制恶性黑色素瘤细胞增殖、迁移和侵袭,促进其凋亡,其机制可能与靶向下调STAT3的表达有关,将可为恶性黑素瘤的预防和治疗提供新靶点和理论基础。
