肝转移癌超声造影增强模式表现分析*
2020-05-28曹东明景香香林运旺
曹东明,景香香,林运旺
转移癌是常见的肝脏恶性肿瘤类型之一。常见转移癌的原发部位以结直肠、乳腺、肺和胰腺等部位较为多见[1-4]。准确诊断和评估转移癌的大小、数量和位置对最佳治疗策略的制定、后续随访和预后评估都是至关重要的[5,6]。传统的二维超声检查是评估肝脏病变的首选方法,但其成像的准确性通常被认为并不如增强CT或MRI检查强。超声造影(contrast-enhanced ultrasonography,CEUS)通过反映正常和病变组织的血流信号灌注情况,具备动态检测肝脏肿瘤内部微循环的优势,现已被广泛运用于对肝转移癌的评估[7-10]。研究表明,与二维超声成像相比,CEUS能显著提高肝转移癌诊断的准确度,尤其是对微小转移灶。肝转移癌的CEUS成像表现较为多样,需要在诊断时予以甄别。肝转移癌的CEUS表现与原发病灶的肿瘤类型有关,血流信号高的转移病灶多来自于神经内分泌瘤、恶性黑色素瘤或肉瘤等,而血流信号低的转移灶多见于结直肠癌、胃癌、胰腺癌或卵巢癌等[11,12]。除了血流信号外,病灶的增强方式也是多种多样,容易混淆,需要鉴别诊断。本研究分析了肝转移癌的CEUS增强模式及其影响因素,现报道如下。
1 资料与方法
1.1 研究对象 2016年1月~2019年1月我院诊治的肝转移癌患者76例,男性48例,女性28例;平均年龄为(53.2±9.6)岁。影像学(MRI和/或CT)检查具有典型的占位性病变征象,经手术后组织或肿瘤组织活检病理学检查诊断。76例肝转移癌患者共有132个病灶,病灶直径为(2.1±0.8)cm。根据病灶在增强CT检查肝动脉期强化程度区分,凡肝动脉期肿瘤表现为低密度者为乏血供,表现为高密度或等密度者为富血供。本研究经我院医学伦理委员会审核通过,患者及其家属签署相关知情同意书。
1.2 CEUS检查 使用LOGIQ E9型(GE公司,美国)或IU22型(Philips公司,荷兰)超声诊断仪行超声造影检查。相关扫描参数包括探头频率 为1~5 Hz、机械指数为 0.04~0.10。使用超声造影剂SonoVue(Bracco公司,意大利)。在CEUS检查前,常规予以二维和多普勒超声检查,观察内容包括病灶的数目、大小、位置和回声。在了解肝脏目标病灶形态和血管条件后,迅速经肘静脉注入造影剂2.4 ml。在应用SonoVue前,将其与生理盐水充分混匀,制成混悬液。在造影剂注入后20~45 s为动脉期,持续至120 s为门脉期,120~360 s为延迟期。根据CEUS成像表现,将动脉期增强模式分为高增强或局部高增强:病灶局部区域(少于病灶的一半)表现为高增强;同步等增强:与周边肝组织实质同步增强和不均匀低增强:随着超声造影时程的顺延,门脉期和延迟期CEUS成像表现为低增强(病灶回声较肝实质低)或等增强(病灶回声与肝实质相同)。另外,记录CEUS增强时间、达峰时间和廓清时间。

2 结果
2.1 一般资料 肝转移癌的原发灶包括结肠癌50例(65.8%)、乳腺癌7例(9.2%)、肺癌5例(6.6%)、胃癌5例(6.6%)、胰腺癌4例(5.3%)、胰腺神经内分泌肿瘤3例(3.9%)、卵巢癌2例(2.6%)。乏血供组肝转移癌来自结肠癌、肺癌、胃癌、胰腺癌和卵巢癌,富血供组肝转移癌来自胰腺神经内分泌肿瘤和乳腺癌。乏血供组男性28例,女性20例,平均年龄为(53.8±9.6)岁,病灶108个,病灶直径(2.1±1.0)cm;富血供组男性20例,女性8例,平均年龄为(52.8±11.1)岁,病灶24个,病灶直径(2.1±1.2)cm。两组年龄、性别和病灶直径之间均无显著性差异(P>0.05)。
2.2 乏血供与富血供病灶CEUS动脉期成像表现比较 两组成像模式显著不同(P<0.05,表1、图1)。
2.3 乏血供与富血供病灶CEUS门脉期和延迟期成像表现比较 乏血供组与富血供组患者门脉期和延迟期病灶成像表现存在显著性差异(P<0.05,表2、图2)。
2.4 乏血供与富血供病灶CEUS参数比较 乏血供组患者病灶增强时间和达峰时间均显著长于富血供组(P<0.05),而病灶增强减退时间显著短于富血供组(P<0.05,表3)。

表1 乏血供与富血供病灶CEUS动脉期成像表现(%)比较
与富血供组比,①P<0.05
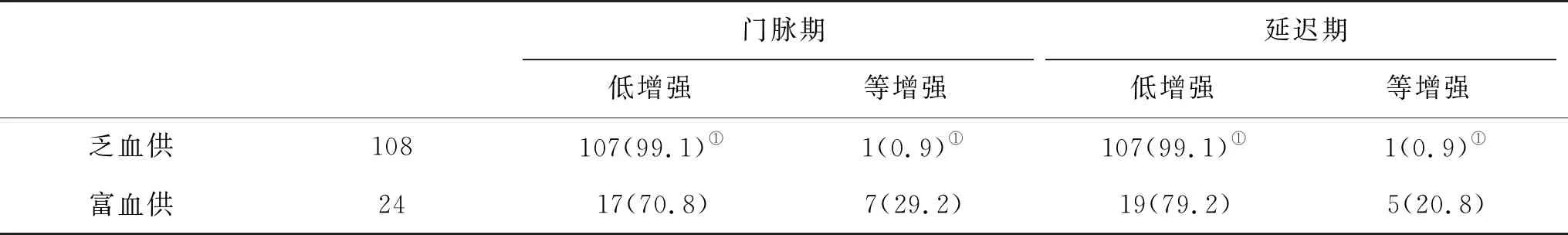
表2 乏血供与富血供病灶CEUS门脉期和延迟期成像表现(%)比较
与富血供组比,①P<0.05

表3 乏血供与富血供病灶CEUS参数比较
与富血供组比,①P<0.05
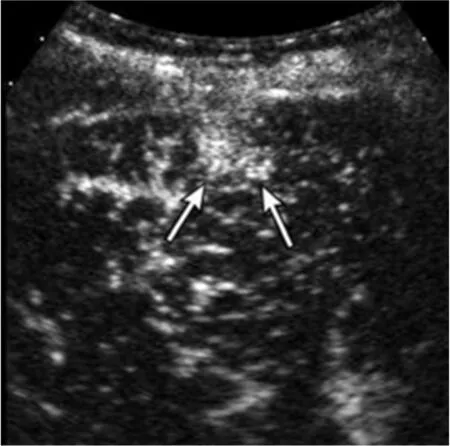
图1 直肠癌肝转移患者肝脏CEUS表现 45岁男性,造影动脉期病灶呈高增强(箭头)

图2 结肠癌肝转移患者CEUS表现 图1患者,造影延迟期病灶增强廓清(箭头)
3 讨论
肝转移癌与原发性肝脏恶性肿瘤在生物学行为方面存在显著性差异,表现在影像学成像和临床治疗方法的选择上也会明显不同。病灶局部高增强被认为是肝转移癌的特征性表现。有研究表明肝转移癌在增强CT检查动脉期表现为增强,其增强模式有时表现得比较明显,但有时则表现为混杂信号[13]。引起肝转移癌增强模式不尽相同的因素主要为原发恶性肿瘤具有不同的生物学行为。CEUS作为近年来兴起的影像学成像方法,业已在多种病变的检查方面被证明具有较为理想的诊断价值。本研究旨在总结肝转移癌CEUS增强模式表现的特征。
本研究表明肝转移癌以乏血供占多数,常见的CEUS增强模式为高增强后迅速廓清,与先前的研究结论相一致[14]。另外,CEUS增强模式与转移癌病灶的大小相关,可能的原因是随着肿瘤病灶的增大而相应发生了组织病理学变化所致。直径小的病灶血管丰富,倾向于均匀高强化,而在直径较大的病灶,由于病灶内部存在坏死或血栓,可表现出的增强方式的不均匀。另外,有研究表明由于低动脉灌注等原因的存在,肝转移癌病灶常常在CT或MRI成像上表现为局部高增强[15]。肝细胞癌和肝转移癌间存在相似的强化模式,两者都可表现为快速增强和快速廓清,在鉴别诊断方面仅依靠这些表现还不足以鉴别,可能存在混淆。结合本研究结果发现,我们发现肝转移癌病灶表现为短暂的高强化过程,随后增强被很快廓清。肝细胞癌病灶往往表现出相对较慢的廓清速度,特别是较小(<3 cm)或分化较好的肝细胞癌[16,17]。另外,我们能够在门脉期观察到肝转移癌表现为低强化,这也有助于肝转移癌的早期发现。
由于本组病例乏血供和富血供肝转移癌病例数相差悬殊,它们在CEUS动脉期增强模式方面并无显著性差异,但它们增强或廓清时间可以反映病灶的血供状况[18-20]。CEUS增强时间和达峰时间与肿瘤血管密度密切相关,富血管病灶强化时间显著快于乏血管病灶,而在延迟期扫描,富血管转移癌似乎比乏血管病灶的廓清速度显得更慢。因此,我们能够推测出当肿瘤血管密度越多时,其增强信号的廓清时间也越长。
