卡托普利对非酒精性脂肪性肝病大鼠肝细胞脂肪变性的影响*
2020-05-28唐新亚焦营营
唐新亚,侯 森,焦营营
非酒精性脂肪性肝病(NAFLD)以弥漫性肝细胞脂肪变性和脂质沉积为主要病理,且无过量饮酒史。据报道,西方国家普通人群NAFLD患病率高达20%~30%,国内患病率类似。NAFLD的发病机制尚未完全明确,可能与环境、遗传、生活方式等因素密切相关[1,2]。目前,“二次打击”学说已被认为是解释该病发病机制较为成熟的观点,胰岛素抵抗(IR)会诱导肝细胞脂肪变性,致使肝脏脂肪沉积,以线粒体反应氧体系为核心的氧化应激和脂质过氧化会加重肝脏损伤,引起肝脏炎症反应。肝脏炎症持续存在,诱导细胞因子和其它因素综合作用,促使炎症进展为肝组织坏死及纤维化,形成炎症、坏死恶性循环[3,4]。有报道认为,以肝组织细胞色素氧化酶P4502E1(cytochrome P4502E1,CYP2E1)为中心产生的氧自由基和脂质过氧化会诱导肝实质损害,在非酒精性脂肪性肝病的发生发展过程中发挥着重要的作用[5]。卡托普利属血管紧张素转化酶抑制剂,已被用于治疗高血压和紫癜性肾炎等疾病,在改善血糖代谢、增加胰岛素敏感性、抗氧化应激、缓解放射性肺损伤等方面疗效显著[6,7]。本研究探讨了卡托普利对NAFLD大鼠肝细胞脂肪变性的影响,现报道如下。
1 资料与方法
1.1 动物、试剂与仪器 健康雄性SD大鼠64只,SPF级,鼠龄为3~6个月,体质量130~160 g,由湖北省疾控中心实验动物中心提供。饲料级胆酸钠、饲料级胆固醇(安徽天启化工科技有限公司);卡托普利(四川太平洋药业有限责任公司);罗格列酮(太极集团重庆涪陵制药厂有限公司);检测丙二醛(malonic dialdehyde,MDA)试剂盒(北京邦定生物医学技术有限公司),检测谷胱甘肽(glutathione,GSH)试剂盒(南京建成生物工程研究所),检测血生化试剂盒(上海百祥生物科技有限公司);TIANScript cDNA第一链合成试剂盒、总RNA提取试剂盒(天根生化科技有限公司);聚合酶链反应(PCR)反转录试剂盒(美国Promega公司);检测肝组织CYP2E1引物(美国Santa Cruz公司);DXC800型全自动生化分析仪(美国贝克曼库尔特公司);DYY-6C型电泳仪(北京六一仪器厂);720型超低温冰箱(Thermo Scientific公司);722型分光光度计(上海佑科仪器仪表有限公司);Spectra Max M3酶标仪(Molecular Devices公司);ABI-7300荧光定量PCR检测仪(美国应用生物系统中国公司);Gel DocTMEZ成像系统(美国BIO-RAD公司)。
1.2 NAFLD大鼠模型的建立 随机将64只大鼠分为4组,给予对照组普通饲料喂养,给予其他组高脂饲料(87.8%普通饲料+10%猪油+0.2%胆酸钠+2%胆固醇)喂养,制备NAFLD大鼠模型。在造模第6 w,明确模型建立后,分别给予动物10 ml·kg-1生理盐水(模型组)、卡托普利0.7 mg.100 g-1(卡托普利处理组)、罗格列酮0.047 mg.100 g-1(罗格列酮处理组)灌胃。持续给药6 w,所有大鼠禁食12 h,给予1%戊巴比妥钠0.4 ml.100 g-1腹腔注射麻醉,处死动物,取血和肝脏,称量肝湿质量,计算肝指数(=肝湿质量/体质量)。按组织质量(g)∶乙醇体积(m1)=1∶9的比例,加入无水乙醇,冰水浴下匀浆、离心,收集上清液并保存。另留取部分肝组织,4%甲醛固定,行肝组织病理学检查,将剩余的肝组织置入冻存管,置于液氮中短期保存。
1.3 肝组织CYP2E1 mRNA水平检测 取肝组织0.1 g,于液氮中磨碎,提取总RNA,测定总RNA浓度和纯度,确保D260/D280≥1.8。合成TIANScript cDNA第一链,行逆转录反应,分别加入CYP2E1和GAPDH基因引物行PCR反应,于1.5%琼脂糖凝胶电泳,应用凝胶成像分析系统照相,记录结果。

2 结果
2.1 各组大鼠肝组织病理学表现 对照组肝细胞未见炎症反应,无变性及坏死;模型组肝细胞体积增大,见广泛性脂肪变性和细胞水肿;卡托普利处理组大部分肝细胞排列正常,可见少量脂肪变性,部分细胞水肿;罗格列酮处理组肝组织病理学变化类似于卡托普利处理组,但细胞内脂滴较大,数量略增多(图1)。
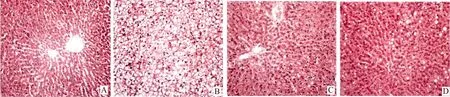
图1 各组大鼠肝组织病理学表现(HE, 200×) A:对照组,肝细胞正常,无炎症反应;B:模型组,肝细胞广泛性脂肪变性,出现炎症反应;C:卡托普利处理组,肝细胞脂肪变性和炎症程度明显减轻;D:罗格列酮处理组,肝细胞脂肪变性和炎症程度明显减轻
2.2 各组大鼠血清AST、ALT、TC、TG水平比较 模型组血清AST、ALT、TC、TG显著高于对照组(P<0.05);卡托普利处理组、罗格列酮处理组血清AST、ALT、TC、TG显著低于模型组(P<0.05,表1)。

表1 各组大鼠血清指标比较
与对照组比,①P<0.05;与模型组比,②P<0.05
2.3 各组大鼠肝组织肝湿重和肝指数比较 模型组、卡托普利处理组和罗格列酮处理组肝湿重、肝指数和肝组织CYP2E1 mRNA水平显著高于对照组(P<0.05),而卡托普利和罗格列酮处理组肝湿重和肝指数显著低于模型组(P<0.05,表2)。

表2 各组大鼠肝湿重和肝指数比较
与对照组比,①P<0.05;与模型组比,②P<0.05
2.4 各组大鼠血清MDA和GSH水平比较 模型组血清MDA水平显著高于,而血清GSH水平显著低于对照组(P<0.05),卡托普利和罗格列酮处理组血清MDA显著低于,而血清GSH水平显著高于模型组(P<0.05,表3)。

表3 各组大鼠血清MDA和GSH水平比较
与对照组比,①P<0.05;与模型组比,②P<0.05
3 讨论
近年来,国内非酒精性脂肪性肝病患病率呈逐年增长且年轻化趋势,病因复杂,是多方面因素综合作用的结果,其中RI、活性氧簇和氧应激、脂质过氧化损伤、脂肪细胞因子、与脂肪酸代谢相关的细胞因子等在其发生和发展过程中发挥着重要的作用[8,9]。目前,该病尚无特效治疗,主要以运动、饮食和行为疗法为主,药物治疗为辅,需要综合性长期治疗。卡托普利作为血管紧张素转换酶抑制剂的代表药,已被证实在原发性高血压、充血性心力衰竭、急性肺栓塞等疾病治疗中发挥着重要的作用,在治疗大鼠肝损伤方面也具有显著的疗效,但目前鲜有报道分析卡托普利对非酒精性脂肪性肝病大鼠肝细胞脂肪变性的影响[10-12]。
本研究模型组肝湿重和肝指数增大,血清AST和ALT上升,血清TC和TG上升,血清MDA增多和血清GSH减少。在光镜下观察病理学表现发现模型组大鼠肝细胞体积增大,伴细胞水肿,肝细胞脂肪变,证实非酒精性脂肪性肝病大鼠造模成功。
本研究卡托普利处理组和罗格列酮处理组血清AST、ALT、TC和TG明显低于模型组,与既往报道[13]相似,预示卡托普利可降低血清AST、ALT、TC和TG水平。非酒精性脂肪性肝病大鼠接受卡托普利干预后肝细胞损伤减轻,肝脏功能获得明显的改善,其机制可能是对肝细胞膜功能恢复有显著的改善作用14,15]。卡托普利可通过减少非酒精性脂肪性肝病大鼠脂质在肝细胞内的合成和沉积,改善脂代谢紊乱。本研究卡托普利处理组和罗格列酮处理组肝组织肝湿重和肝指数明显低于模型组,卡托普利处理组动物大部分肝细胞排列正常,可见少量的脂肪变性和部分细胞水肿,证实卡托普利干预后肝细胞脂肪变性明显改善,肝脏脂质沉积状况减轻。
本研究卡托普利处理组和罗格列酮处理组血清MDA明显低于模型组,而血清GSH水平显著高于模型组,证实卡托普利能有效减轻非酒精性脂肪性肝病大鼠机体氧化应激和脂质过氧化程度,与以往报道[16]相似。MDA具有细胞毒性,可诱导细胞膜通透性及流动性改变,引起细胞结构及功能损伤,诱导致炎因子大量释放,与Kupffer细胞共同作用介导肝损伤[17]。GSH属低分子抗氧化剂,可清除体内自由基,维护细胞膜结构及功能完整性,抗脂质过氧化效果显著,其血清含量反映了机体的抗氧化能力[18]。
本研究发现,卡托普利处理组和罗格列酮处理组肝组织CYP2E1 mRNA水平显著低于模型组,表明卡托普利可经诱导YP2E1 mRNA水平下调,调节体内氧化应激和脂质过氧化[19,20]。卡托普利可通过降低非酒精性脂肪性肝病大鼠CYP2E1蛋白表达水平,减轻脂质过氧化程度,缓解氧化应激反应,改善肝损伤。
