肾交感神经射频消融术的离体实验研究
2020-05-28程妍妍
南 群,程妍妍,高 翔,庞 玥,田 甄
(北京工业大学生命科学与生物工程学院,北京 100124)
高血压作为最常见的心脑血管疾病,其发生率逐年上升,严重威胁人类生命安全. 中国高血压人群达2 亿以上,约占全球高血压总人数的1/5,而35 岁以下年轻人高血压发生率则在20%~25%[1]. 在接受正规治疗的高血压患者中,顽固性高血压患者占20%~35%,可引起急性心肌梗死、缺血性脑卒中、心功能不全、肾功能衰竭等危险事件发生[2-3]. 根据2010年中国高血压防治指南[4-5],顽固性高血压定义为3种及3种以上不同作用机制的降压药物(其中一种为利尿剂)达到最佳剂量并达到足够服用疗程而血压仍未控制,或4种或以上降压药物血压才可以控制,又称难治性高血压. 然而,治疗顽固性高血压的困难在于在传统的降压药物基础上加醛固酮阻滞剂、筛查继发性高血压等措施都无法降压;其次,部分人群对于降压药物副作用敏感或其他各种原因对药物疗效反应较差. 因此,探索有效控制血压的方法成为临床研究的重点.
交感神经的过度激活在高血压的产生和维持中起到重要的作用,阻断交感神经成为治疗高血压的靶点[6-8]. Esler[9]研究证明,肾交感神经释放的神经递质为去甲肾上腺素. 肾交感神经纤维包括肾传入神经与肾传出神经,均位于肾动脉外膜[10]. 相关动物实验证明切除肾交感神经会使血压下降[11]. 早在19世纪初,人们就开始尝试通过外科手术去除交感神经支配来降低血压,因手术创伤大、操作复杂而未能推广,但利用降低交感神经兴奋性来控制血压这一理念却得到了肯定[12]. “经皮经肾动脉消融交感神经治疗难治性高血压”(catheter-based renal sympathetic denervation for resistant hypertension, RSD),又称去肾交感神经术(renal denervation, RDN),是一种微创手术,可通过对抗交感神经过度兴奋达到降压效果,这一技术在许多国家临床应用中逐渐接受并得到推广[13]. 它是通过射频电极释放射频能量,透过肾动脉的内、中膜选择性毁坏外膜的肾交感神经纤维,来降低肾动脉交感神经活性释放,从而抑制交感神经过度兴奋,达到降压目的. 与传统的外科肾交感神经切除术相比,RDN可对肾交感神经选择性离断,具有手术创伤小、术中及术后并发症少、手术过程短和术后恢复时间短等优点,患者接受度及依从性较高[14]. 相关研究表明,当消融区域温度升高达到有效治疗温度超出43 ℃即相对人体温度37 ℃的温升值超过6 ℃,肾交感神经能够被完全消融[15].
随着射频导管消融术治疗顽固性高血压广泛的临床应用,许多业内人士从不同的角度对RDN这一术式的术前规划或有效性及安全性进行探讨. 熊楠青等[16]进行了离体和在体动物猪实验观察猪肾动脉交感神经丛消融术中的效果及其安全性,术后3个月进行肾动脉和交感神经损伤情况病理学观察. 张健等[17]进行了离体和在体动物犬实验探讨RDN的可行性及安全性. 从病理学检查角度,术后 1 个月随访作肾动脉交感神经坏死检测. 然而,临床研究大部分从动物实验进行病理学观察的角度观察RDN有效性,若从交感神经纤维温度的敏感性角度来看,真实的组织血管较薄,离体实验很难进行温度的数据采集,较多采用其他模型进行模拟[18-19]. Ye等[20]进行数值模拟和离体实验的射频消融效果对比,离体实验采用不同电导率的聚丙烯酰胺凝胶模型模拟肾实质和血液. 因此,该生物模型并没有考虑血液的流动性. Dong等[15]从离体实验和仿真对比的角度研究该术式有效性,但是离体实验所采用的材料为外径相同的直血管模拟肾实质,真实的肾动脉为分叉的血管(入口和分叉处内外径不一). 为了更真实地模拟人体肾动脉,同时将血液流动的影响考虑在内,方便温度的数据采集,制备了含有血液流动通道的分叉式血管.
本研究利用3D打印技术打印血管并制备生物体模模拟肾动脉,采用质量分数为0.9%的盐溶液模拟血液流动,搭建血液循环平台,执行射频消融术. 研究射频能量对血管壁外围组织和血液的影响,探究不同射频消融时间、温控温度及血液流速情况下的消融效果.
1 材料和方法
1.1 实验材料
聚乙烯醇水凝胶(polyvinyl alcohol hydrogel, PVA-H)具有同生物软组织相似的机械性能(高弹性模量和高机械强度)、良好的导电性和传热性能,结构非常稳定以及生物相容性好等优点,在生物医学领域应用广泛[21]. PVA-H中的水可使溶于其中的低分子量物质从其中渗透扩散,具有生物膜的特性[22-23]. 水凝胶类材料在物理性质方面比其他任何人工合成材料更像活体组织[24-25]. 本实验采用PVA-H模拟肾动脉血管,将射频导管与血管相似的PVA-H壁面接触模拟消融过程.
本实验采用3D打印技术打印理想化肾动脉模型置于长方体盒内整体作为模具,将聚乙烯醇(PVA:w=15%)粉末、氯化钠(NaCl:w=2%)粉末溶解于二甲基亚砜(DMSO:w=80%)水溶液中,室温下反复搅拌;将溶液置于99 ℃的恒温水浴锅中加热4~6 h,每0.5 h搅拌一次,确保溶质充分溶解;将溶化的PVA溶液置于-4~6 ℃的冰箱中凝固27~50 h;取出后常温冷却12~24 h. 血管模型如图1所示,完成后的模型为中间含有血管通道的长方体体模.
1.2 实验仪器
本实验所用实验仪器包括FYJS85- IV射频仪、温度数据采集仪、数显流量计、YE- 180小流量静音循环流量泵等. 实验所用的FYJS85- IV型射频仪(温控型射频仪,黄河医电公司)为改进型产品,Agilent34972A温度数据采集仪(安捷伦公司)为多点数据采集仪,ZJ- LCD- M数显流量计(江节能电子有限公司)的数据采集卡通过导线与测温针相连.
1.3 开环式血液循环系统
本研究搭建起开环式流动循环系统以便射频电极针易于插入肾动脉. 开环流动循环系统示意图如图2所示,水桶内装有质量分数为0.9%的盐溶液被潜水泵(工作状态为稳流)驱动通过与硅胶管(管直径1.65~1.85 cm)连接模拟血液流动,控制球阀设置不同流速,同时通过数显流量计监控水流流速. 实验制备的凝胶体模参数经过计算和测量与人体参数对比,如表1所示.
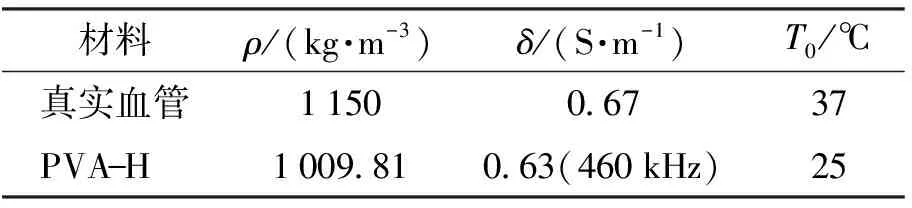
表1 实验材料参数对比
注:ρ为密度;δ为电导率;T0为所处环境温度.
实验制备的PVA- H生物体模为分叉的血管模型,与射频消融仪的电极相接触进行消融,同时插入热电偶实时采集温度和记录数据并存储于电脑端.
1.4 实验过程
1.4.1 测温针排布
温度为评价射频消融结果的重要指标,在实验前对测温针进行定标用来温度校准. 实验总共设置九根测温针,分为4类. 第一类针(101、102)置于血管的水流中心,101位于射频电极附近血流中心处,102位于分叉血管处,目的在于监测血液中温度变化情况;第二类针(201、202、203)紧贴血管内壁与射频电极相距0 mm,两两相距5 mm,目的在于获取血管内壁的温升情况,分析其是否出现热损伤. 3根针与电极平行,垂直距离一致,为减小误差,实验后分析其平均值. 第三类针(301、302、303)和第四类针(401)与消融点的垂直距离分别为4和8 mm,与第二类针平行安放,目的为测得血管壁外围组织的升温情况. 具体排布方式如图3所示.
1.4.2 实验参数设置
应用离体实验模拟人体血液流动,需要得到模型尺寸和人体血流参数,并且将实验模型与人体实际参数等效. 由于真实的人体肾血管的管壁非常薄从而忽略壁厚,则实验采用的模型为含有血管通道的长方体体模,通道外围部分为12 cm×9 cm×9 cm的长方体用来模拟人体腹部组织. 根据解剖学特点[26],人体肾动脉的入口直径为0.50~0.70 cm,分叉处直径0.30~0.35 cm. 本实验所用等效入口管径为1.65 cm,分叉处管径为1.25 cm,分叉角度约为50°. 雷诺数是一种量纲一的数,用于表征流体流动情况. 利用雷诺数可区分流体的流动状态(层流或湍流). 人体血液看作牛顿流体,流动状态为层流,通过真实的物性参数和雷诺数计算公式,计算得出实验中溶液的流速范围.
(1)
式中:Re为流体的雷诺数;v为流体的流速,m/s;ρ为流体的密度,kg/m3;μ为流体的黏性系数,Pa·s;d为管道的直径,m.
根据雷诺数相同等效原则[27],即外部条件几何相似时(几何相似的管子,流体流过几何相似的物体等),若二者雷诺数相等,则流体流动状态则几何相似 (流体动力学相似). 经计算得到,实验参数和实验变量设置如表2、3所示.

表2 实验参数

表3 离体实验变量
求得实验液体流速在0.14~0.42 m/s. 液体流速分别取值v1=0.2 m/s、v2=0.3 m/s、v3=0.4 m/s. 根据流速和流量转换关系
Q=vSA
(2)
式中:Q为液体流量,L/min;SA为流体流过的管道横截面积,m3. 将流速转换为流量,Q1=2.56 L/min、Q2=3.84 L/min、Q3=5.12 L/min.
在准备工作完成后,按照要求完成仪器的连接. 连接射频消融仪正负极,将生物体膜置于负极板上,射频电极针从血液入口插入,保证电极紧贴血管壁. 进行实验,并采集数据和实时记录温度,每组实验重复多次取平均值.
ΔT=T1-T0
(3)
式中:T1为射频消融术后温度,℃;T0为室温下实验所测的初始温度.
液体的流动涉及到流场的质量守恒定律. 在恒定流流动时两断面间流动空间内流体质量不变,流动连续,在同一段时间Δt中,根据质量守恒定律流入断面A的流体质量必等于流出断面B和C的流体质量之和. 本研究中肾动脉模型入口外径RA=1.65 cm,分叉处外径RB=RC=1.25 cm,因此,流出断面B和C的流体质量相等. 即
QA=QB+QC=2QB
(4)
本研究稳定流动的流场中的分流情况如图4所示.
当流体不可压缩即ρ为常数时,其连续性方程为
vASA=vBSB+vCSC=2vBSB
(5)
根据式(5)可求得分叉处测温点102的速度. 针对不同实验,当vA=0.2 m/s时,vB=vC=0.35 m/s; 当vA=0.3 m/s时,vB=vC=0.53 m/s; 当vA=0.3 m/s时,vB=vC=0.70 m/s. 可进一步对比测温点101和102加以区别.
2 实验结果
本研究获取了不同实验条件(液体流量、消融时间,与消融点距离和射频功率)对组织(距离消融点0、4、8 mm进行测温)和液体中心(101、102)的升温的影响,并分别进行数据分析. 设定加热时间为2 min时的实验数据如表4所示,组织的温升包括对测温点和消融点垂直距离分别为0、4、8 mm处温升范围的统计. 为减小测量误差,0 mm的结果为测温针201、202、203测得数据的平均值,4 mm的结果为测温针301、302、303测得数据的平均值,8 mm处的结果为测温针401的所测数据.

表4 时间为2 min的实验数据
从表4中数据可以初步看出,与对照组流量为0 L/min(液体静止)对比,液体流量从2.56 L/min增加到5.12 L/min时,同条件下组织和液体的ΔT值均呈下降趋势.
2.1 液体流量因素影响
在射频加热过程中,血液的流动会带走部分热量,进而影响温度的上升. 采用控制变量方法,当射频加热时间为4 min,如表5所示,温控温度为70 ℃时,改变液体流量,观察不同液体流量下射频消融对组织升温的影响. 所得结果如图5所示.
消融结果受液体流量的影响. 由图5看出,不同测温点的温升均随血液流量呈现下降趋势,执行射频消融时,血液流动的速度越快,带走的热量就越多,有效降低了温升幅度,故而起到一定的冷却效果. 液体流量接近层流速度阈值即0.4 m/s时的温升最高为1 ℃,该流速下消耗的热量最多. 相同血液流量下,通过对比不同距离测温点的曲线发现,距离射频电极4 mm时ΔT值最大,说明血管壁外围组织因远离管内血液而热量散失较慢,一定程度上验证了在血管内执行消融在一定条件下可以消融位于外膜4 mm处外周交感神经纤维.

表5 时间为4 min的实验数据
2.2 消融时间因素影响
当液体入口流量为2.56 L/min,温控温度为65 ℃时,改变射频消融时间,探究加热时间对组织和血液的升温影响.
由图6可以看出,消融时间对组织和血液的热量累积均具有一定的叠加效应. 但从8 mm的温升曲线来看,对于组织,距离射频电极较远的测温点的叠加效应比较微弱. 对比0 mm和血管壁外4 mm温升曲线,血管壁的ΔT值均小于4 mm下的同条件值,血液的冷却作用能一定程度起到保护血管免受热损伤. 对于血液,测温点101的ΔT值在0.23~0.29 ℃,分叉点102的ΔT值在0.11~0.16 ℃,消融时间的累加对血液的影响甚微.
2.3 测温点位置因素影响
当消融时间为4 min,液体入口流量为3.84 L/min时,设置不同温控功率,观察组织距离射频电极不同位置的升温情况.
由图7可知,组织位置不同,消融效果不同. 不同温控功率下的组织温度上升值均随测温点的位置呈现先上升后下降的趋势. 相同条件下,距离消融点4 mm时ΔT最大. 距离消融点0与4 mm相比,ΔT较低,这是因为距离消融点0 mm处存在血液流动,血液的流动带走了部分热量,使得升温幅度降低. 距离消融点4和8 mm相比,8 mm处的温升值远远低于4 mm处温升值,说明距离射频电极越远,能量越低,温升越慢. 在8 mm测温点的ΔT仅仅上升0.38~0.76 ℃,因此可知,射频能量的传播范围是有限的,且并不与电极距离的增加线性增加.
2.4 射频功率因素影响
消融功率的设定是影响射频能量的输出的重要因素之一. 当消融时间为4 min,液体入口流量为3.84 L/min时,设置不同射频功率即温控温度,分析数据结果,如图8所示.
可以看出,对于组织,增加射频功率,温升幅度增加,射频功率的输出同样具有能量累积效应,但是由于实验设备的限制,继续增加温控功率是否温升随之增加需要进一步的实验探究. 增加射频功率的输出,4 mm测温点的温升变化幅度较大,0和8 mm温升幅度较小,分别受液体的冷却作用和距离射频电极较远所致. 对于血液,101和102测温点射频输出功率越高,可能会造成的热损伤就越明显.
上述结果中,101和102均位于血液内,当101的流速为分别取0.2、0.3、0.4 m/s时, 根据质量守恒定律,102的流速相应为0.35、0.53、0.70 m/s. 102与 101相比,流速较高,距离射频电极距离较远. 因此相同条件下同时受距离(距离较远时能量传播较慢)和流速(液体快速流动带走的能量较多)变化规律影响,测温点102温升值相较101低. 因此,在研究血液内升温情况时,液体的平均温升(见表4、5)主要为101多次测量的温升值的平均值.
2.5 统计学分析
实验利用生物体膜代替组织排除了个体引起的差异. 针对射频功率、液体流速、加热时间各影响因素,使用SPSS 19.0分别对每组数据进行单样本T检验,结果显示,P值均小于0.05,具有统计学意义.
3 讨论
由于人体真实血管管壁较薄,离体实验很难采集温度数据. 因此,本实验通过制备生物体模模拟肾动脉,采用质量分数为0.9%的盐溶液[24]模拟血液流动,搭建开环式血液循环系统,同时执行射频消融术. 实验采集位于组织距离消融点不同位置和血液中心处的温度,探究了不同消融条件(射频加热时间、温控功率及血液流速)下的消融效果及对血管壁外围组织和血液的影响.
根据实验数据分析得出:1) 血液血流量由0 L/min上升至5.12 L/min时,血管外围组织不同距离消融点的ΔT均呈下降趋势,血管壁处的温升从3.96 ℃降低到0.52 ℃,说明进行射频消融时,血液流动的速度越快,带走的热量就越多,有效降低了温升幅度,可起到一定的冷却作用; 2) 射频加热时间由2 min增加至4 min时,血管壁外围组织和血流中心的ΔT值均增加,血液中心的最大ΔT值仅0.29 ℃,消融时间对组织和血液的热量累积均具有一定的叠加效应,而血液的冷却作用能够一定程度起到保护血管免受热损伤且消融时间的累加对血液的影响甚微; 3) 测温点与消融点距离为0、4和8 mm处于不同功率下的平均温升值分别为3.90、5.13、0.59 ℃;射频能量的传播范围是有限的,且并不与电极距离的增加线性增加; 4) 温控温度从65 ℃变化至75 ℃时,血管外围组织最大ΔT值为6.67 ℃,血液中心最大ΔT值为2.76 ℃,这与实验室前期关于牛肝脏血管的离体实验研究[28]的变化规律基本一致.
本实验存在不足之处:首先, 打印的3D肾动脉模型为理想化模型,与人体真实肾动脉仍然存在一定的差距;其次,循环的血液为0.9%的盐溶液与人体复杂的血液内环境存在一定的差异;配置比例的不同使得生物体膜呈现不同的物理特性. 因此探索与真实血管传热性和导电性等参数一致性的配置比例有待进一步研究.
去肾交感神经术为治疗难治性高血压提供了一种新的非药物治疗手段,是在传统疗法上的突破和创新,由于这种手术创伤小,恢复较快,且并发症比较少,因此受到广泛关注. 射频产生的高频电磁场使组织发生离子震荡,摩擦生热并传导至周围组织,通过直接热效应引起细胞死亡. 但是这一术式为血管内消融,如何保证电极周围瞬间达到的高温不会对血管壁引起热损伤,还将从细胞学的角度,开展细胞对温度的敏感性实验研究;消融后肾交感神经是否实现损毁或者血压是否下降,后期需要进行动物实验进一步临床验证.
4 结论
1) 射频消融时,液体的快速流动能够消耗部分热量,可以起到一定程度的冷却作用,避免组织和血液热损伤;液体流速在0.2 m/s时,组织的温升值最高为2.67 ℃,液体流速接近层流速度阈值0.4 m/s时组织的温升最高为1.00 ℃;相比对照组流速为零时组织最高温升5.02 ℃而言,流速越大,冷却作用越明显.
2) 消融时间在0~4 min内对组织和血液的热量累积均具有一定的叠加效应. 但是,距离射频电极8 mm测温点的叠加效应比较微弱,没有达到治疗温度,此时对组织温升影响较小.
3) 血管壁外围组织因远离管内血液而热量散失较慢,位于外围组织的测温点与消融点垂直距离为4 mm时升温最高达到6.67 ℃,可损毁位于血管外膜4 mm内的交感神经纤维.
4) 时间在4 min内和温控温度小于75 ℃时,液体最大温升不超过2.76 ℃,可见对血液温升影响较小.
5) 为临床提供了基本数据的参考,基本验证了血管内执行去肾交感神经术的安全性和有效性.
