舒洛地特通过抑制NOX4/NLRP3通路减轻高糖诱导的视网膜血管损伤*
2020-05-26何学敏彭荣东李静仁付夏楠石国军陈燕铭
李 婷,何学敏,彭荣东,李静仁,付夏楠,周 丽,石国军△,陈燕铭△
(1中山大学附属第三医院内分泌与代谢性疾病科,广东省糖尿病防治重点实验室,广东广州510630;2中山大学附属第三医院临床免疫中心,广东广州510630)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病(diabetes mellitus,DM)常见的微血管并发症,是成年人最常见的致盲性眼病[1],由于其缺乏特异性的治疗方法,重点在于早期筛查早期防治,研究其发病机制及防治方法具有重大现实意义。内皮细胞是视网膜微血管的重要组成部分,对维持视网膜微血管的结构和功能完整性起重要作用。炎症与DR的发生发展密切相关,DR患者[2]的房水和血清中都发现了白细胞介素1β(interleukin-1β,IL-1β)和IL-6等炎症相关因子的增加。因此,抑制促炎症分子,保护内皮细胞,减轻DR的血管渗漏[3],是目前研究的热点。
IL-1β是核苷酸结合寡聚域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体(inflammasome)激活后产生的促炎介质之一,敲除IL-1β受体基因缓解了小鼠DR的进展[4]。NLRP3炎症小体是一个分子复合体,由3个部分组成:感受蛋白为NLRP3,衔接蛋白为含胱天蛋白酶募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC),效应蛋白为前体胱天蛋白酶1(procaspase-1,Pro Casp-1)。NLRP3在DR中被激活[5]。抑制NLRP3炎症小体可保护糖尿病诱导的内皮细胞间紧密连接蛋白1(zonula occludens-1,ZO-1)和VE-钙黏着蛋白(VE-cadherin,VE-Cad)[6],这是减轻血管渗漏重要的一环。
活性氧簇(reactive oxygen species,ROS)对内皮细胞有损伤作用[7]。NADPH 氧化酶(NADPH oxidase,NOX)是脉管系统ROS主要的来源之一[8]。高糖刺激下,内皮细胞中NOX4/ROS激活并诱导NLRP3炎症小体活化[9];ROS还可通过降解细胞间黏附蛋白损伤内皮细胞[10]。另外,研究表明DR患者中ROS升高[11]。这些研究表明,NOX4是诱导DR氧化应激和血视网膜屏障分解的关键分子。
舒洛地特(sulodexide,SDX)由80%的低分子肝素和20%的硫酸皮肤素构成,属于葡糖胺聚糖(glycosaminoglycans,GAGs)[12]。临床研究显示,SDX 干预的糖尿病患者视网膜的渗漏减少[13],提示SDX具备治疗DR的潜能。在体外实验中,SDX在内皮细胞中抑制高糖诱导的ROS生成和炎症因子分泌[14],提示SDX可能具有抑制NOX等酶活性的作用。
本研究旨在探索SDX对糖尿病视网膜尤其是视网膜微血管内皮细胞的影响及其潜在机制。本课题组前期研究提示SDX干预减轻了DR小鼠的视网膜渗漏,NLRP3炎症小体也同时减少[15]。因此,本研究重点关注SDX抑制NLRP3炎症小体活化的机制。
材料和方法
1 动物与细胞
6周龄的C57BL/6小鼠购自广东省医学实验动物中心,生产许可证号为SCXK(粤)2013-0002,饲养于广东省动物监测所。人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRMECs;cap-0010)购于Angio-Proteomie。
2 主要试剂
小鼠抗人和小鼠NLRP3多克隆抗体(1∶1 000,AG-20B-0014-C100)购自Adipogen;兔抗人NOX4单克隆抗体(1∶1 000,ab133303)、兔抗人Pro Casp-1+p10+p12多克隆抗体(1∶1 000,ab179515)、兔抗人VE-Cad多克隆抗体(1∶1 000,ab333168)及兔抗人和小鼠ZO-1多克隆抗体(1∶1 000,ab59720)购自Ab-cam;Alexa Fluor®488偶联的同工凝集素(isolectin)GS-IB4(1∶5 000,I21411)购自Invitrogen。
3 主要方法
3.1 实验动物模型建立 6周龄的C57BL/6小鼠分为对照(control,Con)组和DM组,分别接受10%脂肪饲料或60%高脂饲料。4周后DM组和Con组小鼠分别用40 mg/kg链脲佐菌素(streptozocin,STZ)和等体积柠檬酸-柠檬酸钠缓冲液腹腔注射,连续注射5 d后随机血糖高于16.7 mmol/L者为糖尿病模型造模成功。
3.2 舒洛地特治疗 造模成功后随即进行为期3个月的药物干预,用随机数法将小鼠分为DM+SDX组、DM+生理盐水(normal saline,NS)组、Con+SDX组及Con+NS组。DM+SDX组和Con+SDX组腹腔注射SDX(10 mg/kg),而DM+NS和Con+NS组腹腔注射等体积生理盐水,每2 d一次,持续12周。
3.3 伊文思蓝尾静脉注射 通过尾静脉给小鼠注射30 mg/kg的伊文思蓝,随后将小鼠静置于37℃热毯上2 h。直接摘取小鼠右侧眼球在4%多聚甲醛中固定15 min后进行铺片,观察视网膜血管渗漏情况(激发波长620 nm,发射波长740 nm)。用37℃的PBS进行心脏灌注后剥离左侧视网膜于甲酰胺中,在冰上超声裂解后于70℃水浴18 h,500 000×g离心45 min,取上清液于620 nm波长检测吸光度(A)。
3.4 HRMECs处理 用125、250、500和1 000 LSU/L(LSU即lipasemic unit,脂酶单位)4个浓度的SDX处理HRMECs 24 h。阴性对照siRNA(si-NC)和沉默NOX4的siRNA(si-NOX4)用于转染HRMECs。对照腺病毒(ad-GFP)和过表达NOX4的腺病毒(ad-NOX4)以MOI=20感染细胞。
3.5 Western blot 上样量30 μg,转膜后用7%的脱脂牛奶室温封闭1 h,TBST洗膜后用I抗孵育8~16 h(I抗稀释比例见“2 主要试剂”),其后用II抗于4℃孵育3 h,洗膜后用ECL法显影,用ImageJ软件分析条带灰度。
3.6 免疫荧光技术 用4%多聚甲醛室温固定切片或细胞10 min,PBST浸洗后用溶于1%BSA的0.2%Triton X-100在室温下固定破膜1 h,再用PBST浸洗;加入I抗,湿盒中4℃孵育过夜;其后用PBST浸洗,加入Alexa Fluor®555偶联或Alexa Fluor®647偶联的荧光II抗室温孵育1 h,浸洗后封片拍摄。
3.7 ROS检测 用DCFH-DA探针试剂盒检测细胞内产生的ROS。细胞种在48孔板或者96孔板里,进行相应处理后,在黑暗中与10 μmol/L的DCFH-DA反应30 min,然后用PBS洗涤两次。随后可在酶标仪和荧光显微镜中检测或观察ROS产生的情况。
4 统计学处理
采用GraphPad Prism软件进行统计学分析,统计结果以均数±标准误(mean±SEM)表示。实验均重复3次及以上。符合正态分布及方差齐性的两组间均数比较采用t检验,多组间均数比较采用单因素方差分析(one-way ANOVA)及 Bonferroni’s post hoc test。不符合正态分布的数据使用秩和检验进行分析。以P<0.05为差异有统计学意义。
结 果
1 SDX减轻糖尿病小鼠视网膜微血管渗漏
DM+NS组与DM+SDX组在SDX治疗前后血糖无显著差异,见图1A。视网膜铺片结果显示,DM+NS小鼠的视网膜微血管渗漏较Con+NS组显著增加,而DM+SDX组的视网膜渗漏较DM+NS组显著减少(P<0.05),见图1B、E。另外,我们发现DM+NS组的微血管密度较Con+NS组下降,而DM+SDX组相比于DM+NS组,微血管密度显著上升(P<0.05),见图1C、F。HE染色结果提示,神经节细胞数量在DM+NS组中显著减少,而DM+SDX组较DM+NS组增多(P<0.05),见图1D、G。
2 SDX减轻糖毒性引起的内皮细胞损伤
Western blot结果显示,ZO-1在DM+NS组小鼠视网膜组织中的表达量下降,而DM+SDX组的ZO-1表达量较DM+NS组显著上升(P<0.05),见图2A。在HRMECs中,高糖刺激明显降低了ZO-1和VE-Cad的表达,而在高糖刺激同时加入SDX的HRMECs中,ZO-1和VE-Cad的表达水平显著提高(P<0.05),见图2B。细胞免疫荧光结果提示,高糖处理的HRMECs之间VE-Cad减少,而SDX与高糖共处理的HREMCs之间VE-Cad表达部分恢复(P<0.05),见图2C。
3 舒洛地特在体内抑制高糖导致的NLRP3炎症小体激活
Western blot结果提示,NLRP3、Pro Casp-1及其活化状态的剪切体(cleaved Casp-1)在DM+NS组中升高,而在DM+SDX组比DM+NS组显著下降(P<0.05),见图3A。NLRP3和GS-IB4共染的视网膜铺片结果显示,NLRP3在视网膜上的表达与GS-IB4高度吻合,提示NLRP3主要在血管内皮中表达;NLRP3在DM+NS组中升高,而在DM+SDX组比DM+NS组下降(P<0.05),见图3B。
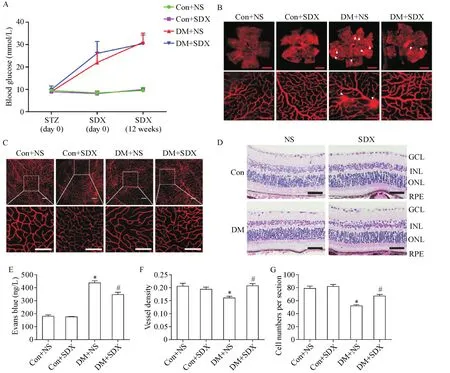
Figure 1.Intraperitoneal injection of sulodexide(SDX)protected diabetic mouse retinas from blood-retina barrier breakdown,vascular leakage,reduction of microvascular density and loss of ganglion cells.A:blood glucose of mice(n=15~20);B and E:representative images(B;the upper scale bar=1 μm;the lower scale bar=100 μm)and quantification(E;n=3) of retinal vascular leakage(indicated by with arrows);C and F:representative images(C;scale bar=25 μm)and quantification(F:n=7~10)of microvascular density.D and G:HE staining of retinal sections at the analogous positon of eyeballs(D;scale bar=25 μm)and quantification of ganglion cell number(G;n=12~18).GCL:ganglion cell layer;INL:inner nuclear layer;ONL:outer nuclear layer;RPE:retinal pigmented epithelium.Mean±SEM.*P<0.01 vs Con+NS group;#P<0.05 vs DM+NS group.图1 SDX治疗减轻糖尿病小鼠视网膜微血管渗漏,提高微血管密度及神经节细胞数
4 SDX在HRMECs中抑制高糖导致的NLRP3炎症小体激活
Western blot结果显示,125 LSU/L的SDX处理对HRMECs的NLRP3和Pro Casp-1表达无明显影响,因此后续实验选用最低有效浓度250 LSU/L处理细胞,见图4A。细胞免疫荧光结果显示,高糖处理下,HRMECs中的NLRP3和NOX4表达都显著升高,而高糖与SDX同时处理的HRMECs中NLRP3和NOX4表达下降;Pearson相关系数统计结果都显示,高糖处理时HRMECs中NLRP3和NOX4的共定位明显增加,在额外添加SDX处理时显著下降(P<0.05),见图4B。
5 SDX在HRMECs中减少NOX4诱导的NLRP3炎症小体活化
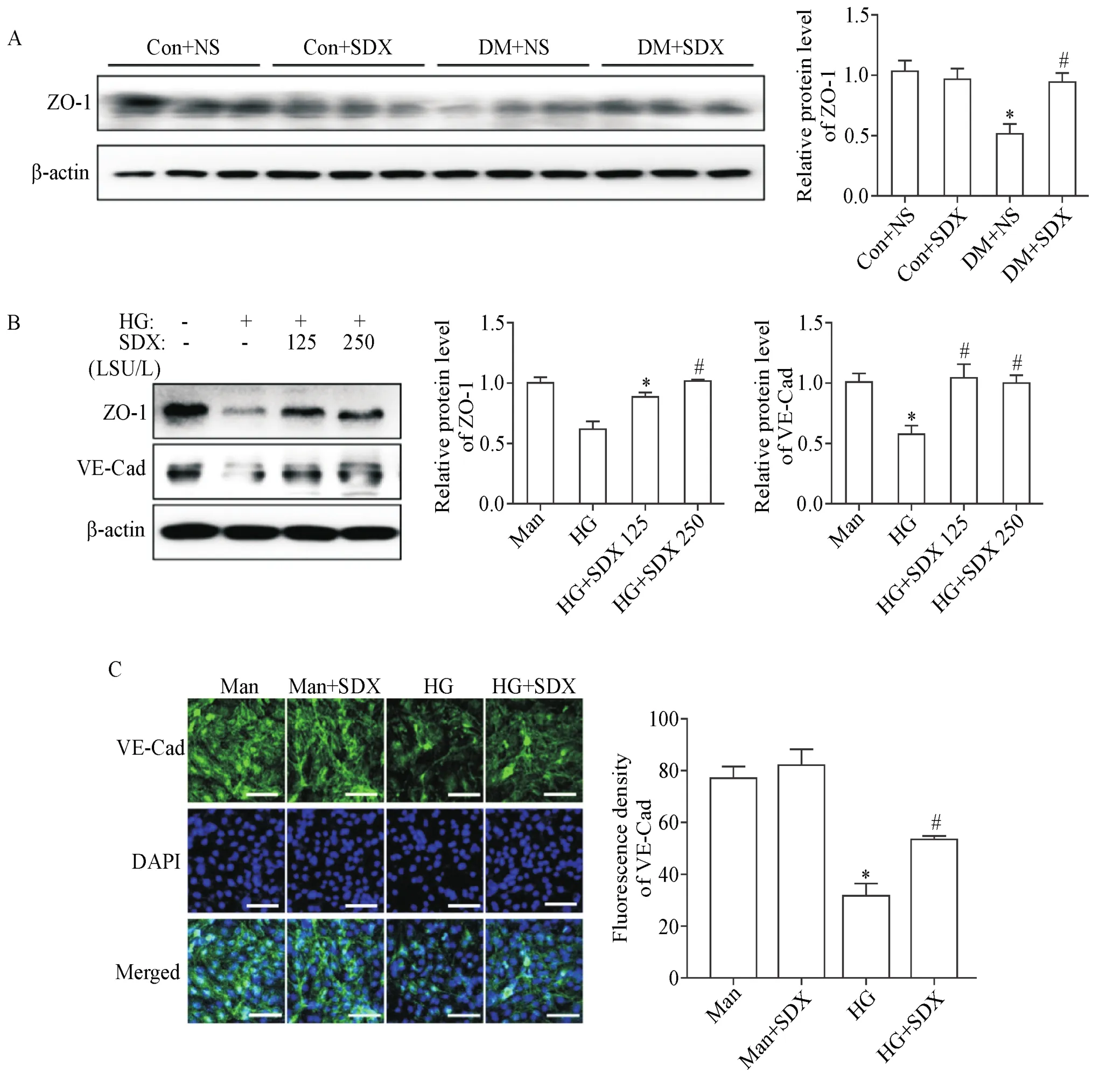
Figure 2.SDX inhibited high glucose(HG)-induced degradation of junction proteins in both diabetic mouse retinas and HRMECs.A:Western blot analysis and densitometry quantification of zonula occludens-1(ZO-1)in retinas;B:Western blot analysis and densitometry quantification of ZO-1 and VE-cadherin(VE-Cad)in HRMECs;C:representative images(scale bar=100 μm)and mean fluorescence density of VE-Cad in HRMECs.Mean±SEM.n=6.*P<0.01 vs Con+NS group or Man(5.5 mmol/L glucose and 24.5 mmol/L mannitol)group;#P<0.05 vs DM+NS group or HG(30 mmol/L glucose)group.图2 SDX在糖尿病小鼠视网膜和HRMECs中均能抑制高糖诱导的连接蛋白降解
Western blot结果显示,高糖处理使HRMECs中NOX4和NLRP3炎症小体组分的表达均增加,其下游分子IL-1β的表达也增加;敲减NOX4后以上蛋白在HRMECs中的表达都显著下降(P<0.05),见图5A。同样,我们观察到无论是在正常糖还是高糖状态,过表达NOX4都引起了NLRP3的表达显著上升,而SDX处理降低了NOX4、NLRP3和cleaved Casp-1蛋白水平(P<0.05),但Pro Casp-1蛋白水平始终没有统计学意义的变化,见图5B。
6 SDX在HRMECs中抑制NOX4介导的ROS生成
ROS在高糖处理下明显增加,而高糖与SDX共处理显著降低了ROS的生成(P<0.05),见图6A、D。敲减NOX4后,ROS的生成显著降低(P<0.05),见图6B、E。相反,过表达NOX4使HRMECs的ROS生成明显升高,而过表达NOX4后再加入SDX处理,ROS的生成显著下降(P<0.05),见图6C、F。
7 SDX在HRMECs中抑制NOX4诱导的连接蛋白降解
在高糖处理下,HRMECs中NOX4表达升高,而ZO-1和VE-Cad都明显下降,而敲减NOX4后,ZO-1和VE-Cad都显著升高(P<0.05),见图7A。相反,过表达NOX4无论是在正常糖还是高糖状态使ZO-1和VE-Cad表达减少,而过表达NOX4后再用SDX处理,则部分抑制了NOX4表达的同时也部分恢复了ZO-1和VE-Cad在 HRMECs中的表达(P<0.05),见图7B。
讨 论
NLRP3炎症小体的激活与DR中内皮细胞的损伤关系密切。本研究实验结果表明,在糖尿病小鼠视网膜中,NLRP3炎症小体的成分显著升高,确证了DR小鼠视网膜的炎症反应。视网膜铺片结果显示NLRP3和血管内皮标志物GS-IB4高度共定位,提示视网膜的NLRP3升高主要是在内皮细胞中,这让我们更加确信NLRP3炎症小体的激活与DR中内皮功能的损伤及血管渗漏有关。
多个研究表明高糖刺激可以诱发内皮细胞的氧化应激和炎症反应[16]。ROS是激活NLRP3炎性小体的重要中间分子[17]。在糖尿病状态下,NOX4产生的ROS可以引起内皮损伤,使用抗氧化剂或NOX抑制剂抑制了糖尿病小鼠的视网膜渗漏[18],提示NOX/ROS对DR的血管渗漏有负面影响。我们的研究提示NOX4/ROS可以激活NLRP3炎症小体,而抑制ROS可减轻由IL-1β引起的炎症反应[19]。我们认为在高糖刺激下,HRMECs的炎症反应至少有一部分要归咎于NOX4/ROS/NLRP3通路的激活,同时本研究也为NLRP3及其下游、NOX4等作为DR治疗的靶点提供了依据。

Figure 4.SDX inhibited high glucose(HG)-induced NLRP3 inflammsome activation in HRMECs.A:Western blot analysis and densitometry quantification of NOX4,NLRP3,procaspase-1(Pro Casp-1)and cleaved caspase-1(cleaved Casp-1);B:representative images(scale bar=25 μm)and colocalization ratio of immunofluorescence staining of NOX4 and NLRP3.Mean±SEM.n=3.*P<0.01 vs Man group;#P<0.05 vs HG group.图4 在HRMECs中,SDX抑制高糖诱导的NLRP3炎症小体激活
内皮细胞是通过连接蛋白,如ZO-1和VE-Cad等相互衔接的,内皮细胞间的连接对于维持内皮通透性非常重要[20]。研究表明,NLRP3炎症小体的激活会导致内皮间连接蛋白的降解[21]。与报道一致,我们在糖尿病小鼠中观察到了ZO-1的降低,在高糖处理的HRMECs中观察到了ZO-1和VE-Cad的降低,与NLRP3的变化呈相反趋势。有研究提示IL-1β降低了血管内皮细胞之间ZO-1和claudin-5的黏附强度,导致血管通透性增加[22],因此IL-1β也许是研究NLRP3与ZO-1等内皮细胞间连接蛋白关系的切入点。总之,NOX4/ROS/NLRP3通路的抑制对DR具有保护作用。

Figure 5.SDX inhibited NOX4-induced NLRP3 inflammsome activation in HRMECs.Western blot analysis and densitometry quantification of NOX4,NLRP3,procaspase-1(Pro Casp-1)and cleaved caspase-1(cleaved Casp-1)were shown.A:the cells were treated with 5.5 mmol/L glucose and 24.5 mmol/L mannitol(Man)+negative control siRNA(si-NC),Man+NOX4 siRNA(si-NOX4),30 mmol/L glucose(HG)+si-NC or HG+si-NOX4;B:the cells were treated with Man+control adenovirus(Ad-GFP),Man+adenovirus carrying NOX4 gene(Ad-NOX4),Man+Ad-NOX4+SDX,HG+Ad-GFP,HG+Ad-NOX4 or HG+Ad-NOX4+SDX.Mean±SEM.n=3.*P<0.05 vs Man+si-NC group;#P<0.05 vs HG+si-NC group;△P<0.05 vs Man+Ad-GFP group;▲P<0.05 vs HG+Ad-GFF group;+P<0.05 vs HG+Ad-NOX4 group.图5 在HRMECs中,SDX抑制NOX4诱导的NLRP3炎症小体激活
研究报道减少ROS可减轻糖尿病的症状[23];NOX家族也被视为治疗DR的靶点之一[24]。SDX既往被报导具有抑制炎症和抗氧化的作用,具体机制未阐明[25]。而我们的研究结果表明,SDX干预可抑制由高糖引起的NOX4/ROS/NLRP3通路激活,从而保护内皮间连接蛋白;动物实验也表明,SDX干预显著减少糖尿病小鼠视网膜渗漏。此外,神经节细胞在DR中降解也是损害视力的原因之一,我们在糖尿病小鼠中观察到SDX抑制了由糖尿病引起的节细胞数量下降,提示SDX不仅对HRMECs有保护作用,可能还对视网膜中其他的细胞有保护作用。因此,SDX可以被考虑用作治疗DR。但是,SDX作为糖萼保护剂是否直接作用于NOX4仍有待研究。
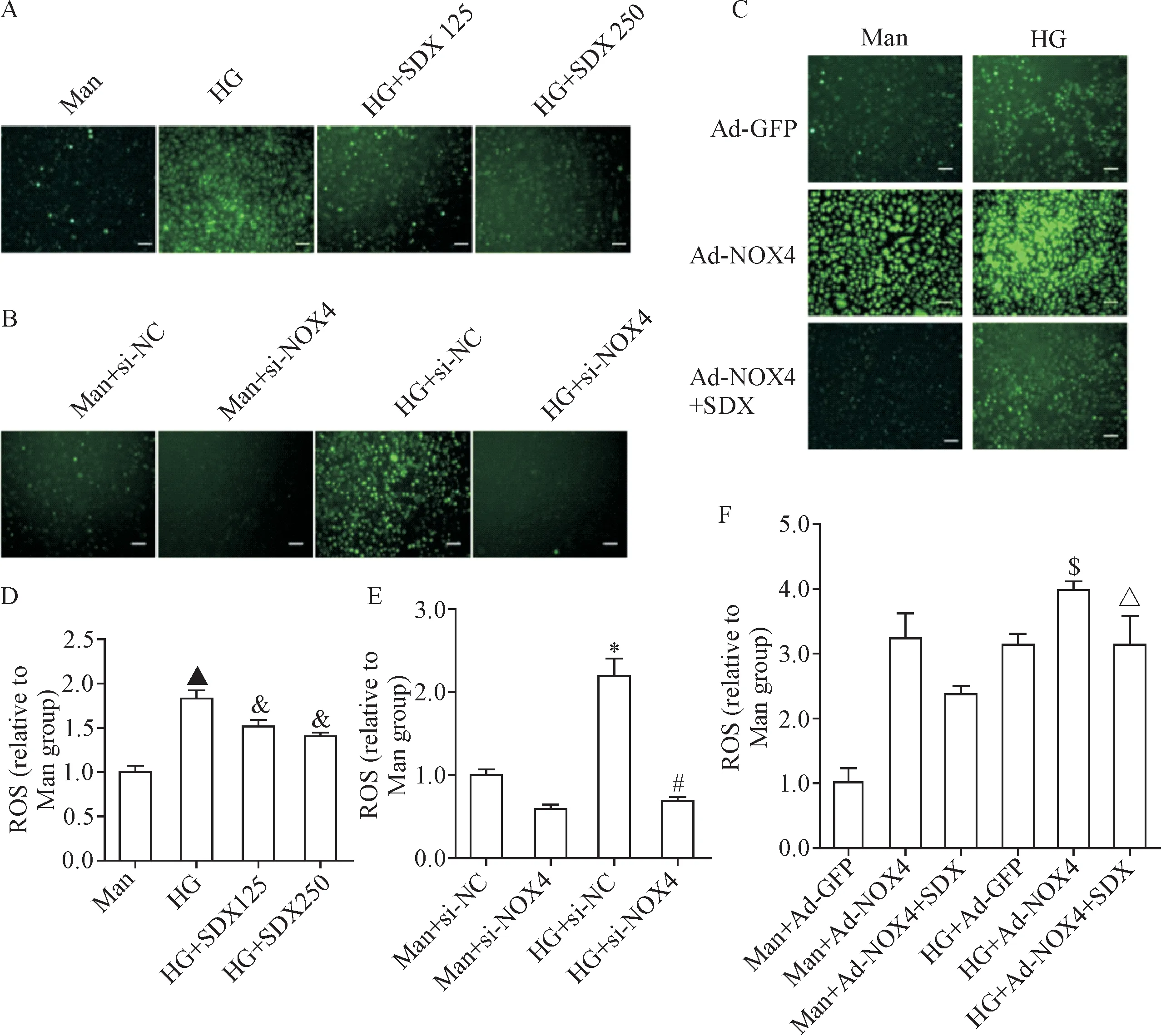
Figure 6.SDX inhibited NOX4-mediated ROS generation in HRMECs.The representative images and quantification of ROS generation were shown.A and D:the cells were treated with 5.5 mmol/L glucose and 24.5 mmol/L mannitol(Man),30 mmol/L glucose(HG),HG+125 LSU/L SDX(SDX125)or HG+250 LSU/L SDX(SDX250);B and E:the cells were treated with Man+negative control siRNA(si-NC),Man+NOX4 siRNA(si-NOX4),HG+si-NC or HG+si-NOX4;C and F:the cells were treated with Man+control adenovirus(Ad-GFP),Man+adenovirus carrying NOX4 gene(Ad-NOX4),Man+Ad-NOX4+SDX,HG+Ad-GFP,HG+Ad-NOX4 or HG+Ad-NOX4+SDX.Mean±SEM.n=5.▲P<0.05 vs Man group;&P<0.05 vs HG group;*P<0.05 vs Man+si-NC group;#P<0.05 vs HG+si-NC group;$P<0.05 vs HG+Ad-GFP group;△P<0.05 vs HG+Ad-NOX4 group.图6 在HRMECs中,SDX抑制NOX4介导的ROS生成
综上所述,本研究发现SDX通过抑制NOX4/ROS/NLRP3通路减轻HRMECs的氧化应激反应和炎症反应,从而保护连接蛋白ZO-1和VE-Cad,以减轻DR中的微血管渗漏(图8)。本研究为SDX应用于DR治疗提供了新的证据。

Figure 7.SDX attenuated NOX4-induced damage of junction proteins in HRMECs.Western blot analysis and densitometry quantification of NOX4,ZO-1 and VE-Cad were shown.A:knockdown of NOX4;B:over-expression of NOX4.Mean±SEM.n=3.*P<0.05 vs Man+si-NC group;#P<0.05 vs HG+si-NC group;△P<0.05 vs Man+Ad-GFP group;▲P<0.05 vs HG+Ad-GFF group;&P<0.05 vs HG+Ad-NOX4 group.图7 在HRMECs中,SDX通过抑制NOX4减少高糖对连接蛋白的损伤

Figure 8.A proposed schematic diagram of how sulodexide(SDX)protects human retinal microvascular endothelial cells(HRMECs)with high glucose stimulation.NADPH oxidase 4(NOX4)-derived reactive oxygen species(ROS)facilitate the activation of nucleotide-binding oligomerization domain-like receptor protein 3(NLRP3)inflammasome and further destroy zonula occludens-1(ZO-1)and VE-cadherin(VE-Cad)after high glucose treatment.Our study indicates that SDX suppresses expression of NOX4,thus inhibiting NOX4-derived ROS and NOX4-induced NLRP3 activation.Our study also provides evidence that SDX protects ZO-1 and VE-Cad in response to glucotoxicity or NOX4 over-expression.This suggests that SDX may alleviate leakage in diabetic retinas via inhibiting NOX4/ROS/NLRP3 pathway.ASC:apoptosis-associated speck-like protein containing a caspase recruitment domain;Casp-1:caspase-1;IL-1β:interleukin-1β.图8 SDX保护HRMECs的示意图
