SIRT1/AMPK通路在利拉鲁肽早期干预缓解高脂饮食导致的大鼠非酒精性脂肪性肝病中的作用*
2020-05-26何航辉吴宸炜王声遥徐燕娉
陈 霞,何航辉,苏 悦,吴宸炜,洪 莹,庄 飞,王声遥,徐燕娉,郑 超
(温州医科大学附属第二医院内分泌科,浙江温州325000)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指除外酒精和其它明确的肝损害因素导致的、以肝细胞内脂肪大量沉积为主要特征的临床病理综合征[1]。近年来,NAFLD的发病率呈现逐年升高的趋势[2]。我国NAFLD的患病率大约为27%,已经超过2型糖尿病11.6%的发病率,且近年来有低龄化表现。如何防治NAFLD已成为我国及全球人口共同面临的巨大挑战[3]。沉默信息调节因子1(silent information regulator 1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖性蛋白质脱乙酰酶,同时也是机体重要的能量稳态调节因子[4-5]。有研究显示SIRT1基因缺失的小鼠与野生型小鼠在相同条件下进行高脂喂养,前者的肝脏脂肪变更加严重,而肝脏过表达SIRT1可减轻内质网应激及胰岛素抵抗[6]。SIRT1下游靶点——AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)[7-10]的激活能通过调节固醇调节元件结合蛋白1c(sterol regulatory element binding protein-1c,SREBP-1c)、乙酰辅酶A羧化酶(acetyl coenzyme A carboxylase,ACC)和脂肪酸合成酶(fatty acid synthase,FAS)等调控脂质合成与代谢的关键调控分子,从而抑制脂肪酸的合成和脂质积累[5-6]。利拉鲁肽(liraglutide,Lira)是人工合成的胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)受体激动剂之一,它可以刺激葡萄糖依赖性胰岛素分泌,抑制胰高血糖素分泌,延迟胃排空,降低食欲,增加β细胞数量,从而达到降低血糖的效果[11-12],但其在治疗NAFLD中的作用还不完全明确。本课题组先前在研究利拉鲁肽早期干预改善肥胖大鼠骨骼肌微循环并减轻骨骼肌胰岛素抵抗的时候观察到,用药组大鼠肝脏的病理学形态学改善明显,且第172位苏氨酸磷酸化的AMPK[phosphorylated AMPK at Thr172,p-AMPK(Thr172)]被激活,由此我们设计了本次实验,以高脂饮食(high-fat diet,HFD)喂养大鼠18周建立大鼠NAFLD模型,用以探究利拉鲁肽早期干预对NAFLD大鼠的影响及SIRT1/AMPK及其下游通路在其中的作用。
材料和方法
1 动物
SPF级6周龄雄性SD大鼠24只,体重(160±10)g,购自上海斯莱克实验动物有限责任公司,许可证号为SCXK(沪)2017-0005,饲养在温州医科大学实验动物中心,实验动物获得伦理委员会批准。
2 主要试剂
含60%脂肪的高脂饲料购自江苏美迪森股份有限公司;利拉鲁肽购自Novo Nordisk;麻醉药戊巴比妥钠购自Sigma;兔抗大鼠GLP-1受体抗体购自Proteintech。大鼠血清肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin-6,IL-6)ELISA试剂盒购自上海博蕴生物科技有限公司;丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、总超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)试剂盒购自南京建成生物工程研究所;兔抗大鼠AMPK、p-AMPK(Thr172)、第372位丝氨酸磷酸化的SREBP-1c[phosphorylated SREBP-1c at Ser372,p-SREBP-1c(Ser372)]、第79位丝氨酸磷酸化的ACC[phosphorylated ACC at Ser79,p-ACC(Ser79)]和FAS抗体购自CST;兔抗大鼠SIRT1和肉毒碱棕榈酰转移酶1A(carnitine palmitoyltransferase 1A,CPT1A)抗体购自Aiffinity;兔抗大鼠GAPDH(内参照)抗体购自杭州至贤生物科技有限公司;辣根过氧化物酶标记的山羊抗兔IgG(H+L)购自上海翊圣生物科技有限公司;BCA蛋白浓度试剂盒购自碧云天生物技术研究所。
3 主要方法
3.1 实验分组及处理 所有大鼠适应性喂养1周后,随机分为正常饮食(normal diet,ND)组、HFD组和HFD+Lira组,每组各8只。各组大鼠自由饮水进食,分笼饲养在明暗各12 h、22~26℃的标准动物房内。按不同分组,HFD+Lira组皮下注射利拉鲁肽200 μg/kg,每天1次,其余2组皮下注射等体积0.9%氯化钠注射液。每周记录进食量、体重和血糖,第16周行葡萄糖耐量实验(glucose tolerance test,GTT)。第18周末麻醉后行高胰岛素-正葡萄糖钳夹实验,此实验结束后颈动脉取血,心脏灌流后处死,取肝脏和皮下、内脏及棕色脂肪组织,并称重。
3.2 GTT 大鼠HFD喂养至第16周进行GTT。大鼠过夜禁食,测得0 min空腹血糖。事先配制20%的葡萄糖并称量大鼠体重,按照大鼠每100 g体重1 mL的剂量腹腔注射葡萄糖,随后分别测量30、60、90和120 min的血糖水平。
3.3 高胰岛素-正葡萄糖钳夹实验 第18周开始,大鼠过夜禁食,腹腔注射1.5%戊巴比妥钠(40 mg/kg)麻醉后,使大鼠仰卧于恒温手术台,迅速完成气管插管,颈外动静脉置聚乙烯管(PE-50),动脉通过装有肝素(3×104U/L)生理盐水的微量注射泵连接血压仪,监测血流动力学;静脉通过三通管连接2个微量注射泵,分别注射30%葡萄糖和胰岛30 mU·kg-1·min-1,用强生稳豪血糖仪每10 min测定1次颈动脉血糖,葡萄糖速率逐渐增加使血糖波动在基础血糖±10%以内,最后3次稳态葡糖糖输注率的均值作为此实验的葡萄糖输注率(glucose infusion rate,GIR;mg·kg-1·min-1)。
3.4 HE染色、油红O染色、马松染色、天狼星红染色及ROS荧光染色 取相同部位规则形状的肝组织以4%多聚甲醛固定,石蜡包埋,每组取3个组织,切成5 μm薄片。根据试剂盒说明书行HE染色、马松染色及天狼星红染色,在荧光正置显微镜下进行观察并拍照。肝组织经OCT包埋后,制作冰冻切片,根据试剂盒说明书行油红O染色及ROS染色。
3.5 免疫组织化学染色 石蜡切片,经过脱蜡,水化以及高压抗原修复,PBS洗2次,每次5 min,加3%过氧化氢灭活内源性过氧化物,BSA封闭30 min,PBS漂洗后,置于湿盒,分别加入Ⅰ抗,4℃孵育过夜,PBS漂洗3次,各2分钟。滴加Ⅱ抗,37℃恒温箱孵育1 h,PBS漂洗,DAB显色后,冲洗,苏木素复染,脱水,透明,中性树胶封片,然后正置显微镜下进行观察并拍照。
3.6 血清 TNF-α、IL-6、TC、TG、ALT和AST测定严格按照试剂盒说明书进行以上指标的测定。
3.7 肝组织TC、TG、MDA和SOD测定 取约30 mg肝脏组织,于300 μL生理盐水中剪碎并匀浆;离心后取上清到另一离心管内。检测时严格按照试剂盒说明书操作。
3.8 Western blot 取肝脏组织约30 mg,加入300 μL RIPA裂解液(含100 μmol/L PMSF),用弯眼科剪剪碎组织,使用机械匀浆机匀浆后,12 750×g、4℃离心10 min,取上清;采用BCA法测蛋白浓度。取30 μg蛋白进行SDS-PAGE,湿转法将蛋白条带转移到PVDF膜上;用含5%脱脂奶粉封闭1.5 h后加入Ⅰ抗4℃摇床过夜,用TBST洗膜3次,每次5 min后室温摇床孵育Ⅱ抗1 h,用ECL法显影,通过ChemiDoxTMXRS+凝胶成像系统采集图像,用ImageJ软件进行灰度分析。
4 统计学处理
用Prism 5.0统计软件进行数据处理和分析,所有数据均以均数±标准差(mean±SD)表示。多组间比较用单因素方差分析,两两比较用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 利拉鲁肽降低NAFLD大鼠的体重和肝指数,减少进食量及脂肪积聚
与ND组相比,HFD组大鼠体重、肝指数及进食量显著升高(P<0.01),皮下脂肪和内脏脂肪积聚增加(P<0.05或P<0.01);与HFD组相比,HFD+Lira组大鼠体重、肝指数及进食量显著下降(P<0.01),皮下脂肪和内脏脂肪含量减少(P<0.05或P<0.01);3组的棕色脂肪含量无显著差异,见表1及图1。
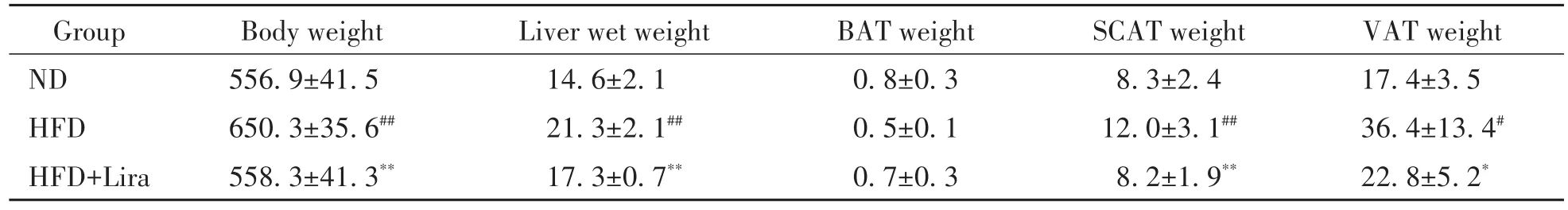
表1 3组大鼠体重、肝湿重、皮下脂肪、内脏脂肪及棕色脂肪重量比较结果Table 1.Body weight,liver wet weight,and the weight of brown adipose tissue(BAT),subcutaneous adipose tissue(SCAT)and visceral adipose tissue(VAT)of the rats in the 3 groups(g.Mean±SD.n=8)
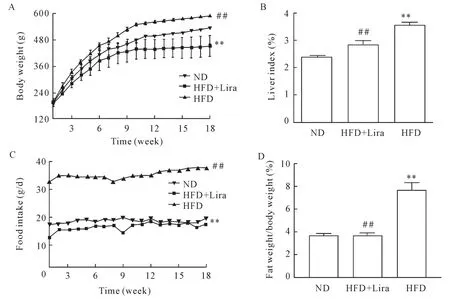
Figure 1.Lira reduced the body wight(A),liver index(B),daily food intake(C)and the ratio of fat weight/body weight(D)of NAFLD rats.Mean±SD.n=8.##P<0.01 vs ND group;**P<0.01 vs HFD group.图1 利拉鲁肽降低NAFLD大鼠的体重、肝指数、每日进食量和体脂比例
2 利拉鲁肽降低NAFLD大鼠空腹血糖,提高糖耐量及胰岛素敏感性
与ND组相比,HFD组大鼠空腹血糖升高(P<0.05或P<0.01);与HFD组相比,HFD+Lira组大鼠空腹血糖下降(P<0.05或P<0.01),见表2。GTT结果显示,与ND组相比,HFD组大鼠存在糖耐量异常(P<0.01);与HFD组相比,HFD+Lira组大鼠糖耐量得到改善(P<0.01),见图2A。高胰岛素-正葡萄糖钳夹实验结果表明,HFD组大鼠GIR为(4.45±0.63)mg·kg-1·min-1,较 ND 组[(11.24±2.15) mg·kg-1·min-1]降 低(P<0.01),HFD+Lira 组[(8.43±1.42)mg·kg-1·min-1]较HFD组升高(P<0.05),见图2B。

表2 3组大鼠第13~18周的空腹血糖水平Table 2.The fasting blood glucose levels of rats in each group in the 13th~18th weeks(mmol/L.Mean±SD.n=8)

Figure 2.Lira improved glucose tolerance and attenuated insulin resitance of NAFLD rats.A:the results of glucose tolerance test;B:the results of hyperinsulinemic euglycemic clamp test.AUC:area under curve;GIR:glucose infusion rate.Mean±SD.n=8.##P<0.01 vs ND group;*P<0.05,**P<0.01 vs HFD group.图2 利拉鲁肽改善NAFLD大鼠的葡萄糖耐量,减轻胰岛素抵抗
3 利拉鲁肽降低NAFLD大鼠的血脂,氧化应激及炎症水平
实验结束时,与ND组相比,HFD组大鼠血清TG、TC、ALT、AST、IL-6和TNF-α升高,肝组织TG、TC和MDA升高,SOD降低(均P<0.01);与HFD组相比,HFD+Lira组大鼠血清TG、TC、ALT、AST、IL-6和TNF-α降低(P<0.05或P<0.01),肝组织TG、TC和MDA降低(P<0.01),SOD升高(P<0.05),见表3、4。相对于ND组,HFD组大鼠肝组织ROS荧光强度升高(P<0.05或P<0.01);与HFD组相比,HFD+Lira组ROS荧光强度降低(P<0.05或P<0.01),见图3。

表3 三组大鼠血清相关指标的比较Table 3.The serum related indexes in the rats of each group(Mean±SD.n=8)

表4 3组大鼠肝组织相关指标的比较Table 4.The liver tissue related indexes in the rats of each group(Mean±SD.n=8)

Figure 3.Lira attenuated ROS production in the liver of the NAFLD rats.A:DCFH-DA staining;B:DHE staining.Mean±SD.n=8.#P<0.05,##P<0.01 vs ND group;*P<0.05,**P<0.01 vs HFD group.图3 利拉鲁肽减少NAFLD大鼠肝脏ROS的产生
4 利拉鲁肽改善NAFLD大鼠肝脏结构紊乱,减轻脂质蓄积及纤维化等病理变化
HE染色可见,ND组大鼠肝小叶结构清晰完整,肝细胞排列整齐,无明显病变,肝细胞内未见脂质沉积;而HFD组大鼠肝脏结构紊乱,可见弥漫性肝细胞大泡或小泡性的脂肪变性;在给予利拉鲁肽治疗后,肝细胞内的脂滴减少,且大部分肝细胞接近正常形态,见图4A。油红O染色结果显示,ND组大鼠肝组织无显著脂滴沉积,HFD组大鼠肝脏中有大量脂滴沉积,HFD+Lira组大鼠肝组织脂滴沉积较HFD组明显减少(均P<0.01),见图4B。马松及天狼星红染色显示,HFD组胶原纤维较ND组增多,在应用利拉鲁肽后,胶原纤维较HFD组显著减少(均P<0.01),见图5。
5 利拉鲁肽增加NAFLD大鼠肝脏GLP-1受体的表达
与ND组相比,HFD组大鼠肝脏GLP-1受体表达降低,应用利拉鲁肽后GLP-1受体表达上调(均P<0.01),见图6。
6 肝脏免疫组化染色显示利拉鲁肽可增加肝脏SIRT1与p-AMPK(Thr172)表达
免疫组化染色结果显示,与ND组相比,HFD组肝脏的SIRT1和p-AMPK(Thr172)表达量减少,而利拉鲁肽治疗组肝脏SIRT1与p-AMPK(Thr172)的表达上调(P<0.01),见图7。
7 利拉鲁肽对各组大鼠肝脏脂质代谢相关蛋白和SIRT1/AMPK通路的影响
Western blot结果显示,相对于ND组,HFD组的SIRT1、p-AMPK(Thr172)、p-SREBP-1c(Ser372)、p-ACC(Ser79)和CPT1A蛋白水平降低(P<0.05或P<0.01),FAS表达增加(P<0.01);与 HFD 组相比,HFD+Lira组的FAS表达明显减少(P<0.01),SIRT1、p-AMPK(Thr172)、p-SREBP-1c(Ser372)、p-ACC(Ser79)和CPT1A蛋白水平显著升高(P<0.05或P<0.01),见图8。
讨 论
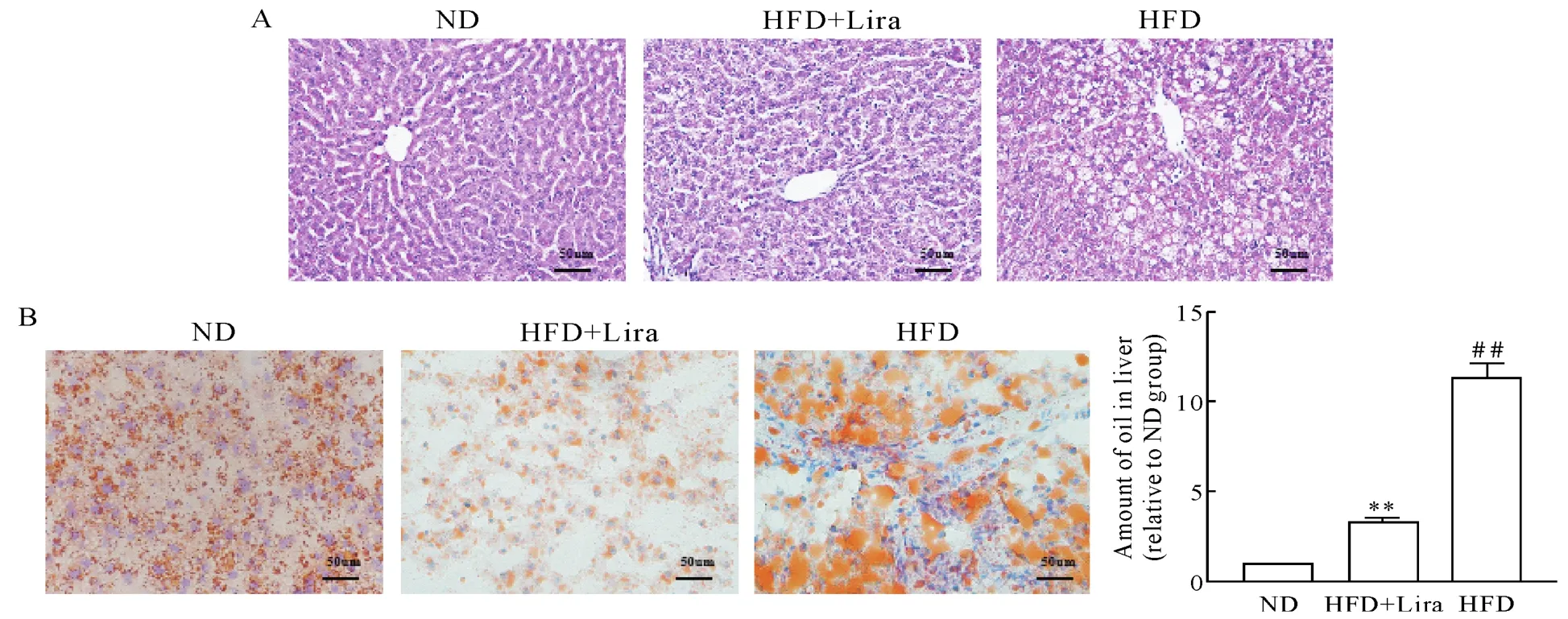
Figure 4.Lira attenuated liver tissue structural disorder and lipid accumulation in rats with NAFLD.A:HE staining;B:oil red O staining.Mean±SD.n=8.##P<0.01 vs ND group;**P<0.01 vs HFD group.图4 利拉鲁肽减轻NAFLD大鼠肝组织结构紊乱和脂质蓄积
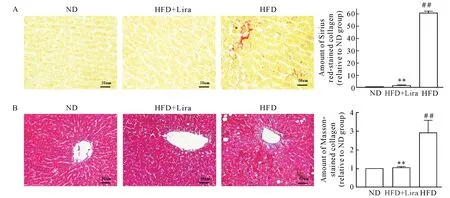
Figure 5.Lira attenuated liver fibrosis of rats with NAFLD.A:Sirius red staining;B:Masson staining.Mean±SD.n=8.##P<0.01 vsND group;**P<0.01vsHFD group.图5 利拉鲁肽减轻NAFLD大鼠肝脏纤维化

Figure 6.Lira increased the expression of GLP-1 receptor in the liver of rats with NAFLD(immunofluorescence staining).Mean±SD.n=8.##P<0.01 vs ND group;**P<0.01 vs HFD group.图6 利拉鲁肽增加NAFLD大鼠肝脏GLP-1受体的表达

Figure 7.Lira stimulated the expression of SIRT1(A)and p-AMPK(Thr172)(B)in the liver of NAFLD rats(immunohistochemical staining).Mean±SD.n=8.##P<0.01 vs ND group;**P<0.01 vs HFD group.图7 免疫组化染色显示利拉鲁肽可增加NAFLD大鼠肝脏SIRT1与p-AMPK(Thr172)的表达

Figure 8.Relative protein levels of SIRT1,p-AMPK(Thr172),p-SREBP-1c(Ser372),p-ACC(Ser79),CPT1A and FAS in hepatic tissues of rats in different groups were detected by Western blot.A:Lira increased the protein levels of SIRT1,p-AMPK(Thr172),p-SREBP-1c(Ser372)and p-ACC(Ser79);B:Lira increased CPT1A expression,but attenuated FAS expression.Mean±SD.n=8.#P<0.05,##P<0.01 vs ND group;*P<0.05,**P<0.01 vs HFD group.图8 Western blot显示利拉鲁肽可增加 NAFLD 大鼠肝脏 SIRT1、p-AMPK(Thr172)、p-SREBP-1c(Ser372)、p-ACC(Ser79)及CPT1A的表达,减少FAS的表达
NAFLD是一个全球性的公共卫生问题,但它的发病原因和机理尚未完全明确[13-14]。目前,“多重打击”学说占主导地位。这一学说认为:胰岛素抵抗和高浓度游离脂肪酸为初次打击,是NAFLD发生的必要因素;ROS导致的肝细胞氧化应激损伤及相关事件为第2次打击,引起肝脏发生炎症反应和纤维化;第3次打击主要是氧化应激持续存在。可见,氧化应激是其发展的关键[15-16]。本研究在结合“多重打击”学说及课题组前期研究的基础上,采用60%的高脂饲料造模,喂养过程中监测大鼠空腹血糖、体重及糖耐量状态,大鼠处死前以钳夹试验评估大鼠胰岛素抵抗情况。后续研究主要从利拉鲁肽减轻脂质沉积、氧化应激、炎症及纤维化方面展开。结果显示,模型组大鼠脂质代谢异常,内脏和皮下脂肪积聚,肝组织结构紊乱,空腹血糖和摄食量增加,葡萄糖耐量受损,出现胰岛素抵抗,这作为“初次打击”,是NAFLD发生的源头。此外,模型组IL-6和TNF-α等炎症因子水平升高,肝纤维化显著增加。ROS、SOD和MDA是公认的监测氧化应激的生物标志,而氧化应激损伤是NAFLD发生发展的重要因素之一[13,17]。我们的结果显示,模型组MDA和ROS水平升高,SOD水平降低,提示氧化应激水平升高,这与该学说提出的“二次打击”结论相一致[18]。早期进行利拉鲁肽治疗可控制大鼠食欲,降低体重与空腹血糖,减轻胰岛素抵抗、肝脏纤维化、炎症与氧化应激。可见,利拉鲁肽对于NAFLD发生发展过程中的“多重打击”有显著抑制作用,这可能是利拉鲁肽缓解NAFLD的主要机制。利拉鲁肽是一种GLP-1受体激动剂,本次研究还检测了各组大鼠肝脏GLP-1受体的表达情况。我们观察到肝脏组织存在GLP-1受体,且在高脂喂养时GLP-1受体在肝组织的表达下调。机体在高脂饮食下GLP-1受体发生下调,可能是餐后高血糖或者肝脏胰岛素抵抗发生的原因之一[19]。经利拉鲁肽早期干预后GLP-1受体表达量可有所恢复,这可能是利拉鲁肽对抗NAFLD的另一重要机制。
近年来,SIRT1在NAFLD中的作用已成为研究的热点。SIRT1能显著降低体内ROS的水平并改善氧化应激条件下细胞的存活状态[13]。为了进一步探讨利拉鲁肽缓解NAFLD的机制,我们研究了它对SIRT1/AMPK通路的作用。HFD可以降低肝脏SIRT1的表达,肝内过表达SIRT1可防止由HFD引起的肝脏脂质代谢损伤[20-21]。利拉鲁肽缓解NAFLD可能是通过激活SIRT1来实现的。本研究结果显示,在HFD导致的NAFLD大鼠中,肝脏SIRT1表达量下降,而利拉鲁肽治疗后,SIRT1表达量显著升高,这与文献报道结果一致[22-25],显示SIRT1在NAFLD中起调控作用。SIRT1的下游分子AMPK[26]是广泛分布于生物体内的高度保守的蛋白激酶,具有抗氧化应激、抗炎、抗增殖和抗凋亡等多种生物学作用,可从多途径影响脂质代谢,包括抑制脂肪酸与甘油三酯的合成,抑制胆固醇的合成、促进脂肪酸氧化分解等[27]。在肝脏中,AMPK通过磷酸化调节脂质代谢[28-29]。p-AMPK(Thr172)可抑制肝脏脂质从头合成[30]。SREBP-1c、ACC、FAS等是调控脂质合成与代谢的关键调控分子[4],在NAFLD的发生发展中起着重要作用。在本研究中,HFD导致的NAFLD大鼠肝组织 p-AMPK(Thr172)、p-SREBP-1c(Ser372)及p-ACC(Ser79)蛋白水平降低,FAS表达量增加;经利拉鲁肽干预后ACC等的磷酸化增加,FAS表达减少。AMPK的Thr172磷酸化激活可导致SREBP-1c的Ser372磷酸化,抑制了核SREBP-1c表达,降低FAS的表达,减缓肝脏脂肪变性,而且肝脏激活的p-AMPK(Thr172)可以直接使ACC的Ser79磷酸化而失活[13,29,31]。此外,我们检测到 HFD 组肝脏 CPT1A表达量减少,经利拉鲁肽早期处理后CPTIA表达增多。CPT1A是脂肪酸β氧化的限速酶[32-33],在肝脏的活性较其他组织强,其介导的脂肪酸β氧化是通过将脂肪酸在细胞内的长链酯酰CoA催化为长链酯酰肉毒碱,继而转运进入线粒体,进行氧化供能,而ACC可通过变构调节抑制CPT1A,从而抑制活性脂肪酸进入线粒体氧化[34]。总之,我们的研究结果提示利拉鲁肽可能通过激活SIRT1/AMPK通路,调节脂质合成与代谢的关键调控分子,抑制脂肪酸从头合成,从而在缓解HFD导致的NAFLD中发挥重要作用,但是更深的机制需采用SIRT1基因敲除鼠及细胞或者分子层面的进一步研究来揭示。
综上所述,利拉鲁肽早期干预可降低血糖,抑制脂肪合成,减轻胰岛素抵抗、炎症、纤维化及氧化应激损伤,从而缓解NAFLD,这可能与SIRT1/AMPK及其下游基因的激活有关。这一结果显示了利拉鲁肽作为治疗NAFLD潜在药物以及SIRT1作为潜在治疗靶点的可能性。
