热疗联合放化疗治疗局部晚期非小细胞肺癌的临床效果
2020-05-25赵凯王志武杨俊泉
赵凯 王志武 杨俊泉

[摘要] 目的 观察热疗联合放化疗治疗局部晚期非小细胞肺癌(NSCLC)的临床效果及其对生存的影响。 方法 选取2015年1月~2017年1月唐山市人民医院放化疗科收治的110例局部晚期NSCLC患者,采用随机数字表法将其分为观察组和对照组,每组55例。观察组给予同步放化疗联合热疗治疗,对照组给予同步放化疗治疗。比较两组近期疗效、毒副作用发生情况以及远期生存情况。 结果 观察组有效率明显高于对照组,差异有统计学意义(P < 0.05)。两组患者放射性食管炎、放射性肺炎、骨髓抑制、放射性皮炎发生率比较,差异无统计学意义(P > 0.05);观察组2年累积生存率高于对照组,差异有统计学意义(P > 0.05)。 结论 热疗联合放化疗治疗局部晚期NSCLC的近期效果确切,与单纯放化疗比较提高了生存率。
[关键词] 非小细胞肺癌;放疗;化疗;热疗
[中图分类号] R734.2 [文献標识码] A [文章编号] 1673-7210(2020)04(b)-0084-04
Clinical effect of hyperthermia combined with chemoradiotherapy in the treatment of locally advanced non-small cell lung cancer
ZHAO Kai WANG Zhiwu YANG Junquan
The First Department of Chemoradiotherapy, Tangshan People′s Hospital, Hebei Province, Tangshan 063000, China
[Abstract] Objective To observe the clinical effect of hyperthermia combined with radiotherapy and chemotherapy in the treatment of locally advanced non-small cell lung cancer (NSCLC) and its effect on survival. Methods A total of 110 patients with locally advanced NSCLC admitted to the Chemoradiot Department of Tangshan People′s Hospital from January 2015 to January 2017 were selected. They were divided into the observation group and the control group by random number table method, with 55 cases in each group. The observation group received synchronous radiotherapy and chemotherapy combined with hyperthermia, and the control group received synchronous radiotherapy and chemotherapy. The short-term efficacy, incidence of toxic and side effects and long-term survival of the two groups were compared. Results The effective rate of the observation group was significantly higher than that of the control group, and the difference was statistically significant (P < 0.05). There was no statistically significant difference in the incidence of radiation esophagitis, radiation pneumonia, myelosuppression and radiation dermatitis between the two groups (P > 0.05). The 2-year cumulative survival rate of the observation group was higher than that of the control group, and the difference was statistically significant (P > 0.05). Conclusion The short-term efficacy of hyperthermia combined with radiotherapy and chemotherapy in the treatment of locally advanced NSCLC is accurate, and the survival rate is improved compared with that of radiotherapy and chemotherapy alone.
[Key words] Non-small cell lung cancer; Radiotherapy; Chemotherapy; Hyperthermia
肺癌是世界上发病率和死亡率最高的恶性肿瘤,全球每年约有160万人死于肺癌,严重威胁着人类的生命健康[1-2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的病理类型,在肺癌病例中的比例高达85%[1]。早期NSCLC患者可采取手术治疗,预后较好,5年生存率为70%~90%[3]。然而,NSCLC早期不易察觉,75%的患者在确诊时已处于局部晚期,失去了手术治疗的最佳时机。目前,同期放化疗可以缓解不可手术的局部NSCLC患者的病情,但5年生存率仅为5%,而且局部失控和远处转移给治疗带来了巨大的困难[4]。热疗是一种绿色疗法,可以利用肿瘤组织的血管发育异常,迂曲畸形不易带走肿瘤内热量的缺陷来提升肿瘤内热量从而直接杀死肿瘤细胞。更重要的是热疗在一定程度上可以促进瘤内血液循环,提升瘤内血氧浓度,改善肿瘤乏氧状态,从而提升肿瘤的放疗敏感性。一项来自国内的临床研究发现热疗与放疗联合可改善局部晚期NSCLC的疗效,而且安全性较好[5]。局部晚期NSCLC的标准治疗是放化疗同期治疗,现推测在标准治疗的基础上联合热疗同样可改善患者的治疗效果及生存。因此,本研究通过前瞻性的观察热疗联合放化疗对比单纯放疗治疗局部晚期NSCLC的临床效果来验证此假说,现报道如下:
1 资料与方法
1.1 一般资料
选取2015年1月~2017年1月河北省唐山市人民医院放化疗科收治的局部晚期NSCLC患者110例为观察对象。纳入标准:经病理组织学和/或细胞学检查确诊为NSCLC(鳞状细胞癌、腺癌、大细胞癌/大细饱神经内分泌癌、非特指型NSCLC);年龄≥18岁;经影像学(CT或PET-CT)分期为ⅢA期或ⅢB期;卡氏功能状态评分 ≥60分,近半年体重下降<10%;预计生存期>3个月;入组前有最近4周的胸部CT片,有可测量的病灶;主要器官的功能正常,心、肝、肾及血液系统功能基本正常,化验指标达到以下要求:血液:白细胞>4.0×109/L,中性粒细胞绝对值>1.5×109/L,血红蛋白>110 g/L,血小板计数>100×109/L;肝功能:血胆胆红素<1.5×最大正常值(ULN),谷丙转氨酶、谷草转氨酶<1.5×ULN,血尿素氮、肌酐值正常范围,肺功能:1 s用力呼气容积(FEV1)>1 L或者FEV1>40%预计值,一氧化碳弥散量 >30%预计值;患者及家属均知情,并自愿签署知情同意书。排除标准:既往有恶性肿瘤史,或接受过任何抗肿瘤治疗者;放疗、化疗及热疗禁忌者;可行手术治疗;妊娠期和哺乳期妇女。
1.2 治疗方法
将纳入观察的110例患者按随机数字表法分为观察组和对照组,每组55例。观察组经热疗联合同期放化疗进行治疗,对照组经同期放化疗进行治疗,两组患者同期放化疗治疗方案相同。化疗采用紫杉醇(海口市制药厂有限公司,生产批号:12170501)175 mg/m2,卡铂(齐鲁制药有限公司,生产批号:WB2J1610025)曲线下面积AUC=5,均每个周期第1天静点,21 d为1个周期,共进行4~6个周期的治疗。
应用6MV-X射线进行放射治疗,CT模拟定位后勾画靶区,GTV为模拟定位CT上显示的胸内病变,包括原发灶和转移淋巴结,基于治疗前胸平扫加增强CT、PET-CT或纤维支气管镜等检查结果明确GTV,在肺窗上(窗宽:1600,窗位:-600)勾画肺部原发灶GTV,在纵隔窗(窗宽:400,窗位:20)勾画转移淋巴结,纵隔淋巴结短径≥1 cm判定为阳性。肺内病变范围适当外扩5~8 mm及纵隔受侵淋巴结区域组成CTV,CTV外放5~10 mm构成PTV,应用三维治疗计划系统(Pinnacle)制订计划,常规分割照射进行治疗:2 Gy/次,5次/周,总剂量控制在60~70 Gy,放疗周期为6~7周,放疗设备为美国瓦里安医疗系统公司的Trilogy直线加速器。
热疗采用珠海和佳医疗设备股份有限公司HG-2000型体外高频热疗机,热疗靶区为肺部原发肿瘤区域及纵隔淋巴结转移区域,根据热疗机参数设定肿瘤中心参考温度40~43℃,每次治疗60 min,2次/周,8~12次为1个疗程,治疗1个疗程,与放疗同步开始。
1.3 观察指标
所有患者治疗后均通过面诊及电话进行随访,最长随访期为2年。治疗中每周随访1次,治疗后1年内每2个月随访1次,第2年每3个月随访1次,随访内容包括:每次随访观察并记录两组患者的毒副作用发生情况,包括放射性食管炎、放射性肺炎、骨髓抑制以及放射性皮炎的发生情况,参照RTOG放射损伤分级标准[6]及CTCAE 4.0标准[7]评估放化疗毒性作用;于放疗结束后及每2个周期化疗后进行1次胸腹部CT扫描以评价治疗近期效果,并记录两组患者的总生存时间,评估远期疗效。近期疗效按照实体肿瘤療效评价标准RECIST1.1,其分为完全缓解、部分缓解、稳定、进展,达到完全缓解及部分缓解的患者视为有效[8]。
1.4 统计学方法
采用SPSS 23.0对所得数据进行统计学分析,计量资料以均数±标准差(x±s)表示,采用t检验,计数资料以百分率表示,采用χ2检验或Fisher确切概率法。采用Kaplan-Meier法绘制生存曲线,应用log-rank检验比较两组生存情况。以P < 0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
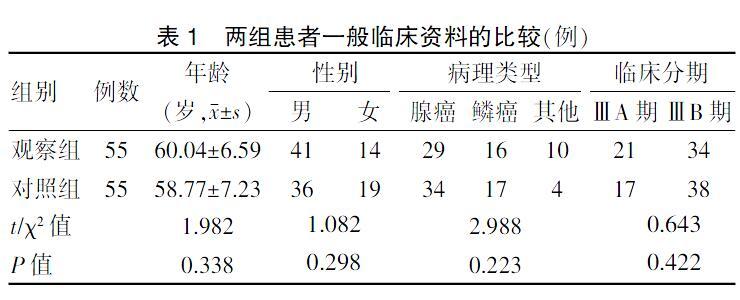
两组患者年龄、性别、病理类型、临床分期比较,差异无统计学意义(P > 0.05),具有可比性。见表1。
表1 两组患者一般临床资料的比较(例)
2.2 两组患者Ⅲ度及以上毒副作用发生比较
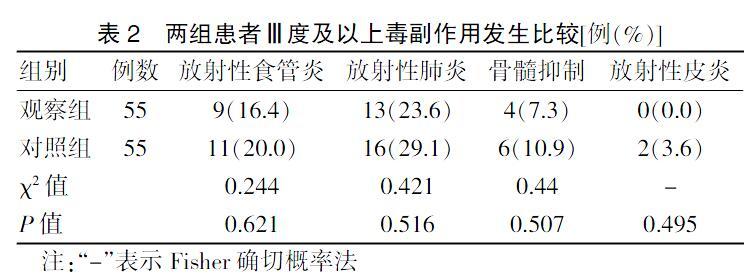
两组患者放射性食管炎、放射性肺炎、骨髓抑制、放射性皮炎发生率比较,差异无统计学意义(P > 0.05)。见表2。
表2 两组患者Ⅲ度及以上毒副作用发生比较[例(%)]
注:“-”表示Fisher确切概率法
2.3 两组患者近期疗效比较
观察组有效率明显高于对照组,差异有统计学意义(P < 0.05)。见表3。
表3 两组患者近期疗效比较[例(%)]
2.4 两组患者生存时间比较
治疗后中位随访时间为14个月,有5例在治疗后8~22个月间先后失访,其中对照组3例,观察组2例。观察组2年累积生存率(23.6%)高于对照组(9.1%),差异有统计学意义(χ2=4.251,P = 0.026)。见图1。至随访结束,排除失访病例,观察组存活11例,共死于肺癌42例;对照组存活4例,共47例死于肺癌,另有1例死于心肌梗死。
图1 两组患者生存时间比较
3 讨论
目前,肺癌是全球患癌症死亡的主因,早诊断早治疗是关键[9]。但是,确诊时已属局部晚期的患者仍占有较高的比例。目前,同步放化疗被公认为治疗局部晚期NSCLC的标准疗法,这主要是因为放疗和化疗两者具有协同作用。放疗能够局部杀死肿瘤细胞,对处于G2/M期的肿瘤细胞较敏感,但对其他细胞周期的肿瘤细胞敏感性较弱,同时放疗对于供血不足导致乏氧状态的肿瘤细胞不敏感;而化疗对于全身的病灶均有杀伤作用,对于细胞周期各阶段的肿瘤细胞均敏感,而且化疗可以增强放疗对肿瘤细胞DNA的损伤作用,两者同步对于局部晚期NSCLC患者的病情起到了缓解作用。尽管如此,局部晚期NSCLC患者的治疗效果并不理想,进行常规放射治疗的患者5年生存率仅为5%~10%,这很大程度上与局部晚期患者,肿瘤的靶区范围较大,不能够给予较高的放疗剂量有关,因此需要寻找新的治疗方法参与到肿瘤的放化疗中来,进一步提高放化疗的疗效,从而提高患者的生存率[10]。
热疗被誉为继手术、放疗、化疗、生物治疗之后的第五大肿瘤治疗方法,该疗法把物理能量积聚于人体的组织内产生热效应,从而可以使肿瘤组织内达到一定的温度,并利用肿瘤组织内血管迂曲,散热不佳而肿瘤细胞不耐热的特点杀灭肿瘤。在1项基础实验中[11],研究者发现热疗与放疗和化疗联合治疗较放化疗联合明显增加人类胶质母细胞瘤细胞的死亡比例,因此提出热疗联合放化疗的治疗模式可能是一种更优的治疗模式。亦有多项临床研究发现与单纯的放化疗比较,热疗联合放化疗对于前列腺癌、卵巢癌、直肠癌、软组织肉瘤等晚期恶性肿瘤的治疗具有良好的效果[12-15]。具体的机制可能是因为热疗自身能够导致细胞的DNA、蛋白质和膜损伤,并且干扰细胞周期以及DNA和蛋白质的合成,从而直接或间接地触发细胞凋亡途径导致细胞凋亡[16]。其次,热疗能够阻碍DNA的修复,以放化疗形成协同作用,增强癌细胞对放化疗导致的DNA损伤的敏感性[17]。同时热疗能够提高肿瘤细胞的局部温度,从而使血流量和供养增加,与化疗产生了协同增强作用[10]。目前免疫治疗的发展很快,有研究发现热疗同样会诱导针对肿瘤的免疫反应,研究在观察荷瘤小鼠接受热疗后的组织切片,发现CD8+ T淋巴细胞介导的抗肿瘤效应明显增强[18]。
本次研究结果显示,实验组和对照组的治疗有效率分别为80.0%、61.8%,可以认为热疗联合放化疗治疗局部晚期NSCLC具有良好的效果(P < 0.05)。而且,与单纯同步放化疗治疗比较,联合热疗的总生存率较高,可以证实热疗联合放化疗可以提高患者的生存时间。在最近发表的两项研究中[19-21],研究者均发现热疗联合同期放化疗较单纯放化疗的有效率明显提高,并且可进一步提高患者生活质量,同时副作用可耐受。这与本研究结果是一致的。
然而,本研究仍有多项缺陷,首先本研究的随访时间为2年,缺乏3~5年生存率的情况,不能判断热疗联合放疗对于长期生存的影响。如前述热疗可以改善肿瘤内部的免疫状态,而免疫治疗的优点之一就是部分患者可以获得长期的生存,因此,继续延长随访时间是非常有必要的。其次本研究是一个单中心的研究,研究结果尚需多中心的随机对照研究来进一步证实。另外,目前热疗的技术进展较快,比如出现了在线自适应热疗技术,即在治疗中根据肿瘤区域的情况调整治疗温度,能够在传统模式上进一步提高疗效[22]。该技术如应用于局部晚期NSCLC可能进一步提高疗效,值得在未来继续探讨。
综上所述,与单纯的放化疗比较,热疗联合放化疗治疗局部晚期NSCLC患者的近期效果确切,而且能够提高患者的生存时间,可以在临床中推广。但是,本次研究的病例数较少,毒副作用观察的类型较少,而且研究时间较短,今后可扩大样本量进一步研究热疗联合放化疗在NSCLC患者的远期效应。
[参考文献]
[1] Herbst RS,Morgensztern D,Boshoff C. The biology and management of non-small cell lung cancer [J]. Nature,2018,553(7689):446-454.
[2] 鄭荣寿,孙可欣,张思维,等.2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2019,41(1):19-28.
[3] Engelhardt KE,Feinglass JM,DeCamp MM,et al. Treatment trends in early-stage lung cancer in the united states,2004 to 2013:A time-trend analysis of the national cancer data base [J]. J Thorac Cardiovasc Surg,2018,156(3):1233-1246.
[4] 吴双,杨泽,张远净,等.局部晚期非小细胞肺癌诱导化疗后同期放化疗与同期放化疗疗效及安全性meta分析[J].中华肿瘤防治杂志,2017,24(1):55-61.
[5] 顾培,吴丹丹,黄灿红.放疗联合热疗对老年局部晚期非小细胞肺癌的效果及安全性观察[J].南通大学学报:医学版,2019,39(3):215-217.
[6] Werner-Wasik M,Paulus R,Curran WJJ,et al. Acute esophagitis and late lung toxicity in concurrent chemoradiotherapy trials in patients with locally advanced non-small-cell lung cancer:Analysis of the radiation therapy oncology group (rtog)database [J]. Clin Lung Cancer,2011, 12(4):245-251.
[7] Chen AP,Setser A,Anadkat MJ,et al. Grading dermatologic adverse events of cancer treatments:The common terminology criteria for adverse events version 4.0 [J]. J Am Acad Dermatol,2012,67(5):1025-1039.
[8] Beaumont H,Bertrand AS,Klifa C,et al. Radiology workflow for recist assessment in clinical trials:Can we reconcile time-efficiency and quality? [J]. Eur J Radiol,2019, 118:257-263.
[9] Vasanthan A,Mitsumori M,Park JH,et al. Regional hyperthermia combined with radiotherapy for locally advanced non-small cell lung cancers:A multi-institutional prospective randomized trial of the international atomic energy agency [J]. Int J Radiat Oncol Biol Phys,2005,61(1):145-153.
[10] 温本,谢美强,颜劲,等.热疗联合同步放化疗在局部晚期非小细胞肺癌中应用[J].广东医科大学学报,2017, 35(6):640-643.
[11] Neshasteh-Riz A,Eyvazzadeh N,Rostami A,et al. Cytogenetic damage from hyperthermia,6 mV X-rays,and topotecan in glioblastoma spheroids,simultaneously,and separately [J]. J Cancer Res Ther,2018,14(6):1273-1278.
[12] Zhang T,Pan Q,Xiao S,et al. Docetaxel combined with intraperitoneal hyperthermic perfusion chemotherapy and hyperthermia in the treatment of advanced ovarian cancer [J]. Oncol Lett,2016,11(5):3287-3292.
[13] Issels RD,Lindner LH,Verweij J,et al. Effect of neoadjuvant chemotherapy plus regional hyperthermia on long-term outcomes among patients with localized high-risk soft tissue sarcoma:The eortc 62961-esho 95 randomized clinical trial [J]. JAMA Oncol,2018,4(4):483-492.
[14] Schlemmer M,Wendtner CM,Lindner L,et al. Thermochemotherapy in patients with extremity high-risk soft tissue sarcomas(hr-sts)[J]. Int J Hyperthermia,2010,26(2):127-135.
[15] Kalapurakal JA,Mittal BB,Sathiaseelan V. Re-irradiation and external hyperthermia in locally advanced,radiation recurrent, hormone refractory prostate cancer:A preliminary report [J]. Br J Radiol,2001,74(884):745-751.
[16] Oei AL,Vriend LE,Crezee J,et al. Effects of hyperthermia on DNA repair pathways:One treatment to inhibit them all [J]. Radiat Oncol,2015,10(1):165.
[17] Yang WH,Xie J,Lai ZY,et al. Radiofrequency deep hyperthermia combined with chemotherapy in the treatment of advanced non-small cell lung cancer [J]. Chin Med J(Engl),2019,132(8):922-927.
[18] Ando K,Suzuki Y,Kaminuma T,et al. Tumor-specific cd8-positive t cell-mediated antitumor immunity is implicated in the antitumor effect of local hyperthermia [J]. Int J Hyperthermia,2018,35(1):226-231.
[19] 赵家棣,苏海龙,曲希侠,等.热疗联合放疗或化疗治疗晚期非小细胞肺癌63例临床分析[J].中华物理医学与康复杂志,2004,26(5):64.
[20] 温本,谢美强,郑文滔,等.热疗联合放化疗治疗局部晚期非小细胞肺癌的临床分析[J].中国癌症防治杂志,2014, 6(2):175-177.
[21] 金倩文.局部晚期非小细胞肺癌治疗现状及趋势[J].疑难病杂志,2019,18(8):860-864.
[22] Kok HP,Korshuize-van Straten L,Bakker A,et al. Online adaptive hyperthermia treatment planning during locoregional heating to suppress treatment-limiting hot spots [J]. Int J Radiat Oncol Biol Phys,2017,99(4):1039-1047.
(收稿日期:2019-09-27 本文編辑:顾家毓)
