群体感应系统介导细菌生物膜形成的研究进展
2020-05-25张天震刘伶普李文超贾士儒
张天震,刘伶普,李文超,贾士儒,钟 成
(天津科技大学 生物工程学院,天津 300457)
细菌生物膜是指细菌通过分泌细胞外聚合物(EPS)形成高度组织化、系统化的膜状结构[1-2]。细菌可借助生物膜增强自身对于环境中多种胁迫、对抗生素的耐受性以及宿主免疫系统攻击抵抗能力。虽然部分微生物生物膜的形成会导致食品腐败变质、致病力增强、加剧耐药形成等负面作用[3],但功能性微生物生物膜具有广阔的应用前景,如细菌纤维素(BC)。BC是一种三维网状结构的胞外纤维素,具有高纯度、高抗张强度、优良的生物适应性等理化性质,在食品、医疗及材料领域广泛使用[4-5]。目前,铜绿假单胞菌(P.aeruginosa)[6]、大肠肝菌(E.coli)[7]、金黄色葡萄球菌(S.aureus)[8]与霍乱弧菌(V.cholerae)[9]等微生物的生物膜形成与群体感应现象间关联已有部分研究。生物膜的形成过程与调控机制复杂,探究群体感应与生物膜之间的关系对降低细菌耐药性、指导食品生产安全以及提高功能性生物膜产量具有现实意义。
1 群体感应系统
Nsalson等[10]在1970年报道了海洋费氏弧菌(Vibriofischeri)的菌体密度与一种夏威夷鱿鱼的生物发光能力成正相关,该现象受细菌的群体感应系统所调节。细菌在生长繁殖过程中会不断生成1种自体诱导物(AI)的化学信号分子。它会随着细菌的细胞种群密度不断增加而同步增长[11],当自体诱导物从细胞内扩散到细胞外,其在细胞外环境中累积达到一定阈值后开启细胞密度依赖的特定基因表达,这种细菌细胞与细胞间的通讯系统即为群体感应(QS)。细菌主要的QS信号分子如表1所示,其调控的生理功能包括生物体的发光、Ti 质粒的接合与转移、生物膜的形成与生长、细菌胞体的分化、抗生素的形成、胞外多糖的生成、病原微生物的毒性、细菌与生物体的共生等[12-15]。由于众多人体或植物病原菌的病理反应受QS系统的调控,且许多微生物代谢产物也受到该机制的介导,QS系统已成为医学、食品科学、生物工程学等多领域的研究热点。

表1 细菌信号分子及作用Table 1 Structure and function of signal molecules in bacteria
1.1 革兰氏阳性菌经典群体感应机制
在革兰氏阳性菌的群体感应系统中,菌体内的前导肽被修饰和加工得到的寡肽类物质(AIPs),即革兰氏阳性菌的信号分子。AIPs类分子具有保守的内酯结构,由C端第5位的半胱氨酸与C末端的氨基酸残基连接而成。与革兰氏阴性菌的信号分子不同,AIPs不能自由地通过细胞膜,必须依赖膜上自诱导肽转运系统或透性酶的协助。革兰氏阳性菌的群体感应机制主要分为两大系统:专一性的ATP-结合盒(ABC) 转运系统[16]和调节信号转导系统[17]。ABC转运系统,负责信号分子的跨膜运输;组氨酸蛋白激酶和天冬氨酸蛋白激酶作为两组分调节系统(TCS)负责传递磷酸基团。细菌在生长繁殖过程中,大量AIPs被ABC系统转运到细胞外,当AIPs含量到达特定阈值后,会被细胞膜上的双组分受体特异性识别,激活受体激酶蛋白,使得组氨酸残基磷酸化。随后响应调节子蛋白活化,天冬氨酸残基磷酸化。启动子与活化的响应调节子结合,进而调控相关基因的表达。群体感应调控的目的基因中还包括部分自诱导肽修饰、ABC转运与TCS系统基因,在一定的动态范围内形成自诱导作用[18]。
1.2 革兰氏阴性菌经典群体感应机制
1.2.1 费氏弧菌群体感应机制
QS系统首次发现于由海洋费氏弧菌调控的夏威夷鱿鱼的发光现象中,当费氏弧菌的菌体密度达到一定的阈值后,就会诱导发光基因的表达。如图1所示,费氏弧菌的QS系统由调控蛋白LuxR蛋白、自体诱导物合成酶LuxI蛋白和信号分子N-酰基高丝氨酸内酯类化合物(AHLs)三部分组成,被视为革兰氏阴性菌群体感应的模式系统。许多革兰氏阴性细菌的QS系统都与费氏弧菌中由LuxR/LuxI蛋白调控系统相似,如紫色杆菌(Chromobacteriumviolaceum)[19]、铜绿假单胞菌[20-21]、根瘤菌(Rhizobium)[22]、木醋杆菌(Gluconacetobacterxylinum)[23]等。
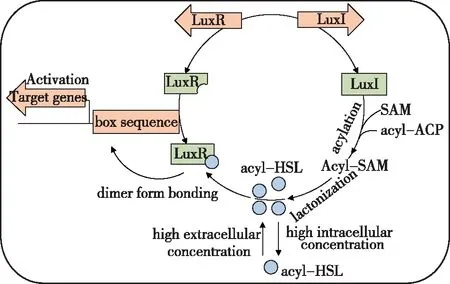
图1 群体感应系统LuxR/LuxI调节机制Fig.1 Regulatory mechanism of LuxR/LuxI in quorum sensing
AI合成酶LuxI蛋白能够合成信号分子AHLs。LuxI蛋白酶通过将酰基-酰基载体蛋白(acyl-ACP)的酰基侧链与S-腺苷甲硫氨酸(SAM)的高半胱氨酸基团特异性结合,形成酰化的HSL,随后内酯化形成Acyl-HSL(AHLs)。LuxR家族蛋白是在信号分子AHLs介导的细菌QS中一类重要的转录调控蛋白,具有AI结合框,能够与信号分子结合并参与细胞之间的感应。LuxR蛋白C端保守的螺旋-转角-螺旋结构可以与目的基因转录调控区box序列特异性结合形成二聚体,调控特异基因表达。LuxR蛋白作为激活子与DNA作用会诱导RNA聚合酶与目的基因启动子结合[24]。当AHLs浓度低于阈值时,N端序列会抑制C端序列与RNA聚合酶的结合;当AHLs浓度水平较高时,N端序列与AHLs结合,N端序列解除对C端序列的抑制,C-短端参与寡聚化并与启动子DNA结合[25]。不同属的微生物间的LuxR的氨基酸序列差异较大,但95%的LuxR型蛋白的AHL结合框结构处具有6个保守的氨基酸,分别是57位色氨酸(W57)、61位酪氨酸(Y61)、70位天冬氨酸(D70)、71位脯氨酸(P71)、85位色氨酸(W85)和113位甘氨酸(G113)[26]。不同细菌中LuxR蛋白具有特殊的AHLs酰基结合框,每一种细菌都能对其自身的群体感应信号识别、监控、并作出反应。
毛磊磊等[27]对嗜水气单胞菌(Aeromonashydrophila)的研究发现:敲除luxR同源基因后,利用RT-PCR检测发现luxI基因的表达量显著降低,表明敲除luxR同源基因会影响AHLs的合成酶基因表达量,从而抑制信号分子AHLs的生成。揭金鑫等[28]构建了luxR基因缺失海希瓦氏菌(Shewanellabaltica),发现缺失lusR缺失对菌体生长并无影响,而对其产硫能力影响显著,削弱了该菌的致腐能力。Tang等[29]发现luxI和luxR缺失荧光假单胞菌(Pseudomonasfluorescens)的生物膜和胞外多糖产量显著降低,生物膜结构较薄且不致密,添加外源C4-HSL后,luxI缺失菌株的生物膜逐渐恢复致密。
不同AHLs分子的保守的疏水性的高丝氨酸内酯五元环部分高度保守,差异只在于亲水性的酰胺侧链的长度与结构[30]。酰胺侧链的碳原子数从4个到18个不等,多为偶数个,奇数仅为7碳,并且链上的第3位碳原子上具有氢、羟基和羰基取代基[31],图2为一些典型的AHLs分子结构。当酰胺侧链碳个数在8个以内时,AHLs可穿透磷脂双层膜自由扩散,当侧链大于10个碳则需借助于运输载体来转移[32]。
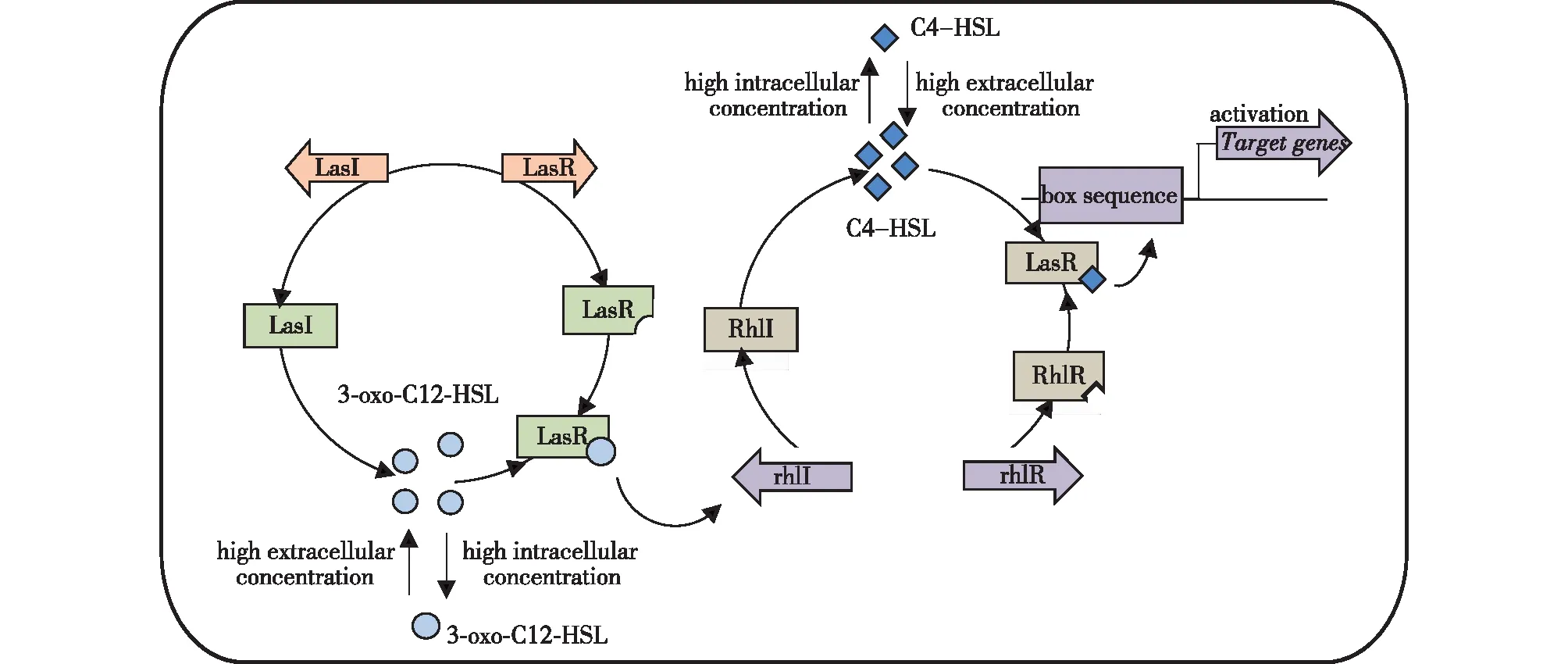
图3 群体感应系统LasR/LasI和RhlR/RhlI的调节机制 Fig.3 Regulatory mechanism of LasR/LasI and RhlR/RhlI in quorum sensing

图2 AHLs的基本结构Fig.2 Basic structure of AHLs
1.2.2 铜绿假单胞菌群体感应机制
铜绿假单胞菌的顺序型QS系统由Las和Rhl系统组成,这些系统均受自诱导物AHLs调节[33]。如图3所示,Las和Rhl系统分别由转录激活调控因子lasR、rhlR和自诱导物合成酶基因lasI、rhlI组成,它们负责检测细胞的浓度,会随着细菌种群数量变化对相应基因的表达做出调节。当LasR的自诱导物结合框和AHLs的同系物3-oxo-C12-HSL嵌合时,Las系统被激活并调控弹性蛋白酶、碱性蛋白酶、外毒素A等毒力因子的表达[34-36]。RhlR与AHLs另一同系物C4-HSL结合后可调控生成鼠李糖脂、几丁质酶、氰化物等次级代谢产物。Las系统可以调控毒性基因的表达,Rhl系统也可以间接地通过调控Las系统来启动毒性基因表达。Las系统不仅可以激活Rhl系统,还可通过LasI合成酶蛋白分泌产生的信号分子AHLs竞争性地抑制调控蛋白RhlR与其自身信号分子的结合,起到相应的负调控作用[37]。
2 群体感应系统对生物膜生成的调控作用
2.1 群体感应系统直接介导生物膜形成
细菌生物膜的形成过程主要分为四大阶段,如图4所示。最初为细菌初始聚集阶段,细菌借助鞭毛的运动、流体动力、布朗运动等方式到达载体表面;第二阶段为细胞间的黏附和增殖过程,吸附到载体表面的细菌在繁殖过程中通过调节基因表达,分泌出EPS(包括多糖、蛋白质、胞外DNA等)黏附于载体表面形成聚集态;第三阶段为生物膜成熟,细菌通过生长和繁殖形成复杂的三维结构的生物膜;第四阶段为生物膜的分散,生物膜中的EPS分解,单个细菌脱离生物膜,进入周围环境中,进入下一个生物膜周期。QS系统通过监测其群体的细胞密度来调节特定的基因表达,控制整个细菌群体的生长、代谢等行为,以确保生物膜中微环境的稳态与代谢物的正常分泌,避免营养物质缺乏等,为菌体生长以及生物膜形成提供保障[38]。
QS系统和环境信号应答系统调控细菌形成成熟的生物膜,主要是通过细菌生长过程中不利的环境因子诱发细胞的环境信号应答系统,使细菌分泌信号分子,当其累积达到一定阈值时,就会结合到细菌的信号分子应答元件上,改变细胞内的调控元件转录或表达,从而调控EPS(多糖基质、脂质蛋白、纤维蛋白等)的合成控制细菌的粘附能力,影响生物膜成熟与结构[39-40]。QS系统还可促进生物膜的解离过程,金黄色葡萄球菌的Agr系统可通过上调多肽酶和核酸酶的表达促进生物膜解离,加速细菌分散、感染[41-42]。
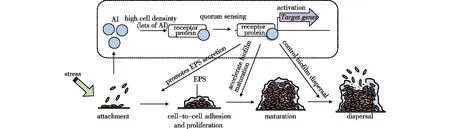
图4 群体感应系统在细菌生物膜形成中的调控过程Fig.4 The control process of Quorum sensing in bacterialbiofilm
另一方面,QS系统介导EPS分泌还可使生物膜从延展模式切换为保护模式,利用EPS应对环境威胁[43]。QS调节系统表明细菌间的信息交流是一种动态的过程,受到了营养成分、温度、pH等多种环境因子的影响,是一个复杂的动态过程。Kim等[44]发现假单胞菌产生的鼠李糖脂,可促进细菌从生物膜中分离来影响生物膜形成,之后鼠李糖脂作为生物表面活性剂被广泛应用于抗菌、防污染等方面[45]。Davies等[46]对铜绿假单胞菌QS系统与生物膜关系的研究中发现,不能产生特定AHLs信号分子的突变菌株只能形成均质、扁平的生物膜;在人为添加信号分子后,突变菌株又能形成成熟的生物膜,从而证实QS系统可调控铜绿假单胞杆菌生物膜的形成与结构。Hebert等[47]发现大肠杆菌(Escherichiacoli)可通过SdiA蛋白检测其他细菌分泌的AHLs,来控制细胞膜的合成。
2.2 群体感应系统协同其他信号分子介导生物膜形成
除了基于群体感应系统调控外,部分细菌中还存在着同样可介导生物膜形成的其他信号分子,在生物膜形成阶段中有着重要作用。环二鸟苷酸(c-di-GMP)是一种对纤维素合成酶有变构激活作用的鸟苷酰寡核苷酸类物质,为第二信使分子之一[48]。其浓度受自体诱导物的调节,它可以快速升降来调节细胞内代谢系统的酶活性,控制营养成分的吸收利用、能量转移、细胞代谢物分泌等微生物生命活动。第二信使也控制着细胞的增殖、分化和生存,并参与基因转录的调控[49-50]。c-di-GMP的合成酶和降解酶感受胞外信号后可改变胞内c-di-GMP水平,进而在转录、翻译和翻译后水平上调控细菌生物被膜形成、EPS分泌、毒性因子产生、细胞运动、黏附性等生理功能。
c-di-GMP调控的细胞运动、EPS分泌、生物膜形成等功能同时受控于群体感应系统,Waters等[51]发现在霍乱弧菌中当存在QS调节子HapR时,QS系统对生物膜的调节作用依赖于c-di-GMP。Rahman等[52]报道了维罗纳气单菌(Aeromonasveronii)中c-di-GMP的增加可以促进C4-HSL信号分子的产生。Bomin等[53]报道了铜绿假单胞菌QS中LasR/LasI系统可通过诱导DGC活性来正向调控c-di-GMP,RhlR/RhlI系统通过诱导PDE活性来负向调节c-di-GMP水平,QS系统与c-di-GMP相互交叉调控细胞毒力与生物膜形成。Theodora等[54]发现霍乱弧菌的QS系统中HapR蛋白可抑制c-di-GMP合成基因的表达,通过促进c-di-GMP降解而间接抑制生物膜的形成,由于HapR的合成存在时间性,因此这种抑制作用仅存在于高细胞密度时;而低细胞密度时,c-di-GMP的合成未受到抑制,其浓度增加,可促进霍乱弧菌的多糖合成,进而促进生物膜的形成,这一发现同时证明了在QS信号分子未达到阈值时,c-di-GMP调控着细菌的运动聚集、增殖、营养吸收、合成EPS等生理功能,随着细胞密度增高并到达阈值,QS系统开始调控生物膜黏附、成熟与分散过程,进而印证了c-di-GMP的信号通路并不是孤立的,而是与双组分系统、QS系统等组成了复杂的信号传递网络,共同介导细菌生物膜的形成。
3 结论
微生物中细胞与细胞之间的交流是一种极其普遍的现象,不同细菌的QS机制与其调控的生理功能各具特色,可在不同的工业领域中加以应用。例如通过分子手段抑制信号分子的生成、信号分子降解酶制剂、针对自诱导物结合域寻找信号分子类似物竞争抑制等方式抑制致病菌生物膜的形成,为解决食品安全、医疗健康问题提供新思路。而有益微生物生物膜的形成有利于抵抗环境胁迫压力,同时功能性生物膜也具有良好的应用前景及研究意义。随着对群体感应系统复杂性的重视程度的加深,对信号的生物分子合成及调控机制的研究显得尤为重要,深入探究其介导生物膜形成机制,为研究细菌群体感应系统拓宽思路。
