醋杆菌中群体感应分布与遗传进化分析
2020-05-23钱成巩梁新乐
夏 凯,钱成巩,梁新乐
(浙江工商大学 食品与生物工程学院,浙江 杭州 310018)
醋酸菌(acetic acid bacteria)是一类严格好氧的革兰氏阴性细菌,因其强大的氧化乙醇产生乙酸能力而被广泛用于工业食醋生产[1]。醋酸菌广泛分布于自然环境、花、水果、醋以及酒等发酵食品中,在目前已知的19个属中,醋杆菌(Acetobacter)和葡萄糖酸醋杆菌(Gluconacetobacter)主要用于食醋发酵[2]。在食醋生产过程中,菌种的耐酸性能是制约高酸度醋生产的关键因素。过去几十年的研究逐步揭开了醋酸菌的高耐酸机制,主要体现在一些和耐酸直接相关的特殊蛋白的发现(如乙醇脱氢酶、ABC转运子、转录调控因子等)以及脂肪酸代谢、氨基酸代谢、蛋白质合成等生物过程[3-5]。但是潜在的调控通路仍知之甚少。
群体感应(quorum sensing,QS)在目前已知调控通路中研究相对透彻,QS在微生物细胞响应环境压力中发挥重要作用,与细菌种群密度相关[6]。微生物可通过感知环境中信号分子的浓度来实现胞内基因的转录调控,以实现细胞在群体水平上的压力响应。根据识别和调控方式的不同,已知信号分子主要分为AHLs类、AI-2、寡肽类以及DSF和PQS类[7]。目前,铜绿假单胞菌、大肠杆菌、西瓦氏菌、以及哈氏弧菌中QS的研究相对成熟,研究发现QS在生物膜的形成、毒力因子合成和释放以及压力响应中发挥重要作用[8]。然而,工业微生物中QS的研究相对薄弱,主要在乳酸菌中[9-10]。研究发现QS调节系统与乳酸菌生长过程中细菌素的分泌以及抗菌肽的产生密切相关,同时也在乳酸菌生长过程中特别是为应对外界不利环境所发生的细胞形态变化、黏附能力的改变方面扮演重要角色[11]。
目前,醋酸菌中有关QS的报道主要在葡萄糖酸醋杆菌中,研究发现QS与细胞产酸和纤维素的合成密切相关,且主要起作用的是AHLs类信号分子[12-13]。除此之外,醋酸菌其他菌种如醋杆菌中的QS研究未见报道。在传统食醋发酵生产过程中,微生物菌群复杂[14-15],预示着QS在细胞响应环境压力以及与其他微生物相互作用过程中扮演重要角色。
本研究中,笔者以分离于浙江传统玫瑰醋中的一株高耐酸巴氏醋杆菌(A.pasteurianus)Ab3以及国内高酸度食醋生产用菌株巴氏醋杆菌CICC 20001(原沪酿1.01,A.pasteurianusCICC 20001)为研究对象[3,16],采用指示菌生物检测法和仪器分析方法探究了巴氏醋杆菌中的QS特性。在此基础上,进一步结合生物信息学分析,对醋杆菌中的QS分布和遗传进化规律进行揭示,以期为深入研究巴氏醋杆菌的压力响应机制以及其他醋杆菌QS系统的调控作用奠定理论基础。
1 材料与方法
1.1 菌种、培养基和试剂
巴氏醋杆菌Ab3(分离于玫瑰醋)和CICC 20001(浙江五味和食品有限公司提供)均在YPD 培养基(10 g/L酵母浸出粉,5 g/L蛋白胨,10 g/L葡萄糖,体积分数2%乙醇)中培养。
紫色紫杆菌CV026(ChromobacteriumviolaceumCV026)和根癌农杆菌(AgrobacteriumtumfaciensA136)(保藏于笔者所在实验室)均在LB培养基(5 g/L酵母浸出粉,10 g/L蛋白胨,10 g/L NaCl,pH 7.0)中培养,其中紫色紫杆菌和根癌农杆菌培养体系中分别加入终质量浓度为50 μg/mL的卡那霉素、50 μg/mL的壮观霉素和5 μg/mL的四环素。
哈氏弧菌(Vibrioharveyi) BB170和BB152(保藏于笔者所在实验室)在LM培养基(5 g/L酵母浸出粉,10 g/L蛋白胨,20 g/L NaCl)或AB培养基(0.3 mol/L NaCl;0.05 mol/L MgSO4;1 mol/L磷酸钾缓冲液,体积分数1%;0.1 mol/L L-精氨酸溶液,体积分数1%;50%甘油溶液,体积分数2%;10%酪氨酸溶液,pH 7.5,体积分数2%)中培养。以上所述菌株培养条件均为30 ℃、180 r/min。固体培养基的配制为液体培养基加入20 g/L的琼脂。
AHLs(C6-HSL和C12-HSL),Sigma 公司;抗生素、X-gal、IPTG等,上海生工生物股份有限公司;酵母浸出粉和蛋白胨,OXOID公司;其余化学试剂均购于西陇化工股份有限公司。
1.2 基因组数据
本研究中所用19种醋杆菌共89个基因组序列下载于NCBI数据库(https://www.ncbi.nlm.nih.gov/)。
1.3 巴氏醋杆菌群体感应信号分子检测
1.3.1 信号分子粗提液制备
信号分子的浓缩提取过程参照文献[12]的研究。-80 ℃甘油管保存的巴氏醋杆菌划线于准备好的YPD平板,待单菌落形成后,挑取单菌落至30 mL YPD液体培养基中培养,培养至对数期(OD约为0.6) 以1%的接种比例转接于新鲜的YPD培养基中进行培养。每隔12 h取样进行信号分子提取实验。提取过程如下:醋酸菌发酵液离心后收集上清液(8 000 r/min,5 min),加入等量的乙酸乙酯萃取3次,合并萃取液并用旋转蒸发仪蒸干,最后用HPLC级甲醇溶出,-20 ℃保存备用。
1.3.2 牛津杯扩散法检测AHLs
-80 ℃甘油管保存的紫色紫杆菌CV026划线于准备好的LB抗性平板,待单菌落形成后挑取单菌落至5 mL的LB液体抗性培养基中培养,对数期后(OD为0.5~0.8)以1%的接种比例转接至新鲜的LB培养基中培养至对数期。将活化好的菌种以1%的比例和新鲜的LB固体培养基混合均匀后倒平板,平板凝固后,放上牛津杯,每个牛津杯中加入150 μL的信号分子粗提液或阳性对照(C6-HSL,质量浓度为1 μg/mL,溶于甲醇)或阴性对照(甲醇)。之后置于30 ℃恒温培养箱中培养。
1.3.3 T型划线检测AHLs
准备好新鲜的LB培养基和YPD培养基混合固体平板或CaCO3平板(加入20 g/L CaCO3)。将活化好的紫色紫杆菌CV026或根癌农杆菌以及目标菌株醋酸菌分别于平板的特定位置进行T型划线,而后静置培养观察结果。以根癌农杆菌为指示菌时,在LB平板表面涂布50 μL质量浓度为20 μg/mL的X-gal。
1.3.4 AI-2信号分子检测
Ⅱ类信号分子的检测采用生物发光法[17]。-80 ℃ 甘油管保存的哈氏弧菌划线于准备好的LM平板,待形成单菌落后,挑取单菌落至30 mL LM液体培养基培养过夜,然后以1%比例转接至AB培养基,其中BB152过夜培养后收集上清液作为阳性对照。过夜培养后的指示菌BB170采用新鲜AB培养基以1∶ 5 000的稀释比例稀释,检测采用不透光96孔板(每孔200 μL,包括180 μL的哈氏弧菌稀释液以及20 μL的待检测样品或阳性对照或阴性对照(培养基)。孔板置于微生物高通量筛选系统(VICTOR X3,Perkin Elmer)中进行荧光测定(激发波长485 nm;发射波长535 nm),每隔30 min测定1次,连续测8 h。所有实验均进行3次生物学重复。
1.3.5 仪器分析法检测信号分子AHLs和AI-2
发酵液中可能存在的AHLs和AI-2采用液质联用技术(LC-MS)进行检测,检测参照文献[18-19]方法进行,检测仪器为安捷伦液相色谱质谱联用仪(1200-6210),柱子采用C18反向分析柱(150 mm×2 mm×5 μm,Phenomenex,UK)。液相洗脱程序:等度洗脱10 min(甲醇与水的体积比40∶ 60);然后梯度洗脱(甲醇比例由40%升至90%,流速0.2 mL/min);最后等度洗脱20 min。质谱条件:进样口温度300 ℃,电压 5 kV,m/z扫描范围 50~600。
1.3.6 醋杆菌中QS生物信息学分析
基于AHLs类信号分子的QS系统:包括LuxI类信号分子合成酶以及LuxR类信号分子受体蛋白。LuxI和LuxR在醋杆菌中的同源序列分布分析步骤:选取经研究证实的LuxI和LuxR的保守结构域,如LuxI为IPR001690和IPR018311,LuxR为IPR016032、IPR005143、IPR000792以及IPR011911等。利用BLAST序列比对软件(选择模式为blastp模式,基因组数据包括19种醋杆菌共89个基因组序列,相似度选择一般,E值0.1)进行比对搜索分析[20]。选择经过比对确认的序列(序列相似度>30%)进行进一步的保守结构域分析、序列比对分析以及遗传进化分析。AI-2合成体系的分析参照上述方法,分析对象包括AI-2合成途径中关键酶LuxS和Pfs的保守结构域PRK02260、PRK05584,以及受体蛋白LuxP和LsrB的保守结构域cd06303、COG0583和PRK15408。蛋白保守结构域分析采用在线数据库CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi?)。
进化树的构建采用MEGA 6.0软件,构建时树的模型选择邻近法(NJ),参数选择p-distance,Gap不保留,bootstrap为1 000。序列比对分析:序列比对分析采用ClustalW。基因在基因组上的线性结构分析由在线软件完成(http://archaea.u-psud.fr/SyntTax/)。本研究所有数据处理采用Origin 9.0软件。
2 结果与讨论
2.1 巴氏醋杆菌Ab3和CICC 2001中AHLs测定
通过平板牛津杯扩散法和T型平板划线法对巴氏醋杆菌Ab3不同生长时期的发酵液进行测定,结果如图1所示(由于不同生长时期发酵上清液的测定结果类似,因此牛津杯扩散法只展现了24 h发酵上清液的测定结果;T型划线结果拍摄于菌生长48 h后)。突变后的紫色紫杆菌CV026自身不能合成信号分子,但能识别并感应环境中的信号分子,对酰基侧链长度为C4-C8的AHL类信号分子具有不同的敏感性,因此可通过观察颜色变化判断目标菌株是否产信号分子[20]。由图1可见:与对照直接加入C6-HSL能使CV026变紫相比,巴氏醋杆菌Ab3发酵上清液中不存在使CV026变色的信号分子(图1(a))。考虑到Ab3产生的乙酸可能会对指示菌产生影响,同时为了排除取样时间点对结果造成的误差,笔者进一步在CaCO3平板上采用T型划线法进行连续测定。CaCO3可中和Ab3菌株产生的乙酸,T型划线结果显示,阳性对照即信号分子标准品可使紫色紫杆菌合成紫色素,而Ab3菌株不能使CV026菌落变紫;同样,阴性对照C12-HSL标准品也不能使CV026菌落变色(图1(b))。类似的结果也在不加CaCO3的平板上得到(图1(c))。
笔者同时对另一株巴氏醋杆菌CICC 20001的AHLs合成情况进行了测定,获得了和菌株Ab3测定中类似的结果,平板扩散法和T型划线法均未证明巴氏醋杆菌CICC 20001能合成酰基侧链长度在C6以下的AHLs(图1(d~f))。考虑到巴氏醋杆菌可能合成酰基侧链长度在6个碳原子以上的AHLs,笔者进一步选取了检测范围更广的根癌农杆菌作为指示菌进行检测(检测范围为酰基侧链长度为C6~C14的信号分子)[19,21]。突变后的根癌农杆菌自身不能合成AHLs,但仍保留了信号分子识别基因且同时导入LacZ编码基因,该基因的启动子来源于根癌农杆菌中AHLs的合成酶基因traI。因此,当环境中存在AHLs时,TraR蛋白可识别并同时调控LacZ的表达,通过水解底物X-gal产生蓝色色素。
T型划线结果显示无论是Ab3还是菌株20001均不能使根癌农杆菌变蓝,与对照采用C12-HSL使指示菌产生蓝色色素形成鲜明对比(图1(g~i))。这表明巴氏醋杆菌Ab3和CICC 20001不能合成并分泌碳链长度为6~14的AHLs类信号分子。AHLs类信号分子目前只在葡萄糖酸醋杆菌中被发现,酰基侧链长度在C2~C14不等[12-13,19]。而巴氏醋杆菌中并未有过报道,巴氏醋杆菌是否采用其他种类信号分子进行交流,需要进一步研究。
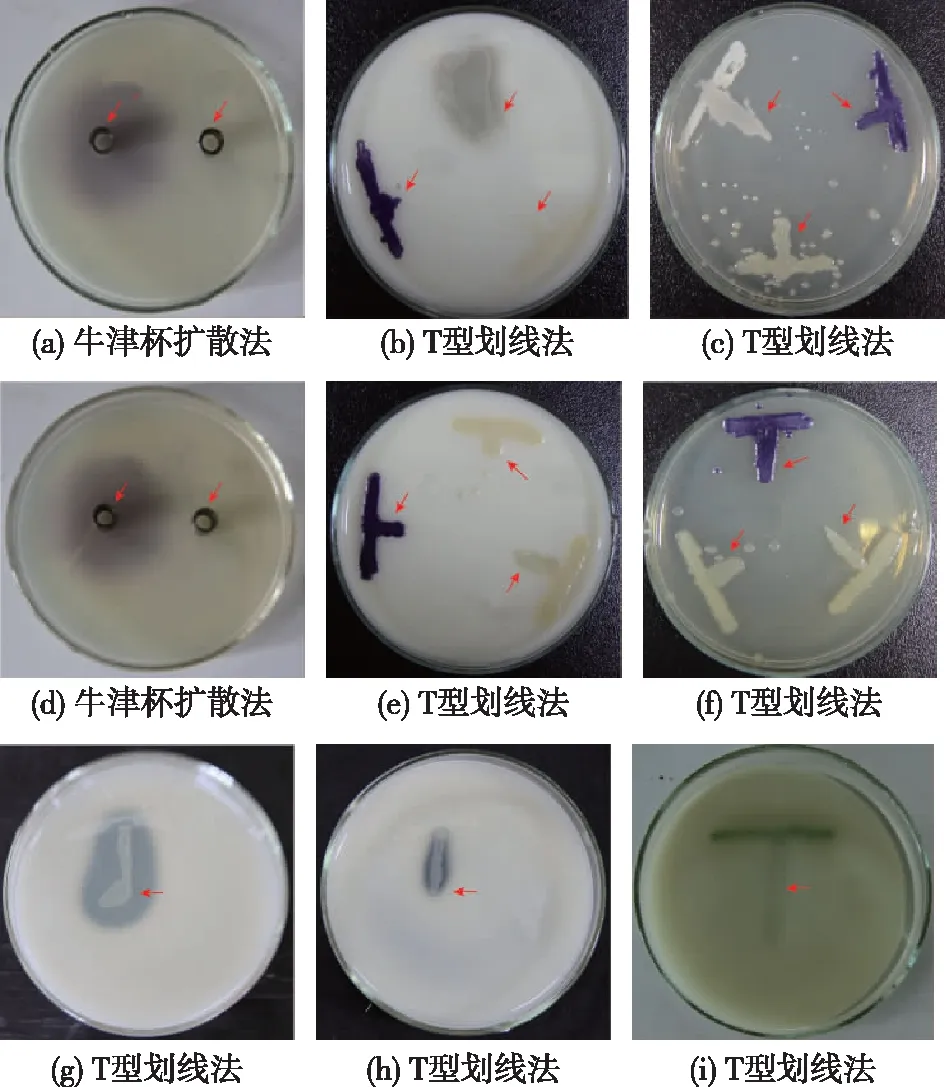
C6—C6-HSL;C12—C12-HSL;Ab3—巴氏醋杆菌Ab3;20001—巴氏醋杆菌 CICC 20001图1 巴氏醋杆菌中AHLs检测Fig.1 AHLs detection of A.pasteurianus
2.2 巴氏醋杆菌Ab3和CICC 2001中AI-2测定
Ⅱ类自诱导物(AI-2)的检测采用生物发光法。AI-2首先在哈氏弧菌中被发现,参与生物发光过程的调控,因此借助该菌能响应AI-2信号分子来对目标样品进行检测是一种快速简便的方法[17]。笔者使用的哈氏弧菌BB170经过基因型改造后不能对AI-1类信号分子进行响应,只能感应AI-2,虽然其本身也能产生AI-2,但是需要群体密度到达一定时才会以发光的形式体现。因此,当外源AI-2不存在时,BB170通过感应自身产生的AI-2信号分子而发光需要在大约3~5 h后,而当外源信号分子存在时则可在短时间内产生荧光[17]。对巴氏醋杆菌中的AI-2检测结果如图2所示。
由图2可知,当加入阳性对照即野生菌哈氏弧菌BB152培养液(培养12 h的上清液),荧光值在0.5 h后开始上升(图2(a))。而加入不同培养时间的巴氏醋杆菌Ab3培养液上清时,未发现荧光值有所上升,相反在开始的2.5 h内荧光值处于下降趋势,荧光下降是由于BB170培养液稀释后因环境中不含有外源AI-2而自身所带荧光逐步猝灭所导致;2.5 h后所有的测试组荧光值开始回升,4 h后达到阳性对照的水平。同样的趋势也发现于阴性对照即加入纯培养基的试验组中,预示着巴氏醋杆菌Ab3不能合成能使哈氏弧菌产生荧光的AI-2信号分子。类似的结果也在巴氏醋杆菌20001中出现,加入不同培养时期的上清液,和阳性对照相比,实验组的荧光值在前2.5 h内一直处于下降趋势,且在2.5 h时达到最低值,之后开始回升(图2(b))。两组中荧光值的回升是由于BB170自身开始产生信号分子诱导菌体产生荧光。综合可知,通过生物发光检测法,本研究未能发现巴氏醋杆菌Ab3和CICC 20001合成AI-2信号分子。

图2 生物发光法检测巴氏醋杆菌中AI-2类信号分子Fig.2 Fluorescence-based detection of AI-2 in A.pasteurianus Ab3 (a) and CICC 20001 (b)
2.3 巴氏醋杆菌Ab3和CICC 20001不能合成AHLs和AI-2
考虑到指示菌检测可能带来的误差,借助LC-MS分析方法,笔者进一步对巴氏醋杆菌中可能存在的信号分子进行分析。依据质谱数据库的检索结果,未发现巴氏醋杆菌Ab3和CICC 20001发酵液中存在AHLs和AI-2相似结构的物质(数据未呈现)。相关结果与上文所述采用生物指示菌检测的结果相互对应,这表明AHLs和AI-2合成体系在巴氏醋杆菌中Ab3和CICC 20001并非普遍存在。此次研究虽仍不能排除它们可能利用其他一些目前未知的小分子物质作为信号分子,但至少AHLs和AI-2在巴氏醋杆菌Ab3和CICC 20001中的丢失似乎是一种趋势。
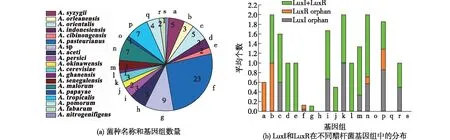
图3 醋杆菌中LuxI和LuxR分布分析Fig.3 Distribution of LuxI and LuxR in Acetoabcter
2.4 醋杆菌中LuxI和LuxR的分布存在种间差异性
鉴于未能在巴氏醋杆菌Ab3和CICC 20001 中检测到AHLs和AI-2信号分子,笔者进一步从基因组水平分析其可能的原因,并将研究对象扩大至整个醋杆菌属。AHLs类信号分子主要由合成酶LuxI催化合成,由LuxR受体蛋白负责识别并对目标基因进行调控[22]。LuxI和LuxR保守结构域同源序列分析显示LuxI和LuxR在醋杆菌中的分布主要以3种形式存在:完整的LuxI+LuxR结构,LuxI orphan结构(即基因组中只存在信号分子合成酶序列)以及LuxR orphan(基因组中只存在信号分子受体序列)(图3)。其中具有完整LuxI+LuxR结构较多的菌种分别是A.orleanensis、A.orientalis、A.indonesiensis、A.cibinongensis、A.persici、A.cerevisiae、A.senegalensis以及A.malorum(平均数量≥1)。A.orientalis、A.persici、A.cerevisiae以及A.tropicalis同时含有较多的LuxI orphan结构(平均数量为0.6~1,图3(b))。而A.syzygii和A.orleanensis则拥有更多的LuxR orphan 结构。A.aceti、A.papaya以及A.pomorum等菌种中不具有任何LuxI和LuxR相关结构。值得注意的是巴氏醋杆菌基因组中不含有完整LuxI+LuxR结构,且只有少数菌株保留LuxI或LuxR结构。本文研究对象基因组中同样不存在任何和AHLs合成相关的序列,这与上文所述未能在所研究巴氏醋杆菌中检测到AHLs的结果一致。因此,巴氏醋杆菌Ab3和CICC 20001不能合成AHLs的原因在于其编码体系的丢失。LuxI和LuxR在醋杆菌不同种中的分布存在差异,而这可能与菌种生存环境密切相关。
2.5 醋杆菌中LuxI和LuxR的分布与生存环境相关
醋酸菌广泛分布于自然环境、植物以及发酵食品中[1],而群体感应主要发挥压力响应调控的作用[6],因此,生存环境的不同势必导致群体感应系统在醋杆菌中的分布差异。不同分离来源醋杆菌基因组中LuxI和LuxR同源序列平均数量如表1所示。由表1可知,分离于植物、水果、以及自然环境中的菌种具有更多的LuxI orphan和LuxI+LuxR结构(平均数量分别为0.44和0.69),远高于那些自食醋等发酵食品中分离菌种的平均数量(0.22和0.27)。但这些菌种含有较少的LuxR orphan结构(0.06)。分离于果蝇肠道等宿主的菌种中拥有较多完整的LuxI+LuxR结构(0.50)。因此,醋杆菌中LuxI和LuxR的分布与菌种生长环境密切相关。
表1 不同分离来源醋杆菌基因组中LuxI和LuxR同源序列平均数量
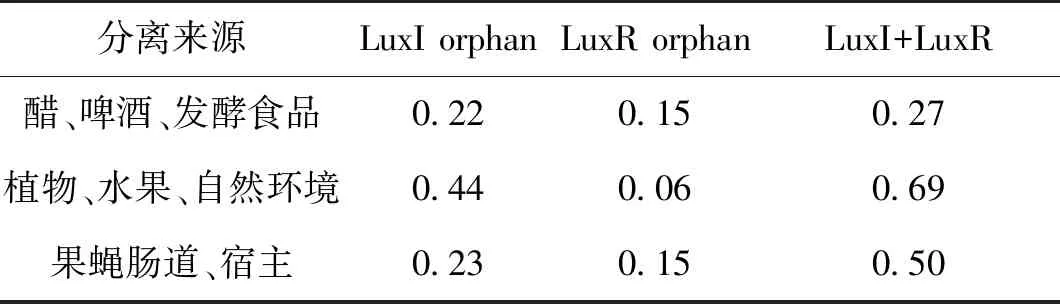
Table 1 Isolation-dependent average number of the homologs of LuxI and LuxR in Acetoabcter
相比于完整的LuxI+LuxR结构,LuxI orphan和LuxR orphan的存在则表明相对应的配对结构在遗传进化过程中存在丢失,同时也表明这种结构可能来自于水平基因转移现象。由于醋杆菌基因组不稳定且可塑性强,同时在基因组上存在众多噬菌体区域和插入序列,因此这种可能性在醋杆菌中是存在的[23-24]。其实,之前已有研究表明,细菌中LuxI和LuxR的分布除两者同时存在以外,单独存在也是一种普遍现象,且与生存环境和遗传进化相关[20,25]。相比拥有LuxI和LuxR元件的菌种可自发合成和感受AHLs,LuxI orphan 则表明该菌株只能合成AHLs,而只含有LuxR orphan结构的菌株自身不能合成AHLs,但能感受环境中的AHLs,实现群体水平的基因转录调控。研究表明,相比于完整结构中的LuxR,单独存在的LuxR具有更宽泛的信号分子识别能力和转录调控对象[26-27]。因此,巴氏醋杆菌少数菌株中保留的LuxR orphan仍可能发挥重要的调控作用,而其他巴氏醋杆菌中LuxI和LuxR结构的完全丢失则表明该结构未能适应遗传进化过程中压力响应的变化。
2.6 醋杆菌中LuxI和LuxR在进化过程中存在丢失和水平基因转移现象
LuxI和LuxR同源序列分析表明,AHLs合成酶LuxI和受体蛋白LuxR在醋杆菌遗传进化过程中存在丢失和基因转移现象(图4),具体表现为以下几个方面:①LuxI和LuxR在种水平并非高度保守,存在不同菌种中的LuxI和LuxR相互聚集在一起的现象,如A.persici、A.malorum和A.tropicalis。②完整结构中的LuxI和LuxI orphan,LuxR和LuxR orphan并未分别归类到一起,而是相互掺杂,如A.pasteurianus中的LuxI orphan和A.tropicalis中的LuxI(图4(a)),A.malorum中的LuxR orphan 和A.tropicalis中的LuxR(图4(b))。③基因组中LuxI和LuxR上下游基因结构分析表明,完整LuxI+LuxR上下游基因结构在同种或不同种中皆高度保守(图5),表明其重要的调控作用。④LuxR orphan上下游基因结构在不同菌种中不保守,且在其附近发现转座子和噬菌体区域(图6),表明其配对LuxI的丢失受这些结构影响。
2.7 醋杆菌中LuxR关键活性位点存在突变现象
群体感应体系中的LuxR含有两个保守结构域:一个是N端信号结合区域ABD;另一个是C端DNA结合域HTH区(helix-turn-helix)。LuxR关键活性位点保守性分析如表3所示。LuxR存在着9个关键氨基酸位置,这些位点的氨基酸高度保守,影响着LuxR的活性(氨基酸位点以根癌农杆菌TraR为准)[20]。9个位点分别是信号分子结合域中57位的色氨酸(W)、61位的酪氨酸(Y)、70位的天冬氨酸(D)、71位的脯氨酸(P)、85位的色氨酸(W)、113位的甘氨酸(G)以及HTH结构域中178位的谷氨酸(E)、182位的亮氨酸(L)以及188位的甘氨酸(G)。醋杆菌中LuxR关键氨基酸位点分析显示这些关键位点在不同菌种中皆存在不同程度的突变,其中主要突变形式包括61位的酪氨酸和70位的天冬氨酸,分别突变为异亮氨酸(I)和甘氨酸(G)(表3)、85位的色氨酸突变为酪氨酸(Y)、113位的甘氨酸突变为丙氨酸(A)、178位的谷氨酸突变为谷氨酰胺(Q)以及188位的甘氨酸突变为丝氨酸(S)。研究表明61位的酪氨酸在信号分子的识别和结合过程中发挥直接作用,因此该位点的突变也表明相应LuxR蛋白可能失去信号分子识别能力[28]。而其他位点的突变是否会影响醋杆菌识别AHLs需要今后进一步分析。总之,醋杆菌中信号分子识别蛋白LuxR关键活性位点发生不同程度的突变,这间接体现了LuxR不同的进化历程和速度,而部分可能将最终导致蛋白功能的改变或相关编码基因的丢失。

相同颜色圆圈代表同一个种;星号代表该序列为LuxI orphan 或LuxR orphan图4 醋杆菌LuxI和LuxR聚类分析Fig.4 Cluster analysis of LuxI (a) and LuxR (b) in Acetobacter

相同颜色箭头代表相同编码基因,箭头方向代表基因在染色体上的方向;左侧的菌种简写信息参照表2图5 醋杆菌LuxI+LuxR上下游基因结构分析Fig.5 Chromosomal synteny analysis of LuxI+LuxR in Acetobacter
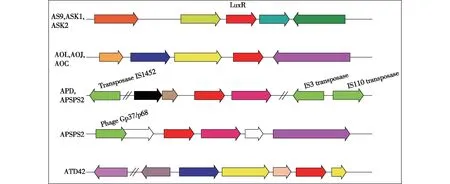
图6 醋杆菌LuxR orphan上下游基因结构分析Fig.6 Chromosomal synteny analysis of LuxR orphan in Acetobacter

表2 基因线性结构分析菌种简写信息Table 2 Abbreviation information of the species used in chromosomal synteny analysis
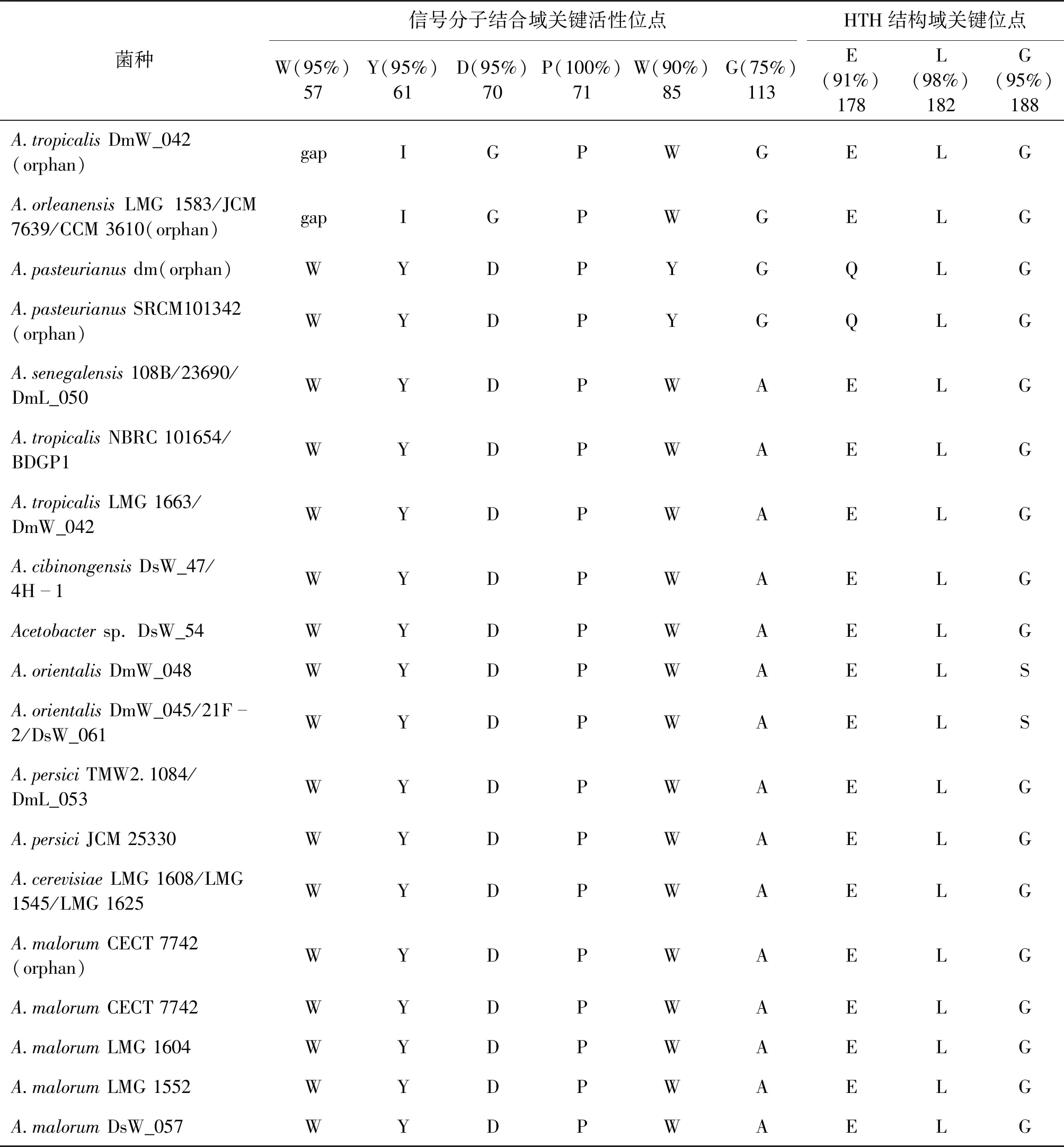
表3 LuxR关键活性位点保守性分析Table 3 Conservation analysis of the key loci in LuxR
2.8 醋杆菌中不存在AI-2合成体系
AI-2是除AHLs以外第2种微生物常用于交流的信号分子。AI-2主要是以SAM(S-腺苷蛋氨酸)为底物经过三步反应合成而来(SAM到SAH(S-腺苷高半胱氨酸),然后在Pfs(S-腺苷高半胱氨酸核苷酸酶)催化下转为SRH(S-核糖高半胱氨酸),SRH在LuxS的催化下生成DPD(4,5-二羟基-2,3-戊二酮),DPD可随时变化结构成为AI-2)[29]。受体方面则主要为LuxP和LsrB(图7)[30-31]。本研究未在醋杆菌基因组中发现Pfs、LuxS、LuxP以及LsrB的同源序列,这与研究前期利用哈氏弧菌生物发光检测法未检测到巴氏醋杆菌能合成AI-2信号分子相对应,表明巴氏醋杆菌等大部分醋杆菌不存在AI-2合成体系。
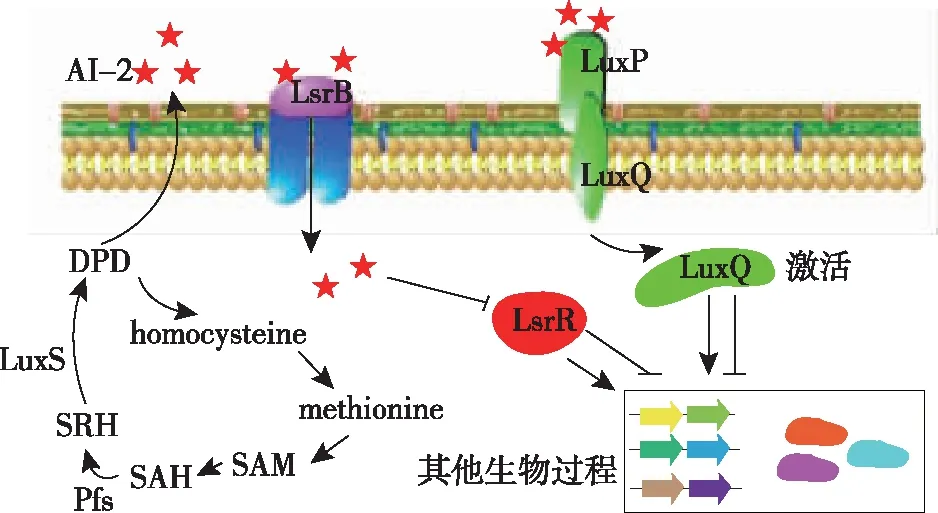
图7 AI-2型群体感应系统Fig.7 The AI-2-based quorum sensing system
3 结论与展望
巴氏醋杆菌Ab3和CICC 20001不能合成AHLs和AI-2类信号分子,与相关QS编码基因在遗传进化过程中的丢失相关。相比于巴氏醋杆菌,其他醋杆菌中存在AHLs编码体系但同样不存AI-2合成体系。醋杆菌中AHLs的分布与生存环境和基因组稳定性有关,综合可知,生存环境引起的菌种生长方式的改变是醋杆菌中QS差异分布的主要原因。AHLs和AI-2介导的群体感应系统未能在巴氏醋杆菌响应酸胁迫过程中发挥调控作用,表明存在其他重要的信号通路调控体系,这有待今后进一步深入分析。同时,其他醋杆菌中广泛存在的AHLs介导的QS是否在细胞响应环境压力中发挥作用以及发挥何作用值得深入探索,而本文所获结果为研究其他醋杆菌中的QS提供了基础。
