真菌群体感应信号分子及群体感应猝灭的研究进展
2020-05-25彭梦雪梁志宏
高 婧,彭梦雪,梁志宏
(中国农业大学 北京食品营养与人类健康高精尖创新中心 食品科学与营养工程学院,北京 100083)
群体感应(quorum sensing,QS)是生物调节群体行为的一种信号交流机制,微生物可以向胞外分泌一些被称为群体感应信号分子(quorum sensing molecules,QSM)的特定小分子化学物质,当胞外QSM浓度积累到一定阈值时,可以通过特定的转运蛋白进入其他微生物细胞内激活相关基因的表达,从而监测群体密度并调控自身的生理行为以适应环境的变化[1-3]。最早在1977年,针对海洋费氏弧菌(Vibriofischeri)的一系列研究中发现[4],在低群体密度时细菌不产生荧光,当群体密度达到阈值时迅速产生荧光,费氏弧菌中的LuxI/LuxR转录激活因子和自诱导系统以密度依赖形式调控Lux基因表达,产生酰基高丝氨酸内酯(acyl homoserine lactone,AHL)影响生物发光[5]。1994年,Fuqua等首次将这种监测微生物自身群体密度以调控微生物群体行为的环境传感系统定义为“群体感应”[6]。自2000年首次在致病性多态真菌--荚膜组织胞浆菌中发现这种类似于细菌的QS现象以来[7],越来越多的研究发现真菌的QSM能够调节真菌菌相转化、生物膜形成、耐药性基因表达、毒力因子的分泌以及抗生素产生等行为[8]。Park等[9]研究发现,一种微生物能同时拥有多套QS系统、产生多种QSM,协调或调控微生物的多项生物功能。真菌中已经发现的QSM主要有醇类、氧合脂质、小分子肽、醛类以及挥发性有机物(VOCs)等[8]。除了作为真菌自身细胞间的通讯分子在转录水平起到全局调控作用外,真菌QSM对其他种类真菌、细菌、植物甚至哺乳类动物细胞(包括正常细胞或肿瘤细胞)也有作用,但QSM的生物合成、运输、受体及信号传导通路尚未有较为深入的全面研究。本文中,笔者就国内外近10年来对真菌QSM种类、种内及种间生理作用及QQ的研究进展进行综述,以期为深化真菌群体感应机制的研究提供参考。
1 真菌中的群体感应现象
早在1955年,Allen[10]就在真菌禾柄锈菌(Pucciniagraminis)中发现群体密度能影响真菌形态,高细胞密度(107个/mL)可以抑制孢子萌发。后续在植物致病菌及产毒真菌如柄锈菌属(Pucciniaspp)、青霉属(Penicilliumspp)、曲霉属(Aspergillusspp)等属内菌株相继发现高密度培养对孢子萌发和菌丝伸长的抑制现象。Hornby团队[11]在致病性双态真菌白色念珠菌(Candidaalbicans)中发现QSM法尼醇(farnesol)是真核生物QS的重大突破。白色念珠菌存在酵母态和菌丝态,当细胞密度低于106个/mL时,白色念珠菌会以菌丝态存在,当细胞密度高于106个/mL时,真菌会以发芽酵母的形式生长,这表明真菌能通过感受群体密度,产生QSM进而调节生命活动。除了调节形态转化外,真菌还能够通过QS调节其次级代谢产物的合成,许多动植物致病菌如白色念珠菌[12]、新型隐球菌(Cryptococcusneoformans)[13]、腐榆角藻菌(Ceratocystisulmi)[11]等,可通过群体感应诱导毒力因子的分泌,增强其入侵动植物的能力,另外对曲霉属真菌,如构巢曲霉(A.nidulans)[14]、寄生曲霉(A.parasiticus)[15]、黄曲霉(A.flavus)[16]、赭曲霉(A.ochraceus)[17]等的研究中也发现了以密度依赖的方式调节次级代谢物产生的现象。QSM在QS中起到重要的调节作用,Albuquerque等[18]总结归纳了微生物QSM的5个标准:①在微生物生长过程中产生并在胞外积累;②积累的浓度与种群密度成正比,仅在生长的特定阶段起作用;③不仅仅是在达到阈值浓度后对单个细胞起到代谢或脱毒作用,而是在整个群体中协同作用;④在培养基中外源添加能诱导同样的QS现象;⑤不光是微生物代谢的副产物。笔者总结了目前发现的真菌中QSM及生理作用(表1),并详细介绍几种重要的QSM。
2 真菌的群体感应信号分子
近年来随着真菌的群体感应现象研究的深入,群体感应信号分子在真菌的生长发育、次级代谢物产生以及抗真菌活性等方面起到的作用越来越受到重视,下面将讨论一些常见的QSM及其作用。
2.1 醇类
法尼醇分子量222.36,化学式为C15H26O,是目前研究较为深入的一种QSM,可以影响多种真菌的形态转换、生物膜形成、氧化应激、诱导真菌凋亡、控制药物排出等,法尼醇作为QSM对真菌的生理作用见表2。

表1 真菌中的群体感应信号分子Table 1 Quorum sensing signaling molecules in fungi

表2 群体感应信号分子法尼醇对真菌的作用Table 2 Effects of the quorum sensing signal molecule farnesol on fungi
白色念珠菌是一种常见的人类条件致病双相真菌,其菌相转换与细胞密度相关,较高的细胞密度下菌丝的形成受到抑制,添加白色念珠菌培养物也会阻止酵母相向菌丝相的转化,但不能抑制已有菌丝的伸长[34]。Hornby等[12]对进入稳定生长期的白色念珠菌培养物上清液进行分析,分离鉴定出起决定性作用的物质为法尼醇(farnesol),这是真菌中最早被证明的QSM。Kebaara等[35]研究发现,用法尼醇处理白色念珠菌细胞后,菌丝特异性基因的转录抑制因子Tup1的mRNA和蛋白水平均升高,抑制了酵母向菌丝的转化,然而Lindsay等[36]的研究表明,法尼醇也可以促进菌丝向酵母的转化,说明不同情况下信号分子所起的调节作用不同。菌丝生长通过几种信号通路调节,尤其是环磷酸腺苷(cAMP)通路,假丝酵母中法尼醇通过抑制腺苷酸环化酶Cyr1p的活性来抑制cAMP信号通路,从而抑制假菌丝和菌丝的发育[37]。酿酒酵母中,芳香醇合成缺陷的突变体菌株的丝状体生长受到抑制[1]
法尼醇可以影响生物膜形成的多个阶段,生物膜是一种能附着在生物或非生物表面良好的微生物群落结构,相较于游离单细胞,生物膜更能抵御抗真菌药物[19]。白色念珠菌的生物膜发育首先是依靠酵母细胞附着在宿主表面,在适宜条件下形成菌丝,最后交织成致密的成熟生物膜,法尼醇可以通过下调编码菌丝特异性壁蛋白HWP1的表达抑制白色念珠菌生物膜的形成。在生物膜形成后期的高密度交织丝状细胞中,法尼醇抑制芽管的形成并触发酵母形态细胞的扩散,从而使菌株转移到新的生存环境中[38]。白色念珠菌产生的法尼醇还影响其他念珠菌物种,如副念珠菌(C.parapsilosis)和热带念珠菌(C.tropicalis)的形态转换[39],除此之外,法尼醇对几种真菌的分生、萌发和菌丝形态也有影响[40]。在黑曲霉中,高浓度的法尼醇抑制分生孢子并降低细胞内cAMP水平,但不抑制气生菌丝的产生[41];禾谷镰刀菌(Fusariumgraminearum)中法尼醇处理损害了分生孢子的发育和萌发[42];球孢子菌(Coccidioidesposadasii)中,法尼醇处理过的细胞中麦角固醇的量减少,从而影响了真菌质膜的完整性[43]。在烟曲霉(A.fumigatus)中,法尼醇改变了参与调节细胞骨架和细胞壁完整性途径的蛋白质(如AfRho1p和AfRho3p)的定位[44]。法尼醇与氧化应激有关,浓度为40~100 μmol/L的法尼醇可通过上调某些与氧化应激相关的基因如超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的表达来保护白色念珠菌免受H2O2、白花丹素(plumbagin)和甲萘醌(menadione)的氧化胁迫[45-46],法尼醇可以诱导酵母和丝状真菌细胞的凋亡,在酿酒酵母和构巢曲霉中,法尼醇通过破坏线粒体,诱导半胱天冬酶和ROS的产生来诱导细胞的凋亡[47-48],用法尼醇处理黄曲霉,可以引起细胞凋亡标志出现(如核浓缩、磷脂酰丝氨酸、DNA片段化、活性氧、泛酸酶激活、细胞超微结构改变等)。Sharma等[49]首先发现法尼醇是白色念珠菌药物外排泵蛋白的调节因子,其特异性调节由三磷酸腺苷结合体转运子(ABC)介导的白色念珠菌药物流出,而不影响主要促进剂超家族(MFS)多药物挤出泵蛋白CaMdr1p。此外,法尼醇通过增加ROS水平来增强白色念珠菌对唑类和多烯类药物的抵抗作用。Yu 等[50]通过体外诱导氟康唑耐药菌株,研究法尼醇对白色念珠菌耐药性的影响,发现法尼醇抑制甾醇合成途径调节基因ERG的表达,可减弱白色念珠菌对氟康唑的耐药性。
法呢酸是法尼醇的一种氧化形式,起到抑制菌丝生长的作用[51],但是其形态抑制作用与法呢醇比相对较弱[52]。除了法尼醇外,真菌中还有从芳香氨基酸色氨酸、苯丙氨酸和酪氨酸中提取的醇类物质[53]。酪醇是另一种重要的醇类QSM,白色念珠菌中,当细胞密度小于107个/mL时,菌株在进入对数生长期前会出现一个明显的生长停滞期,密度越低停滞期越长,酪醇可以缩短菌丝诱导条件下细胞萌发的滞后时间,并且促进菌体形成芽管进一步转变为菌丝[54]。酪醇对白色念珠菌的调控作用弱于法尼醇,只有在环境中的法尼醇含量低于一定浓度时才可以起到影响菌株形态转换的效果[54]。
2.2 脂氧合物
氧脂素(oxylipins)是一类由亚油酸、亚麻酸和油酸等多不饱和脂肪酸(PUFAs)通过酶促或非酶促反应加氧生成的一类氧合脂质,是霉菌、酵母菌、植物和动物信号转导途径的重要信号分子[59],图1显示了脂肪酸代谢的基本途径[60]。
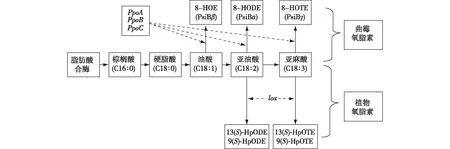
注:脂肪酸通过植物中的lox基因和曲霉菌中的PpoA/B/C基因产生氧脂素。Psi—lipogenic signal molecules脂肪生成的信号分子;lox—脂氧合酶基因;PpoA、PpoB、PpoC—产生Psi的加氧酶基因;8-HOE—8-羟基油酸;8-HODE—8-羟基亚油酸;8-HOTE—8-羟基亚麻酸;9(S)-HpODE—9(S)-氢过氧亚油酸;13(S)-HpODE—13(S)-氢过氧亚油酸;9(S)-HpOTE—9(S)-氢过氧亚麻酸;13(S)-HpOTE—13(S)-氢过氧亚麻酸图1 曲霉属和植物脂肪酸代谢的基本途径Fig.1 Basic pathways of fatty acid metabolism in Aspergillus and plants
最早在模型丝状真菌构巢曲霉中发现了涉及氧脂素的密度依赖性信号传导机制,氧脂素与真菌的形态转化和次级代谢物的产生有关。在构巢曲霉中,Ppo基因编码3种双加氧酶(PpoA、PpoB和PpoC)催化亚油酸加氧生成氧脂素,敲除一个或多个Ppo基因会影响次级代谢物杂色曲霉素(sterigmatocystin)和青霉素(penicillin)的产生,当全部Ppo基因缺失,会导致无性孢子到有性孢子的转换[61]。
在土曲霉培养基中添加氧脂素的前体物质亚油酸,可增加洛伐他汀(lovastatin)生物合成基因lovB和lovF的转录水平,提高洛伐他汀的产量并降低孢子形成率[32]。曲霉属真菌中存在的脂氧合酶(LOX)是脂肪酸代谢途径的关键酶,LOX与Ppo 蛋白一起调节黄曲霉的群体感应,lox或Ppo突变会改变密度依赖性的菌核及分生孢子的转换,并且影响毒素产生,高细胞密度(>105个孢子/板)下,野生型黄曲霉的分生孢子增多,菌核减少,产生的黄曲霉毒素(AF)降低,而突变体与之相反,菌核增加而分生孢子减少,此外突变菌株在任何群体密度下均产生高水平的AF[16]。植物来源的亚油酸氧化产物如羟基十八碳二烯酸(HODE)、氢过氧化十八碳二烯酸(HpODE)和氢过氧化十八碳三烯酸(HpOTE)等可以影响曲霉的营养生长、形态转化及真菌毒素的合成[62]。13(S)-HpODE和13(S)-HpOTE可以抑制AF合成,9(S)-HpODE能够促进AF合成[63],13(S)-HpODE可以促进分生孢子的产生而9(S)-HpODE可以促进子囊孢子的产生[64],植物氧脂素与真菌的氧脂素有相似的结构与功能,这说明氧脂素还可参与有机体间的信号传递,影响曲霉-宿主互作[65]。在赭曲霉中,类lox基因AoloxA的表达产物脂氧合酶能够催化亚油酸发生加氧反应,生成脂过氧化物9(S)-HODE和13(S)-HODE,影响赭曲霉形态及赭曲霉毒素(OTA)的合成,敲除赭曲霉菌株的lox基因后,氧脂素水平降低,形成的分生孢子数减少,菌核数目增加,OTA合成受到抑制[66],最新的研究表明,外源添加9(S)-HODE抑制赭曲霉菌落生长和孢子产生,促进OTA产生,而13(S)-HODE促进赭曲霉菌落生长和孢子产生,抑制OTA产生[17]。
2.3 α-(1,3)-葡聚糖
荚膜组织胞浆菌是一种腐生真菌,在土壤中以自由生活的雾化菌丝形态存在,一旦被人或其他哺乳动物吸入就可以转变为酵母形式,并以密度依赖的方式产生一种特定的细胞壁多糖:α-(1,3)-葡聚糖[67],且高密度的酵母细胞产生比低密度下更多的α-(1,3)-葡聚糖。已有研究发现α-(1,3)-葡聚糖是荚膜组织胞浆菌酵母形态细胞的一种特有物质,能够保护酵母细胞免受宿主吞噬溶酶体的伤害[28],调节酵母在宿主巨噬细胞内的增殖并且影响胞内潜伏期的建立[7]。α-(1,3)-葡聚糖的生物合成与菌株的毒力有关,荚膜组织胞浆菌菌株可以根据细胞壁组分的差异分为两种化学型,化学型Ⅱ酵母细胞的细胞壁包含一层α-(1,3)-葡聚糖,可掩盖宿主吞噬细胞上模式识别受体Dectin-1对免疫刺激性β-(1,3)-葡聚糖的识别[68],而化学I型酵母细胞中缺乏α-(1,3)-葡聚糖,没有发生β-葡聚糖的掩蔽,Dectin-1受体识别β-葡聚糖,进一步增强了宿主吞噬细胞的吞噬作用[69]。因此在荚膜组织胞浆菌中,化学型I细胞的体外毒力与化学型II细胞相比有所降低。尽管体内实验证明化学型I细胞仍保持了毒性,但这可能是由于该细胞内α-葡聚糖合酶AGS1基因表达产生的某种信号因子部分地掩盖了化学型Ⅰ酵母毒力对α-(1,3)-葡聚糖的需求[70]。
2.4 信息素
信息素作为一种信号分子,于1974年被报道参与某些真菌的性周期[71]。在酿酒酵母中,不同的交配类型细胞根据MAT位点的等位基因不同,产生两种信息素中的一种,并识别另一种,a细胞产生信息素a因子,α细胞产生信息素α因子。信息素一经释放就会在环境中自由扩散形成浓度梯度,被细胞表面的跨膜受体识别,Ste2p和Ste3p是G蛋白偶联受体(GPCR),a细胞上Ste2p受体结合α因子,α细胞上Ste3p受体结合a因子,信息素的结合可将相关的异源三聚体G蛋白分离为单体α亚基GTPase(Gpa1p)和βγ二聚体(Ste4p-Ste18p),在Ste5p的参与下激活蛋白激酶级联反应,并最终磷酸化2个MAP激酶Fus3p和Kss1p;然后,磷酸化的Fus3p迁移至细胞核,通过激活核内转录因子Ste12p来触发与细胞形态相关的基因表达,细胞形成了shmoo(酵母细胞向交配对象形成的极化,以1948年首次出现的卡通人物命名,形状类似于拉长的酵母细胞),当shmoos接触时发生原生质融合,开始性循环的第一步[8]。信息素同样影响白色念珠菌的性周期,与酿酒酵母的通过减数分裂结束性循环不同,白色念珠菌不发生减数分裂,配子融合形成四倍体,此四倍体细胞通过染色体的随机丢失恢复天然二倍体形态。白色念珠菌存在白色-不透明细胞表型的转换,只有不透明细胞是交配感受态形式,通过在形态上对信息素浓度梯度做出响应产生shmoo,但信息素可以通过增强白色细胞的黏附性促进白色细胞形成生物膜,通过形成信息素浓度梯度来促进不透明细胞进行交配[72]。另外信息素通讯的机制在多种真菌中具有广泛的意义,如荚膜组织胞浆菌[73]和烟曲霉[74]这样的子囊菌,以及新隐球菌[75]和玉米黑粉菌等担子菌[76],信息素通过促进生物体响应环境的改变而进化的能力,支持细胞之间遗传物质的交换。
2.5 挥发性化合物及气体
除了将信号分子释放到溶液或固体介质外,生物还可以通过释放和接收空气中的信号分子进行信息交流。早在20世纪70年代就有真菌生长受到来自真菌或其他生物的挥发性化合物影响的描述[77],在复合琼脂培养基上生长的酿酒酵母菌落产生挥发性小分子氨,在另一菌落附近形成浑浊带,氨的产生需要氨基酸,当调控几种氨基酸渗透酶正确定位的SHR3基因失活,菌落之间则不再产生浑浊路径[78]。在木霉属真菌中发现,可以产生一种具有抗真菌活性的挥发性次级代谢物6-戊基-α-吡喃酮[79],研究发现木霉菌种中诱导分生孢子的形成除了受到昼夜节律周期调节外也可以通过挥发性试剂来控制,3种8碳化合物:1-辛烯-3-醇、3-辛醇和3-辛酮能够在黑暗条件中诱导分生孢子产生[80],作用效果与浓度有关,1-辛烯-3-醇作用浓度仅为0.1 μmol/L,这3种化合物中任何一种的浓度超过500 μmol/L都会抑制木霉菌种的分生和生长,暗示了其抑制真菌的作用[81]。
除了自身产生的挥发性物质可以作为真菌的信号分子,呼吸作用产生的CO2也会影响真菌的生命活动。最早的研究中发现,黑曲霉分生孢子萌发的最适CO2体积分数为0.5%,而非正常大气中的0.033%[82]。除此之外,链格孢属菌和决明链格孢的孢子形成[83],克雷索孢菌的分生以及新孢梭菌的荚膜形成和交配都受环境中CO2浓度变化的影响[9]。在白色念珠菌中,酵母形态向菌丝形态的转化是由环境中的CO2浓度升高引起的[84],另外与大气中CO2浓度相比,高碳酸环境中的白色细胞到不透明细胞的转换频率可增加16倍,这两种表型均涉及腺苷酸环化酶Cyr1,Cyr1失活则高碳酸环境不能引起的白色念珠菌菌丝形态的形成以及白色-不透明转换频率的升高[85]。
3 群体感应猝灭与群体感应抑制剂
微生物基于QS机制产生QSM能够调控抗生素产生,还可以诱导其他微生物凋亡,而微生物在互作竞争进化的过程中可能会形成有效对抗QS的机制来保护自身,这称为群体感应淬灭(QQ)。QQ能够抑制信号分子的合成和积累,或对信号分子进行降解和修饰,破坏微生物群体感应系统,从而阻断其带来的不利影响,能够有效降低群体感应调控基因表达能力的小分子称为群体感应抑制剂(QSI)[86]。Bin等[87]研究发现,从土壤及植物样本中分离出的微生物能产生高效降解QSM的群体淬灭酶。QSI大部分是群体感应通讯信号的结构衍生物,当环境中微生物产生的QSM达到阈值时,QSM会与其特异性受体结合并生成次级信号,随后这些次级信号依次与各种启动子受体结合,诱导靶标基因表达变化,故可以通过3种方式来阻止QSM传递:①阻碍QSM的产生;②QSM的酶促降解;③阻断QSM与对应受体分子的相互作用,从而抑制调节基因表达的二级信号产生[8]。研究发现细菌产生并接收的信号分子N-酰基高丝氨酸内酯(AHLs)能够调节细菌抗生素的抵抗性以及毒力因子的产生[88],而其他微生物、植物甚至动物能产生抑制AHL的QSI从而阻断相关QS功能[89-90]。类似的,不同来源的真菌次级代谢物可对其他微生物起QSI作用,可削弱微生物的致病性,如海洋红藻(Deliseapulchra)生产的卤代呋喃酮可抑制碳青霉烯类抗生素的合成,并抑制植物病原体欧文氏菌中致病因子的产生[60]。此外,各种群体感应分子也可以充当QSI(表2)。例如,法尼醇除了是白色念珠菌的QSM,还可作为禾谷镰刀菌[47]、表皮葡萄球菌、金黄色葡萄球菌[91]、巴西副球孢子菌[56]和其他细菌的非白色念珠菌的抗菌剂。法尼醇与某些抗生素结合使用时可影响表皮葡萄球菌[92]、副枝梭菌[93]和热带念珠菌[94]的生物膜形成,从而抑制细胞生长,除此之外法尼醇还会影响构巢曲霉的凋亡[95]。
4 总结与展望
群体感应作为微生物间的交流机制,揭示了同一生态系统中各物种共同进化的本质,群体感应信号分子通过密度依赖性对细胞间的信号传递起决定性作用,不仅仅影响微生物自身的生长发育和次级代谢物的产生,同时还能与其他微生物、植物甚至是动物互作,同时真菌产生的群体感应抑制剂破坏QS系统或QS介导的其他微生物种群的信号传导是不同微生物种群之间协调和共存的另一重要手段。细菌的群体感应机制研究相对深入,但真菌的群体感应研究仍处于起步阶段。尽管在更多的微生物群体感应现象的探索以及群体感应信号分子的作用机制等方面还存在许多有待阐明的问题,但是微生物群体感应机制在各个领域的应用已展现出诱人前景,比如针对病原菌,利用QS影响致病性毒力因子的生成可实现医学上的抗病毒治疗;对于农业上的污染菌,可利用生物防治或从源头抑制毒素的产生;对于非病原的商业化用菌,可以实现工业上的代谢物产量提高以及新产品开发,此外在环境污染的防治、垃圾降解等方面都已成为可能并有着良好的应用前景。
