油菜抗菌肽基因BnCRP1的克隆表达和活性分析
2020-05-24曹慧慧闫艳华黄军艳程晓晖刘胜毅
曹慧慧 王 磊 闫艳华 林 田 柯 涛 黄军艳 程晓晖 刘胜毅
(中国农业科学院油料作物研究所;农业部油料作物生物学与遗传育种重点实验室1,武汉 430062)(唐山市食品药品综合检验检测中心2,唐山 063000)(南阳师范学院生命科学与技术学院3,南阳 473061)
抗菌肽(antimicrobial peptides,AMPS)是一类对细菌、真菌等微生物有抑制或杀灭作用的天然小分子多肽,在自然界中分布广泛,普遍存在于动物、植物、微生物、昆虫和细菌中,是机体非特异性免疫的重要组成部分。抗菌肽因其抗菌机理独特,具有高效、环保、抑制病原菌产生耐药性等优点,在生物防治、养殖饲料、食品添加剂和医学上具有良好的应用,同时也是未来抗生素的理想替代品[1-3]。
植物源抗菌肽又称为植物防御素,是植物体内合成的能够防御外界微生物侵害的一类小分子多肽,是植物防御系统的屏障。植物源抗菌肽的特点是其氨基酸序列中通常富含半胱氨酸,容易形成二硫键,因此植物抗菌肽也被称为半胱氨酸富集类多肽。按照氨基酸序列及二级结构,已发现的植物抗菌肽至少可以分为8个家族:植物防御素(Plant defensins)、脂转移蛋白(Lipid Transfer Proteins,LTPs)、硫素(Thionins)、蜕皮素(Snakins)、橡胶蛋白类 (Hevein-like)、打结素类(Knottin-likePeptides)、凤仙花素(IbAMP)、MBP1等[4],它们的分子质量大小一般为2~9 ku,氨基酸序列中含有的半胱氨酸能够形成2~6个二硫键起到稳定蛋白结构的功能。与动物来源的抗菌肽相比,植物源抗菌肽由于其作用温和、对动植物细胞没有毒性,易于在作物中表达和调控,不易被细胞内的蛋白酶降解等优点,在各个领域中应用更加广泛,且由于植物源抗菌肽不会造成环境污染和药物残留等问题,长期使用也不会使病原菌产生耐药性,具有开发成为抗真菌生物制剂的潜力,可以作为抗生素和化学杀菌剂的最佳替代产品。抗菌肽目前在植物病害防控中的应用,主要是利用基因工程手段将抗菌肽基因转化植物中达到抗病的作用。植物源抗菌肽都具有广谱抗真菌或细菌活性,在一种植物中发现的抗菌肽可以有效应用到其他多种植物中。如将萝卜中来源的抗菌肽Rs-AFPs通过转基因的方法转到马铃薯和小麦中分别达到抗马铃薯晚疫病和小麦镰刀的效果[5-7]。抗菌肽作为新兴抗病基因资源,对改良水稻、大豆、棉花、油菜等作物对真菌病害的抗性有着重要意义。植物源抗菌肽具有相对于动物源抗菌肽的诸多优点,但是,目前植物来源的抗菌肽还很难真正应用到农业生产实践中。主要原因是目前鉴定的有功能的植物来源抗菌肽数量很少,抗菌肽数据库中经过验证的抗菌肽基因目前达到3 055个,而植物抗菌肽仅有345个[8]。因此高效地预测具有功能的新型植物抗菌肽,并实现其高水平表达成为获得新型植物抗菌肽基因的主要技术难点,本研究充分利用生物信息学、分子生物学和微生物学等主要技术手段,利用公共数据库中油菜EST序列信息和本实验室已经完成的甘蓝型油菜亲本种白菜和甘蓝及甘蓝型油菜全基因组测序数据信息[9-11],通过生物信息学分析手段,预测油菜中新的抗菌肽候选基因,获得了一批与已知抗菌肽有类似序列结构的候选基因,从中筛选出感兴趣的基因,利用特殊的表达纯化标签体系进行原核表达和体外抗菌活性检测,获得了一个新的对细菌、酵母和植物病原真菌核盘菌都具有明显抑菌活性的转脂蛋白抗菌肽基因BnCRP1,为高通量发掘和筛选植物抗菌肽基因提供了借鉴,为植物抗病遗传改良提供新基因源。
1 材料和方法
1.1 材料
菌株:用于克隆和活性检测的大肠杆菌(Escherichiacoli)XL-10-Gold ATCC2592、用于原核表达的大肠杆菌BL21(DE3)菌株均购自Novagen公司;用于活性检测的革兰氏阳性菌藤黄微球菌(MicrococoluteusACCC11001),用于活性检测的毕赤酵母(Pichiapastoris)GS1115、核盘菌(Sclerotiniasclerotiorum)为实验室所保存。载体pET30α-EDDIE-GFP[12]为本实验室所构建、保存。
主要试剂:DNA聚合酶、DNA Marker、Tricine、Urea、DTT、IPTG;低分子质量蛋白质Marker。质粒抽提试剂盒、胶回收试剂盒。
1.2 方法
1.2.1 抗菌肽基因的预测
本实验室开展了甘蓝型油菜亲本种白菜(Brassicarapa,AA, 2n=20)和甘蓝(Brassicaoleracea,CC, 2n=18)以及甘蓝型油菜(B.napus,AACC,2n=38)全基因组测序信息并建立了可供查询的数据库(http://brassicadb.org/brad,http://www.ocri-genomics.org/bolbase,http://www.genoscope.cns.fr/brassicanapus/BoulosChalhoub)[10,13,14];此外,还进行了油菜不同组织包括根、茎、叶、角果等的表达谱分析,获得了大量的EST数据信息。根据油菜序列信息,与已有的抗菌肽数据库(如ANTIMIC[15]、APD[8]、APPDB[16]和PhyAMP[17]等)收录的抗菌肽序列进行BLAST比对,筛选出一些与已知抗菌肽具有类似结构的抗菌肽候选基因,并对这些筛选得到的候选抗菌肽基因进行结构预测和分类,最终获得潜在的新抗菌肽基因。
1.2.2 抗菌肽基因BnCRP1的合成和表达
pET30α-EDDIE-BnCRP1的构建根据获得的BnCRP1抗菌肽基因的DNA序列,利用DNA Works软件[18],对其进行密码子优化(根据大肠杆菌密码子进化优化)并设计引物,通过Overlap-PCR的方法合成目标基因序列[19]。合成Overlap-PCR引物序列4条(表1)。载体线性化引物为Backbone-F:TGAGATCCGGCTGCTAACAAAGCCC和Backbone-R:GCAGCTGGTCACCCACAGCG。
根据Ke等[12]报道的方法,将BnCRP1基因连接到融合表达载体pET30α-EDDIE-GFP上。先将pET30α-EDDIE-GFP载体利用Backbone-F: TGAGATCCGGCTGCTAACAAAGCCC和Backbone-R:GCAGCTGGTCACCCACAGCG引物通过PCR扩增进行载体线性化,采用50 μL体系:10×Taq buffer(含MgCl2)5 μL,1.5 mmol/L dNTP(10 mmol/L)5 μL,5′引物(10 μmol/L)2 μL,3′引物(10 μmol/L)2 μL,Taq(5 U/μL)1 μL,DNA 模板5 μL,ddH2O 31 μL。反应条件为94 ℃ 5 min,94 ℃ 30 min,60 ℃ 30 s,72 ℃ 6 min,25个循环;72 ℃后延伸10 min。

表1 Overlap-PCR引物序列
注:下划线的序列与载体PET30α-EDDIE-GFP同源,其余为目标基因的特异性引物。
1.0%琼脂糖凝胶电泳检测大小正确后,电泳后切胶回收6 kb线性化载体片段。
采用Overlap-PCR技术获得BnCRP1基因全长。PCR反应体系如下:总的反应体系为50 μL,内含:10×Taq buffer (含MgCl2)10 μL,1.5 mmol/L dNTP(10 mmol/L)4 μL,引物back bone F和backbone R各加入1 μL(浓度为10 mmol / L),引物BnCRP_1、BnCRP_2、BnCRP_3和BnCRP_4各加入1 μL(浓度为2 mmol/L),Taq(5 U/μL)1 μL,ddH2O 33 μL。反应条件为94 ℃ 5 min,94 ℃ 1 min,58 ℃1 min,72 ℃ 2 min 30 s,25个循环,72 ℃后延伸10 min,扩增大小为102 bp。采用反向PCR技术,将BnCRP1基因连接到表达载体pET30a/His-EDDIE-GFP上。具体为利用30α backbone-F和30α backbone-R引物,通过反向PCR扩增,将pET30a/His-EDDIE-GFP载体线性化。将回收到pET30a/His-EDDIE-GFP线性化载体片段与通过Overlap-PCR扩增回收得到的BnCRP1全长DNA片段,同时转化大肠杆菌XL10-Gold菌株,通过体内定点同源重组,将BnCRP1基因连接到表达载体pET30a/His-EDDIE-GFP上,获得目的基因融合表达载EDDIE-BnCRP1。
1.2.3 抗菌肽基因BnCRP1的体外诱导表达和分离纯化
为解决抗菌肽异源表达的诸多问题,本研究采用一种新的融合表达抗菌肽的方法,采用猪瘟病毒蛋白突变体EDDIE为融合蛋白,以包涵体形式在大肠杆菌BL21中高效表达抗菌肽,以减少抗菌肽对宿主的毒性作用。在包涵体蛋白纯化、复性后,EDDIE重新正确折叠,恢复其自剪切能力,在特异位点Cys168和Cys169处把C端融合的抗菌肽剪切下来,从而获得不增加任何多余氨基酸的抗菌肽产物。该方法不需要添加任何化学物质和酶来去掉融合标签,对宿主无毒性,纯化过程简单,剪切后可直接用来检测对病原菌的抗菌活性,最高目标产量可以达到12 g/L。
将测序正确的表达载体pET30α-EDDIE-BnCRP1质粒,用热激法转化到BL21(DE3)感受态细胞中,在加有卡那霉素的LB平板上划线挑取单菌落,并接种于含有终浓度为50 μg/mL卡那霉素的LB液体培养基中,37 ℃振荡过夜,然后以100∶1的比例接种至LB液体培养基中,同样条件下培养3 h至OD600=0.6左右时,加入终浓度为1 mmol/L的IPTG诱导表达6 h,用破菌缓冲液(20 mmol/L Tris-HCL,2 mmol/L EDTA, pH 8.0)冰浴条件超声破碎5 min,4 ℃条件下5 000 r/min 离心15 min收集包涵体沉淀,将收集到的沉淀用缓冲液(1% TritonX-100,1 mol/L NaCL)清洗2次,再次收集菌体。以体积比10∶1的比例将包涵体溶于尿素变性缓冲液(8 mol/L Urea, 50 mmol/L Tris pH 7.5, 25 mmol/L DTT)中,室温条件下振荡2 h,4 ℃条件下2 000r/min离心20 min,取上清液,然后按照1∶50的比例快速稀释到复性缓冲液(500 mmol/L NaCL, 20 mmol/L Tris,2 mmol/L EDTA,5% Glycerol , 0.2 mmol/L Arginine,10 mmol/L DTT,0.01% Tween-20,pH 8.5~9.5)中,室温放置6 h复性。复性的过程即是EDDIE蛋白发生自剪切的过程,利用Tricine-SDS-PAGE 电泳检测剪切结果,并利用NanoDrop-2000测定复性后抗菌肽的蛋白浓度。
1.2.4 抗菌肽BnCRP1的体外活性测定
抗菌肽BnCRP1对细菌抑菌活性的测定分别以藤黄微球菌为革兰氏阳性菌代表,大肠杆菌为革兰氏阴性菌代表,用牛津杯法[20]在每个牛津杯中加入浓度为3 mg/mL的人工表达纯化的抗菌肽溶液200 μL,并以相同浓度的委托生物公司化学合成抗菌肽作为对照,37 ℃环境下(酵母培养温度为22~25 ℃)培养12~16 h(酵母培养时间为48 h),通过测定抑菌圈的大小来确定抗菌肽的活性,共进行3次实验,每次实验进行3个技术重复。
抗菌肽BnCRP1对植物病原菌核盘菌的抑菌活性的鉴定方法:1)菌核与菌丝块的处理:选择完好的核盘菌菌核,用10 mL左右的75%酒精浸泡1 min,然后在10 mL 0.1%的HgCl2中浸泡消毒8~10 min,随后用无菌水冲洗3~5次,把灭菌菌核切掉两端,中间部分切成绿豆大小的颗粒,接种于PDA平板上,切面朝下放置。通常每粒菌核接种1板,1次接种8~9板。当菌丝即将铺满平板时,用直径为2 mm的打孔器沿菌丝外缘打孔,取菌丝块,用于再次接种;2)菌丝培养:将用打孔器去除的菌丝块置于新的PDA平板的正中间位置,使含有菌丝的一面接触PDA平面,放置于22 ℃条件下静置培养3~4 d;3)抑菌活性的检测:PDA平板上培养好的菌丝用打孔器取最外圈生长良好的菌丝块置于新的PDA平板上,在菌丝块的上下左右的位置各放置1个牛津杯,分别加入人工合成纯化的抗菌肽和化学合成的抗菌肽,继续培养48 h,观察抑菌情况。细菌抑菌率的计算可通过直接测量抑菌圈的大小来完成,真菌抑菌率的计算方法按照:抑菌率=[空白对照菌丝半径(a)-抗菌肽作用后菌丝半径(b)]/空白对照菌丝半径(a)×100%,菌丝半径的计量单位为cm。
为了检测抗菌肽BnCRP1作为生防制剂用于植物对真菌性病害的抗性潜力,通过在植物叶片表面进行喷施一定浓度的人工纯化抗菌肽溶液,然后在喷施过抗菌肽的植物叶片上接种病原真菌,36 h后测定病斑的大小,同一条件下未喷施的植物叶片作为对照。具体实验方法是:选取生长5周左右的拟南芥叶片,在叶片表面均匀涂抹一层浓度为5 ng/μL人工表达纯化后的抗菌肽BnCRP1,同时在PDA平板上培养核盘菌,当菌丝即将铺满整个平板时,用直径为1 mm的打孔器沿菌丝边缘打孔,取菌丝块,用于拟南芥的接种。用注射器针头将打孔器取出的菌丝块置于拟南芥的叶片正中央的位置,使含有菌丝的一面接触叶片表面,同时在未涂抹抗菌肽的拟南芥叶片上按照同样的方法进行接种核盘菌菌丝块作为对照,22 ℃条件下,湿度保持在90%培养36 h后观察感病情况,并测量各个叶片上的病斑的大小。
2 结果与分析
2.1 抗菌肽基因的预测和序列结构分析
与已知的抗菌肽数据库中抗菌肽进行氨基酸序列的同源性比对,从基因组水平上高通量筛选出一批与已知抗菌肽有类似序列结构特征的候选抗菌肽基因。将BnCRP1的氨基酸序列与已知的抗菌肽数据库中的抗菌肽进行同源序列比对发现,与APD数据库中编号为AP01582来源于黄星桑天牛(Psacotheahilaris)中的一类3D结构为Bridge类隶属于Knottin~Type打结素类抗菌肽的相似性最高,相似度达到36.36%,这种由黄星桑天牛中分离到的bridge类抗菌肽具有较强的抗革兰氏阳性菌、抗革兰氏阴性菌和抗真菌活性[21]。
通过蛋白结构分析网站,对BnCRP1的蛋白结构进行分析和预测,发现抗菌肽BnCRP1主要表现为螺旋结构,其序列组成中的9个半胱氨酸能够形成4对二硫键,起到稳定抗菌肽结构的作用。蛋白结构预测显示BnCRP1的二级结构中由50%的α螺旋和50%的无规卷曲组成。这种蛋白结构决定了它所发生的抗细菌和抗真菌的作用模式为通过破坏细胞膜的机制来达到抑菌的作用[22]。蛋白三维结构预测的结果也支持该结果,从N端形成一个大的α螺旋,其余部分形成无规卷曲的结构(图1)。

图1 抗菌肽BnCRP1的二级结构
2.2 抗菌肽基因BnCRP1的合成和原核表达载体的构建
Overlap-PCR合成目标基因,经1%琼脂糖凝胶电泳后检测,条带大小为102 bp,符合预期(图2),以构建的BnCRP1原核表达载体pET30α-EDDIE-BnCRP1为模板,用基因特异性引物进行扩增,电泳检测结果显示,重组子的条带大小与合成目标基因条带大小一致,通过测序证明本研究构建的pET30α-EDDIE-BnCRP1正确。
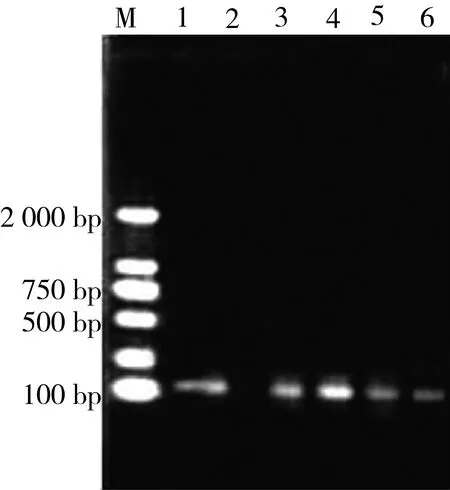
注:M为2 000 bp DNA ladder;1为表达载体重组子;2为阴性对照;3~6为BnCRP1人工合成基因。图2 Overlap PCR合成BnCRP1基因的琼脂糖凝胶电泳
2.3 抗菌肽BnCRP1的体外诱导表达和分离纯化
按照1.2.3所描述的方法,重组蛋白pET30α-EDDIE-BnCRP1诱导表达后,将上清液和沉淀分别进行SDS-PAGE检测,结果如图3a所示,泳道1~6在21 ku处有一条表达量明显增大的条带(图3a中箭头所示),且大小符合EDDIE-BnCRP1融合蛋白的预期,说明EDDIE-BnCRP1融合蛋白主要存在于沉淀中,并且是以包涵体的形式进行表达。融合蛋白包涵体复性后,通过Tricine-SDS-PAGE电泳检测融合蛋白EDDIE-BnCRP1的自剪切效果,结果如图3b中所示,泳道1和2在3.6 ku处有一条抗菌肽BnCRP1的目的条带,说明EDDIE在复性后能够将抗菌肽BnCRP1目的蛋白进行高效自剪切。
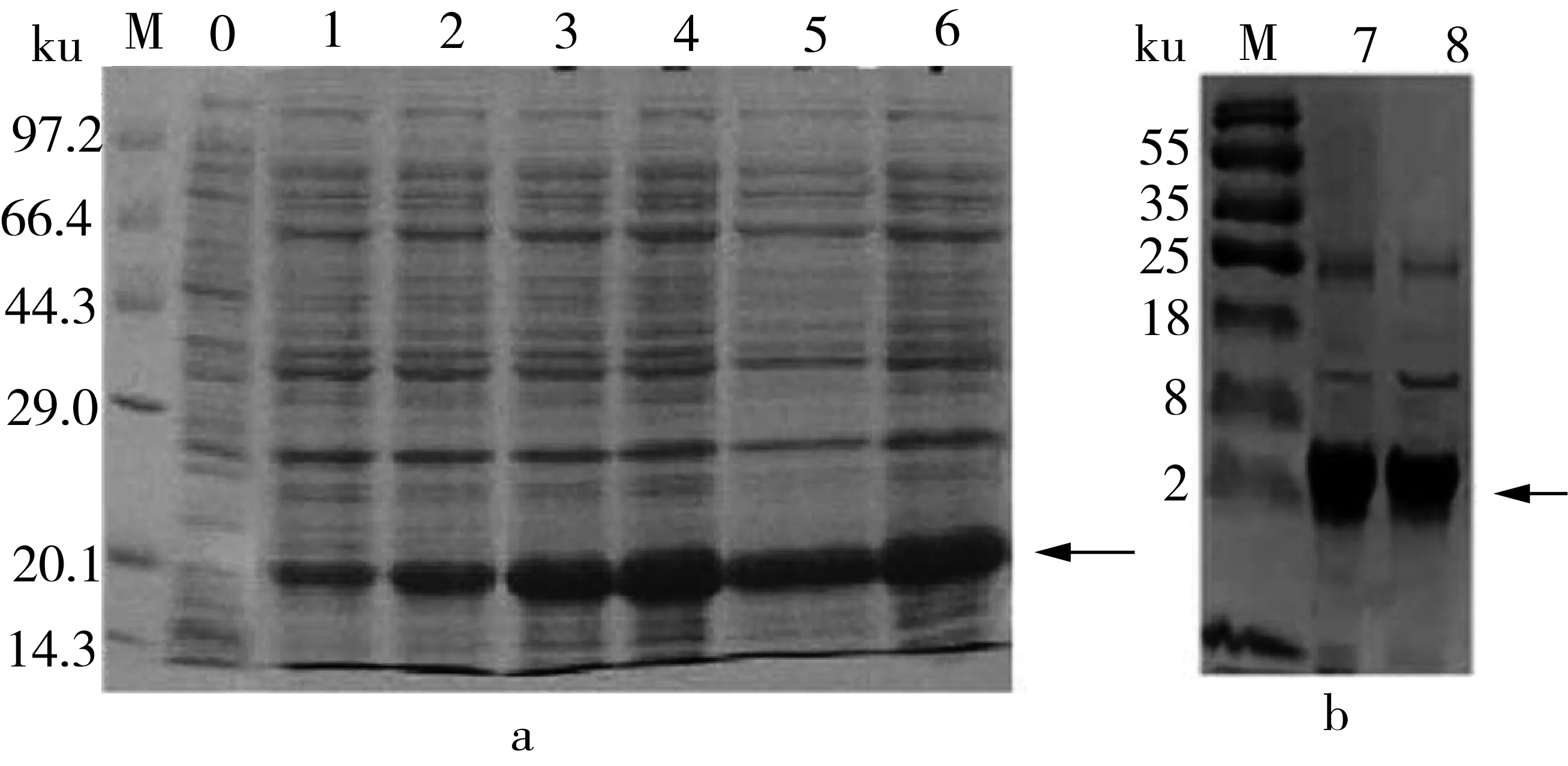
注:0为EDDIE-BnCRP1上清;1~6为EDDIE-BnCRP1沉淀;7~8为复性后6 h的融合蛋白EDDIE-BnCRP1; M为小分子量蛋白标记。图3 表达蛋白EDDIE-BnCRP1(a)和EDDIE-BnCRP1复性后(b)的SDS-PAGE图
2.4 抗菌肽BnCRP1的抗菌活性测定
分别以大肠杆菌为革兰氏阴性菌代表,藤黄八叠球菌为革兰氏阳性菌代表,酵母菌为真菌代表,以复性液作为对照,对复性后的BnCRP1进行抑菌实验检测。结果如图4所示,同时检测了抗菌肽BnCRP1对植物病原菌核盘菌的抑菌活性。结果显示,人工合纯化抗菌肽BnCRP1和化学合成抗菌肽BnCRP1具有明显的抑菌效果。而以复性液为对照的牛津杯周围并未出现明显的抑菌圈,经过3次生物学重复测量得到抗菌肽BnCRP1对大肠杆菌、藤黄八叠球菌和酵母菌的平均抑菌直径分别为1.53、1.11和1.67,对核盘菌的抑菌率达到了70%。
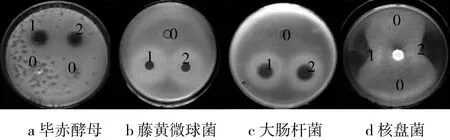
注:0为复性缓冲液;1为体外表达纯化抗菌肽BnCRP1; 2为化学合成抗菌肽。图4 抗菌肽BnCRP1 抗细菌和真菌活性检测
2.5 抗菌肽BnCRP1在植物抗病中的应用
为了研究抗菌肽BnCRP1作为生防制剂在植物真菌性病害防治中的作用,通过在拟南芥叶片涂抹或喷施抗菌肽BnCRP1并接种核盘菌的方法,检验抗菌肽对植物真菌性病害的抗病潜力,结果如图5所示,涂抹抗菌肽的拟南芥叶片与未涂抹抗菌肽的拟南芥叶片相比,接种核盘菌36 h后的病斑面积显著减小。这说明在植物叶片喷施抗菌肽BnCRP1有显著抑制核盘菌侵染扩散的作用,有效提高了植物对植物病原真菌核盘菌的抗性。
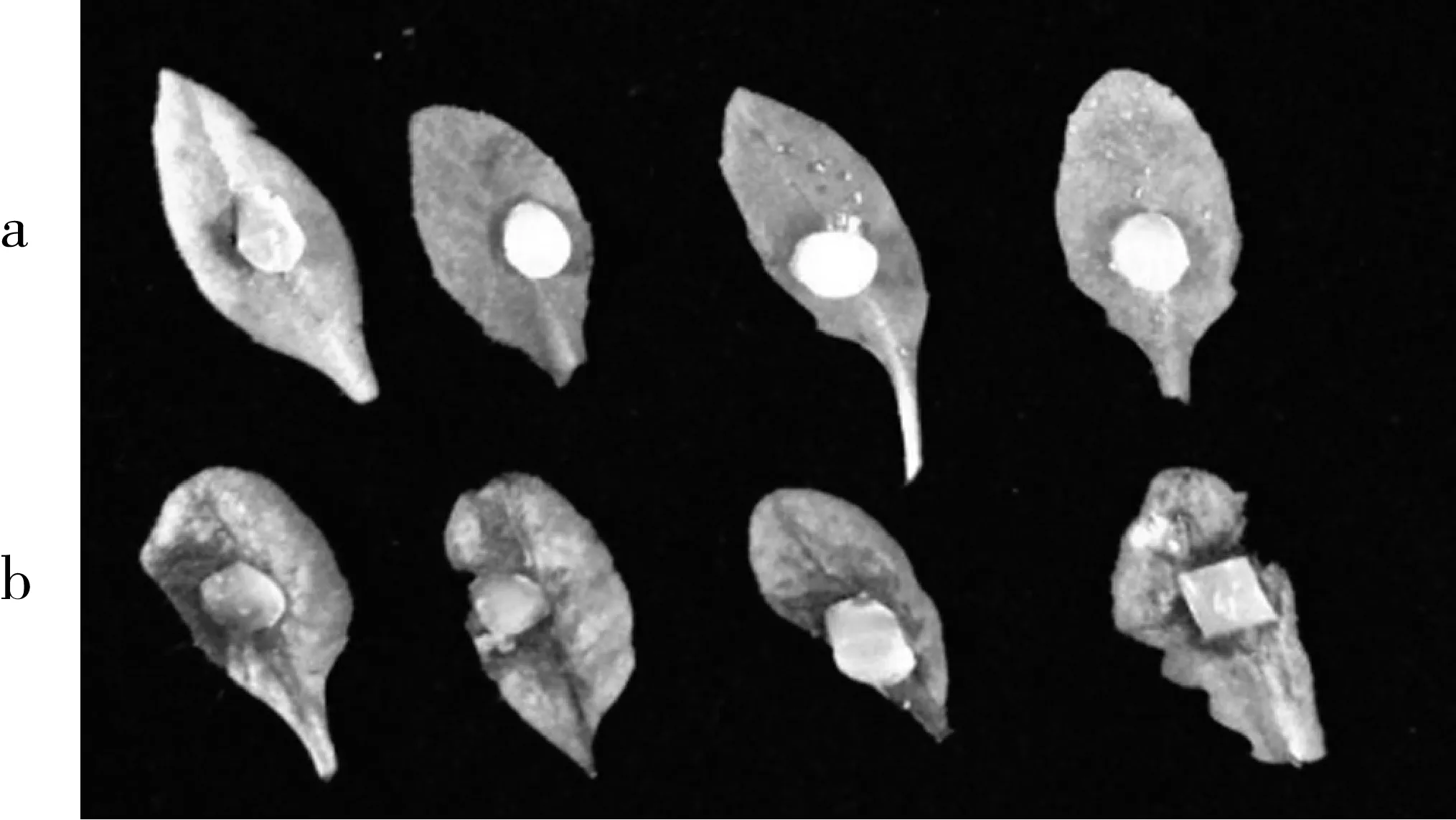
注:a为表面涂抹抗菌肽BnCRP1的拟南芥叶片;b为表面未涂抹抗菌肽BnCRP1的拟南芥叶片。图5 拟南芥离体叶片接种核盘菌抗病鉴定
3 讨论
植物病原真菌是植物的重要病原菌,可引起80%以上的植物病害,造成世界粮食作物减产约20%。许多重要植物病害都是真菌造成的,如马铃薯晚疫病、稻瘟病、小麦白粉病、玉米大小斑病菌、大豆灰斑病、油菜菌核病等,每年都造成巨大的经济损失。另外,真菌在侵染植物的过程中,释放出来的代谢产物—真菌毒素(mycotoxin),对农作物以及人类的健康也造成极大的危害,如黄曲霉毒素(aflatoxin)等。核盘菌(Sclerotiniasclerotiorum)属于子囊菌亚门、盘菌纲、柔膜菌目、核盘菌科、核盘菌属。是一种危害作物和蔬菜的世界性的重要的植物病原菌。核盘菌可以广泛地侵染很多单子叶和双子叶植物。核盘菌引起的菌核病是一种类似于灰霉的腐生营养型真菌,这种破坏性病源侵染超过400种植物,分布广泛。油菜是世界上重要的油料作物之一,菌核病造成油菜的根、茎和角果的腐烂,导致了巨大的产量损失。尽管菌核病严重威胁了农业生产,植物对核盘菌的寄主抗性的分子机制依然不清楚。迄今为止还没有发现完全免疫或者高抗的油菜栽培品种,因此,探究植物对这种病源的抗性机制,发现新的抗性基因具有深远意义。
目前常用的植物病害防治措施,主要依靠化学农药,然而化学防治不仅成本高、污染环境,而且防效也不理想,食品的安全性也受到严重影响。随着社会的进步,人们越来越深刻地认识到长期大量使用化学农药对生态环境和人类健康的危害。生物防治可以有效地克服这些弊端,因而生物农药越来越受到人们的重视。抗菌肽(antimicrobial peptides,AMPs)因其高效、环保、不使病原菌产生耐药性等优点使其在生物防治和医学上具有良好的应用前景。
对抗菌肽的研究虽然取得了较大的进展,但抗菌肽在大规模的生产应用中还存在很多问题:一是抗菌肽的来源及提纯问题,天然的抗菌肽资源有限,而且天然抗菌肽含量很低,提取纯化难度较大,化学合成成本昂贵,这些现有的困难不利于抗菌肽的大规模应用,另外通过基因工程方法获得抗菌肽容易被蛋白酶消解;二是活性问题,抗菌肽氨基酸序列短,其活性与其空间结构密切相关,通过化学合成或者基因工程获得的抗菌肽空间结构上无法与天然抗菌肽保持一致,因此无法保证与天然抗菌肽具有一样的活性。抗菌肽研究面临的挑战一方面要不断提高和改善抗菌肽的抗菌活性和稳定性,另一方面由于抗菌肽具有先天免疫调节作用,可以增加其先天防御调节中的应用,随着对抗菌肽作用机理及转基因技术的不断深入研究与应用,光谱、高效、低毒的抗菌肽将在农业、食品、医药领域发挥更加重要的作用,为人类创造更大的价值。
4 结论
本研究通过生物信息学手段,利用已有的油菜全基因组测序信息和抗菌肽数据库信息,获得抗菌肽新基因BnCRP1,并实现了BnCRP1在大肠杆菌中的融合表达、复性、自剪切和纯化,获得了具有生物活性的BnCRP1蛋白产物。本研究为利用生物信息手段和基因工程技术大规模鉴定新植物来源抗菌肽奠定了基础,提供了一种新的途径。BnCRP1可作为生物试剂喷施于植物表面提高植物对真菌病害的抗性,同时,还可以作为一个新分子标记用于辅助抗病育种,还可以作为一个新基因用于植物基因工程,以培育抗病转基因植物。
