正丁醇同步萃取油茶饼多组分研究
2020-05-24谢益仙肖志红黎继烈张爱华李培旺
谢益仙 肖志红 吴 红,,3 黎继烈 张爱华, 李培旺 田 宏
(中南林业科技大学1,长沙 410004)湖南省林业科学院油脂分子构效湖南省重点实验室2,长沙 410004)(湖南省林业科学院南方木本油料利用科学国家林草局重点实验室3,长沙 410004)(湖南粮食集团有限公司4,长沙 410005)(南开大学5,天津 300071)
油茶(CamelliaoleiferaAbel)被誉为世界四大木本油料之一[1],属茶科,常绿小乔木。油茶籽是我国重要的食用油原料,压榨茶油后得到油茶饼,茶油饼中仍富含茶油、茶皂素、磷脂、蛋白质、角鲨烯等多种天然活性成分[2-4]。茶皂素是一种糖式化合物,是一种天然非离子型表面活性剂[5],具有镇痛、抗渗透等药理作用[6,7],水提法和乙醇提取法的茶皂素碳水化合物含量高,进一步纯化利用较为困难[8]。磷脂是天然表面活性剂,具有生理调节机能,在人体的新陈代谢、免疫力的提高、疾病的预防等方面都有一定的作用[ 9,10 ],广泛用于食品、医药、饲料、化妆品、纺织品、石油化工等行业[11]。油茶饼的开发利用有利于资源的再利用,可以产生一定的经济效益。
油茶饼多组分提取方法有水提法、有机溶剂萃取法、超临界CO2萃取法、亚临界萃取法等。水提法设备条件要求不高、成本低、但目标产物提取率较低且需分步提取多组分,朱俊朋等[12]采用水提-醇萃法提取油茶饼中茶皂素时,在最佳提取条件下茶皂素提取率达到8.33%,提取率较低;有机溶剂萃取法成本低、效率高但产品的后续处理较为复杂且产品质量不高,宗毅等[13]采用超声波-甲醇法提取茶皂素,在最佳实验条件下的茶皂素纯度达到59.30%;超临界CO2萃取和亚临界萃取操作简单、目标产物提取率高但成本较高、设备投资较大且较难实现规模化生产。总之,目前针对油茶饼中残油、茶皂素、磷脂等多组分的提取技术存在耗时耗能、安全性低、产品质量不高的缺陷。根据本课题组前期研究得出醇基溶剂对油茶饼同步萃取效果优于常规有机溶剂,如以正丁醇水溶液为溶剂对茶皂素和茶油的同步提取,茶油提取率达到92.88%,茶皂素提取率达到43.20%[14],实现了茶油、皂素和磷脂等多组分的同步萃取,而且后期通过简单的旋转蒸发就可以逐步实现油脂、皂素和磷脂的分离。与传统方法对比,正丁醇水提取显示出一定的优势。因此,本实验在课题组前期研究的基础上,着力于正丁醇对油茶饼中多组分同步萃取的研究工作,重点探究正丁醇同步萃取油茶过程中更多组分溶出规律及其相互作用对茶皂素纯度的影响。
1 材料与方法
1.1 材料与仪器
茶籽饼:湖南省林业科学院;茶皂素标准品;正丁醇、无水乙醇、石油醚、香草醛、浓硫酸、硫酸肼等试剂均为分析纯。
UV-2800双光束/紫外可见分光光度计;SZF-06A粗脂肪测定仪。
2 实验方法
2.1 油茶饼原料的组分分析方法
2.1.1 油茶饼原料水分及挥发物的测定
油茶饼原料中水分及挥发物的测定方法同GB/T 10358—2008《油料饼粕水分及挥发物含量的测定》。
2.1.2 茶油的测定
油茶饼及滤渣中含油率的测定方法同GB/T 14488.1—2008《植物油料含油量测定》。

(1)
式中:M1为参与同步萃取的茶籽饼原料质量/g;P1为茶籽饼原料中的含油率/%;m1为茶籽饼滤渣的质量/g;P2为测得的茶籽饼滤渣的残油率/%。
2.1.3 茶皂素含量的测定
茶皂素标准曲线及含量的测定按文献[15]方法操作。可得标准曲线回归方程为:
y=1.082 6x+0.002 7,R2=0.999 5。

(2)

(3)
式中:c为茶皂素质量浓度/mg/mL;V为茶皂素溶液的体积/mL;n为茶皂素溶液稀释倍数;m为原料中茶皂素质量/mg;M为茶皂素提取物质量/mg。
2.1.4 磷脂含量的测定
磷脂标准曲线及含量的测定方法同GB/T 5537—2008《粮油检验磷脂含量的测定》。
可得标准曲线回归方程为:y=10.88x-0.033 2,R2=0.999。
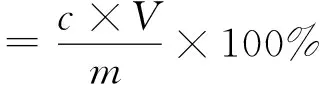
(4)
式中:c为磷脂质量浓度/mg/mL;V为溶液的体积/mL;m为原料中磷脂质量/mg。
2.1.5 蛋白质含量的测定
油茶饼原料及滤渣中蛋白质的测定方法参考GB/T 31578—2015《粮油检验粮食及制品中粗蛋白测定杜马斯燃烧法》。
2.1.6 碳水化合物含量的测定
油茶饼原料及溶出物质中碳水化合物的测定按文献[16]方法操作。
2.1.7 油茶饼多组分同步萃取工艺
称取500 g粉碎后的油茶饼粕(干基),与一定体积的正丁醇在不同的pH(3.5~5.5),温度(50~90 ℃),液料比(4∶1~12∶1) mL/g和正丁醇含水量(0%~20%)条件下回流萃取。提取完全后快速以确保体系在同等温度下离心分离。之后用少量同温度正丁醇与固体相混合后离心分离2次,合并正丁醇相。小心的收集固体相,用于油脂、皂素、磷脂、蛋白质和碳水化合物的提取率测定。旋转蒸发仪蒸发,随着含水量的减少,首先蒸发出来的是磷脂,其次是皂素,最后蒸发出来的是油脂,从而实现三组主要物质的分离。
2.1.8 响应面法优化油茶饼多组分同步萃取工艺
采用Box-Behnken中心组合实验设计方案,根据单因素实验固定正丁醇含水量20%、萃取时间120 min,选取对油茶饼中茶皂素溶出率及茶皂素纯度影响较大的萃取pH、萃取温度、萃取液料比3个因素进行响应面分析,建立茶皂素溶出率及纯度的回归方程,优化茶皂素纯度及萃取工艺参数。
3 结果与讨论
3.1 茶籽饼中主要成分
表1所示为本实验所用油茶饼中主要成分组成含量。由表1可知,油茶饼具有低蛋白质、磷脂含量,高茶皂素含量的特点,与文献[17]相比,茶皂素、磷脂含量略高,这是因为原料产地、品种等都不相同。文献中报道,双亲性的物质如茶皂素、磷脂和蛋白质等,对油脂的溶出有不同程度的促进作用,而每种物质的促进作用又各不相同。本实验将重点研究各组分溶出的规律及其相互作用关系,尤其研究各组分相互作用对茶皂素纯度的影响规律。

表1 油茶饼中主要成分组成
3.2 不同条件对油茶饼多组分溶出率及茶皂素纯度的影响
3.2.1 pH对油茶饼多组分溶出率及茶皂素纯度的影响
提取体系的pH对皂素的溶出及纯度具有非常显著的影响作用[18]。茶皂素含有双亲基团具有表面活性,其表面活性容易受到体系pH的影响,在文献报道中[19]发现茶皂素在弱酸性环境中表面活性较高。因此,考察体系pH的影响具有重要意义。
固定萃取温度80 ℃、萃取液料比8∶1 mL/g、正丁醇含水量20%、萃取时间120 min,在pH 3.5~5.5范围内,随着pH的升高,茶油、茶皂素、磷脂的溶出率及茶皂素纯度呈现出先增加后减少的趋势,蛋白质的溶出率呈现先减少后增加,碳水化合物溶出率有轻度增加。当pH增加到4.5时,茶油溶出率63.56%升高到74.01%,茶皂素溶出率从87.05%升高到90.60%,磷脂溶出率从29.96%增加到38.02%,茶皂素纯度从71.35%增加到77.50%,蛋白质溶出率从30.54%降低到27.93%。在提取体系pH变化过程中茶油、茶皂素、磷脂溶出率及茶皂素纯度变化趋势相同,与蛋白质溶出率变化趋势相反,萃取pH对茶皂素纯度影响较大,与胡福田等[20]采用微波预处理超声波协助水浸提茶皂素试验相比茶皂素纯度提高22.82%,蛋白质溶出率较低,其等电点在4.5左右[21],体系中茶皂素与茶油分子溶出能力较强,茶皂素能降低水的表面能且对茶油具有一定的增溶作用[22]。综合考虑选取pH 4.5为最佳萃取温度。
3.2.2 温度对油茶饼多组分溶出率及茶皂素纯度的影响
提取体系的温度对茶皂素的提取率及纯度都有较大的影响[23],温度过低,不利于各组分溶出,温度过高会使更多的杂质溶出降低茶皂素的纯度。
固定萃取pH 4.5、萃取液料比8∶1 mL/g、正丁醇含水量20%、萃取时间120 min,在温度50~80 ℃时,茶油、茶皂素溶出率及茶皂素纯度均呈上升趋势,低温影响茶油及皂素在正丁醇水溶液中的溶解度[24]。在80~90 ℃茶油和茶皂素溶出率及茶皂素纯度都有少许降低;随着温度增加磷脂溶出率从30.48%增加到38.91%,而蛋白质和碳水化合物溶出率呈现减少趋势,蛋白质溶出率从32.42%减少到25.47%,碳水化合物溶出率从14.70%减少到10.30%。在提取温度变化过程中,茶油、茶皂素溶出及茶皂素纯度变化趋势相同与磷脂溶出变化相似,温度升高对茶油溶出的促进作用较为明显,主要是因为温度升高使油茶饼组织变得疏松,细胞结构被出率呈现减少趋势,蛋白质溶出率从32.42%减少到25.47%,碳水化合物溶出率从14.70%减少到10.30%。在提取温度变化过程中,茶油、茶皂素溶出及茶皂素纯度变化趋势相同与磷脂溶出变化相似,温度升高对茶油溶出的促进作用较为明显,主要是因为温度升高使油茶饼组织变得疏松,细胞结构被破坏;蛋白质与碳水化合物溶出趋势相同,蛋白质和碳水化合物的溶出逐渐减少,温度较高时,蛋白质和碳水化合物结构遭到破坏,其活性成分受到影响,蛋白质和碳水化合物溶出减少,有利于茶皂素纯度的增加。综合考虑选取80 ℃为最佳萃取温度。
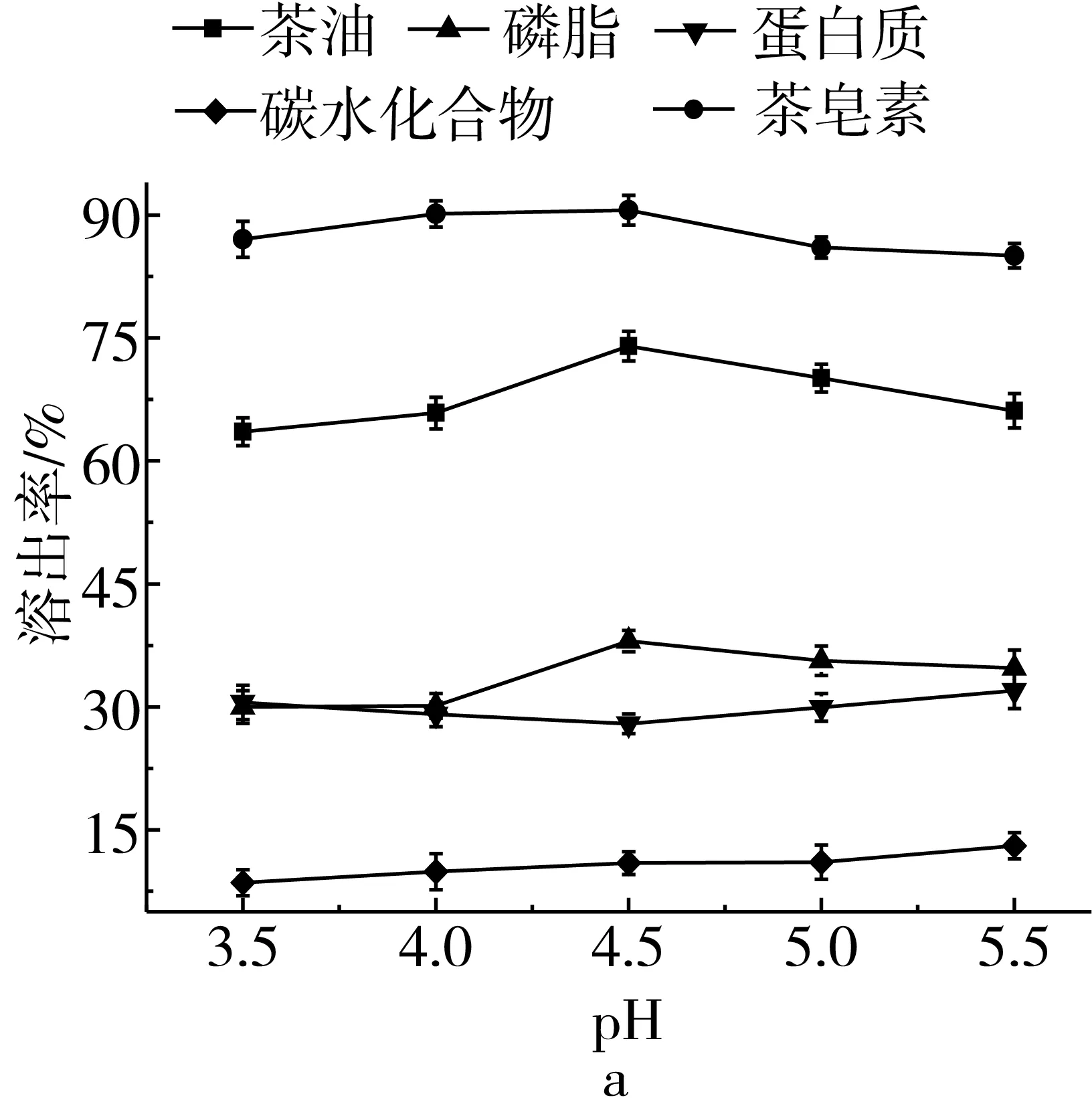

图1 pH对各组分溶出率及茶皂素纯度的影响


图2 萃取温度对各组分溶出率及茶皂素纯度的影响
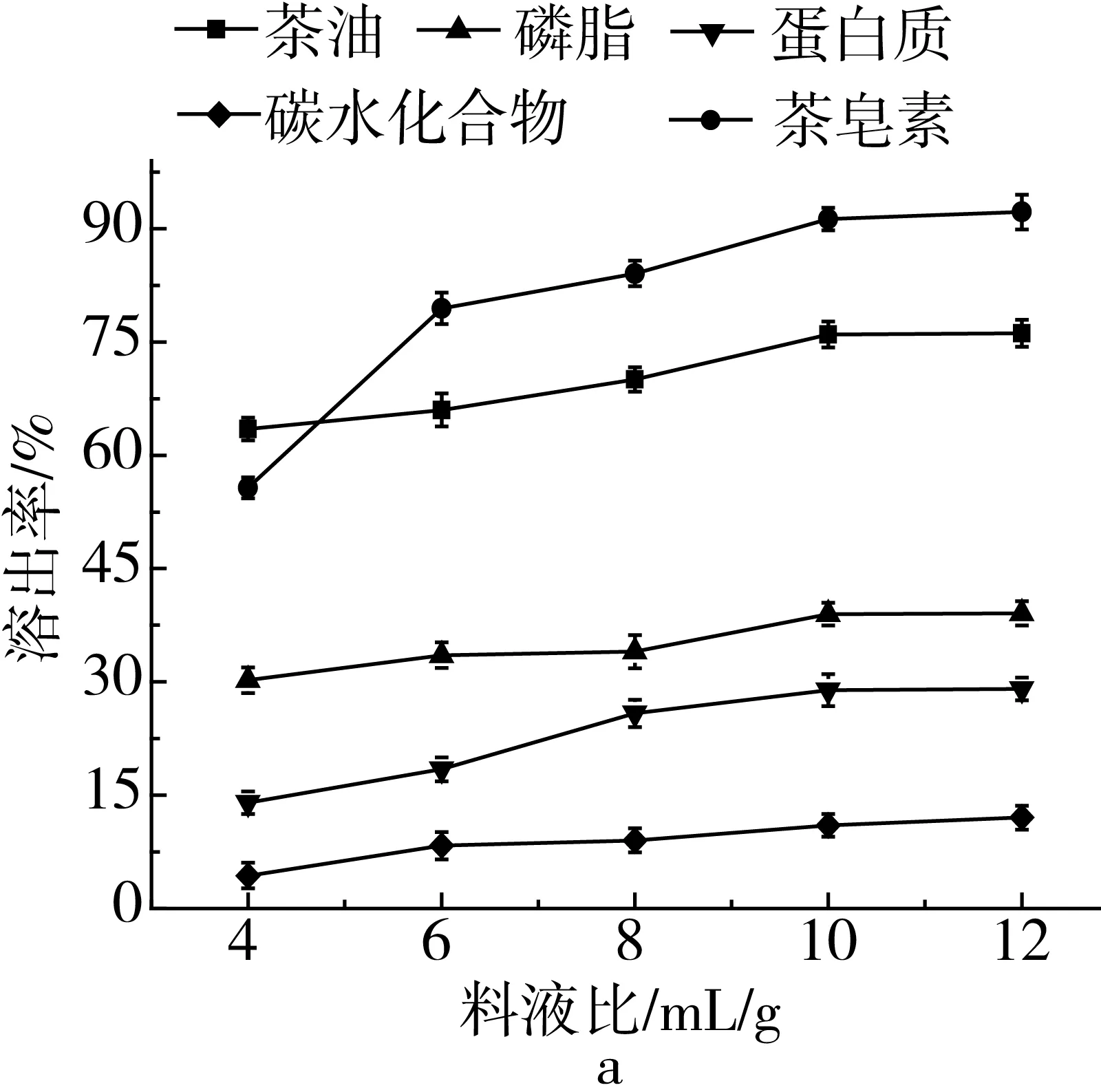

图3 萃取液料比对各组分溶出率及茶皂素纯度的影响
3.2.3 液料比对油茶饼多组分溶出率及茶皂素纯度的影响
提取液料比对各成分溶出及茶皂素纯度影响不相同,最佳液料比可避免造成资源浪费。
固定萃取pH 4.5、萃取温度80 ℃、正丁醇含水量20%、萃取时间120 min,在液料比4∶1 ~12∶1 mL/g范围内,茶油、茶皂素、磷脂、蛋白质和碳水化合物溶出率一直在增加,茶油溶出率从63.48%增加到76.15%,茶皂素溶出率从55.69%增加到92.20%,磷脂溶出率从30.22%增加到39.07%,蛋白质溶出率13.99%增加到29.07%,碳水化合物溶出率从4.35%增加到12.04%,随液料比增加油茶饼中有效成分溶出率趋势相同,茶皂素纯度呈现出先增加后减小的趋势,液料比增加有利于溶剂与物料的充分接触,但液料比较大时,杂质溶出也会越多。在液料比10∶1 mL/g时,茶皂素纯度达到最大值78.26%。在该体系中茶皂素分子溶出竞争力较大,溶出率增加较为明显。综合考虑选取10∶1 mL/g为最佳萃取料比。
3.2.4 正丁醇含水量对油茶饼多组分溶出及茶皂素纯度的影响
正丁醇、茶皂素、茶油和水互溶后可形成一个极性可调的溶剂体2系,该体系具有“双亲增溶”特性,适用于油茶多组分的同步提取。因此考察含水量对溶出率及茶皂素纯度的影响。
固定萃取pH 4.5、萃取温度80 ℃、萃取液料比10∶1 mL/g、萃取时间120 min,在正丁醇含水量0~20%(质量分数)范围内,茶皂素溶出率从19.29%增加到91.54%;茶皂素纯度从48.38%提高到78.12%;随着正丁醇含水量的增加,茶油和磷脂溶出率先轻度降低再增加;蛋白质溶出率增加;碳水化合物溶出率随含水量增加而增加。随着茶皂素的溶出,能够有效的改变正丁醇-水体系的极性大小,形成一个“双亲增溶”体系对茶油具有一定的增溶作用,从而实现茶油、茶皂素的同步高效溶出[25]。正丁醇含水量20%时,茶皂素溶出率为91.54%,纯度为78.12%,与易笑生等[26]进行的正丁醇(含水量5%)萃取茶皂素和茶油相比,茶皂素溶出率提高48%,茶皂素在水中的溶解性稍大于在正丁醇中的溶解性,由于水在正丁醇中的最大溶解度为20.1%(质量分数),综合考虑选取正丁醇含水量20%为最佳萃取含水量。

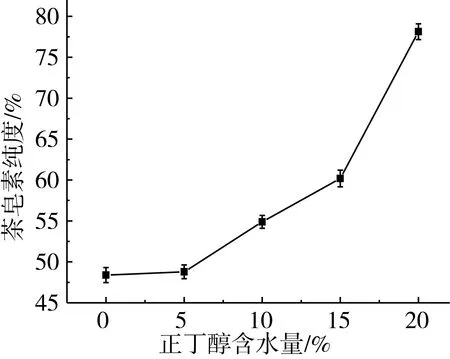
图4 正丁醇含水量对各组分溶出率及茶皂素纯度的影响
3.2.5 萃取时间对油茶饼多组分溶出及茶皂素纯度的影响
传统提取方法中大多数存在提取时间长的缺陷,就会造成效率低,设备利用率低等问题,缩短时间能有效的节约成本,创造更大的经济价值。
固定萃取pH 4.5、萃取温度80 ℃、萃取液料比10∶1 mL/g、正丁醇含水量20%,在萃取时间30~120 min范围内,随时间的增加茶皂素、茶油、磷脂、蛋白质和碳水化合物的溶出率呈现出增加的趋势。在萃取初期,萃取时间越长,各有效成分的溶出率也就越高。随着时间的延长,各有效成分溶出率有略微下降,这可能是因为有效成分在溶剂中溶解度达到饱和,萃取时间较长,茶皂素可能发生水解;在该体系中萃取时间120 min时,茶皂素溶出率达到90.1%,马力等[27]在以水为溶剂萃取油茶饼中茶皂素时达到相似溶出率需要萃取时间8 h;茶皂素纯度随萃取时间的延长而降低,萃取时间越长杂质溶出越多对茶皂素纯度影响越大。综合考虑选取萃取时间120 min为最佳萃取时间。

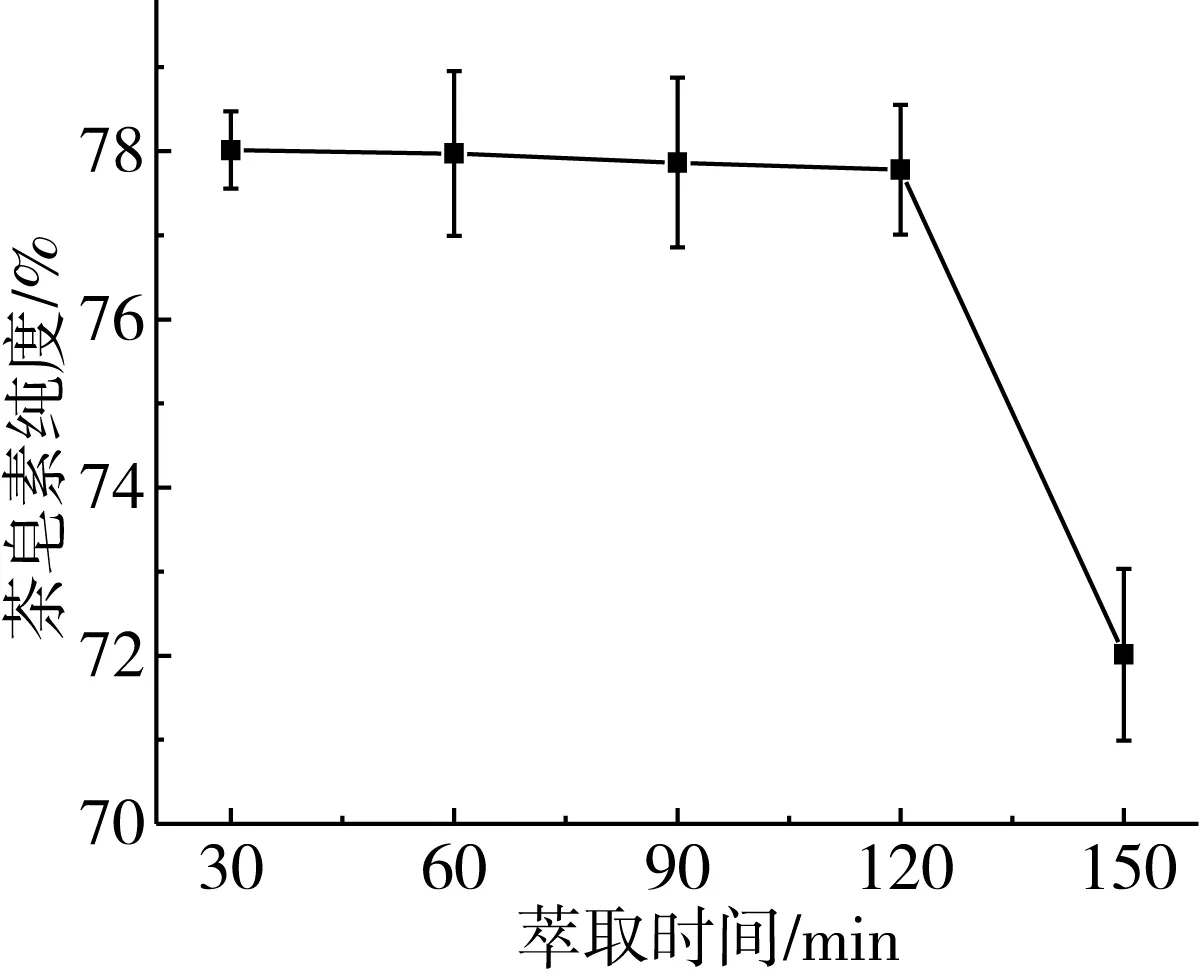
图5 萃取时间对各组分溶出率及茶皂素纯度的影响
3.3 同步萃取油茶饼多组分最佳工艺响应面试验结果与分析
3.3.1 响应面实验结果
根据单因素实验结果,萃取pH、萃取温度、萃取液料比对茶皂素溶出率及茶皂素纯度影响较大,因此响应面试验以茶皂素溶出率及茶皂素纯度为响应值采用3因素3水平的响应面分析方法,以萃取pH、萃取温度、萃取液料比为自变量对工艺参数进行优化。设计因素与水平编码表如表2及表3所示。
3.3.2 响应面优化分析
运用Design Expert 8.0.6软件对实验数据进行分析处理,得到方差结果,如表4所示。
Y1(茶皂素溶出率)=91.89-1.04A+0.80B+1.79C+0.29AB+0.19BC-2.61A2-0.31B2-1.88C2
Y2(茶皂素纯度)=78.72+0.51A+0.33B+0.31C+0.28AC-2.591A2-0.73B2-0.99C2
由表4、表5可知,A、B、C、A2、B2、C2对响应值茶皂素的溶出率及茶皂素的纯度影响极显著(P<0.000 1)。失拟差P>0.05,表明模型的失拟度不显著,回归系数R2分别为0.999 2、0.996 4,表明预测值与试验值具有良好的拟合性,校正后的复测相关系数Radj2分别为0.998 2、0.991 7,测试值与校正值均较大且较为接近,表明该模型拟程度良好。

表2 Box-Benhnken实验因素及其水平表

表3 Box-Benhnken实验结果表

表4 茶皂素溶出率的回归方差分析
注:**表示,差异极显著(P<0.01);*表示,差异显著(P<0.05)。

表5 茶皂素纯度的回归方差分析
注:**表示,差异极显著(P<0.01);*表示,差异显著(P<0.05)。
3.3.3 交互作用分析
根据模型方差分析可以得出萃取pH、萃取液料比和萃取温度对茶皂素溶出率影响极显著,两因素的交互作用对茶皂素溶出率的影响较大的是萃取pH和萃取温度、萃取温度和液料比。随着萃取pH的增加,茶皂素溶出率先增加达到最高值后下降,茶皂素溶出率的下降可能是当pH较大时引起茶皂素的水解[28];萃取pH与萃取液料比之间交互作用不显著,这可能是因为实验中考察这两个变量的范围较小,没有更好的显示出变量范围更大后的交互作用变化规律;萃取温度对茶皂素溶出率影响较小。
对茶油饼中茶皂素纯度响应值的影响及其交互作用中萃取pH对茶皂素纯度的影响程度最大,萃取温度次之,萃取液料比影响最小,两因素的交互作用对茶皂素纯度的影响较明显的是萃取pH和萃取液料比。随萃取pH的增加,茶皂素纯度呈现先增加后减小的趋势,茶皂素纯度降低的原因可能是萃取pH增加会导致更多杂质溶出。
根据二次回归方程的数学模型分析,得到的最佳萃取工艺条件:萃取pH为4.52、萃取温度83.80 ℃、萃取液料比10.60 mL/g、在此条件下茶皂素溶出率及茶皂素纯度理论值分别为92.50%、78.76%。在验证响应面法的可行性的基础上,为了便于实际的操作,将最佳工艺条件修正为萃取pH为4.50、萃取温度84 ℃、萃取液料比10.60 mL/g。
3.3.4 回归模型的验证
按照优化后的工艺条件进行3次平行实验以验证BBD设计所得结果的可靠性,试验所得茶皂素溶出率为(92.38±0.57)%,茶皂素纯度为(78.47±0.37)%,与理论预测值相比无明显差异,基本符合理论,表明所建的模型有效。
3.3.5 本方法与醇提和水提对比
本方法与醇提法、水提法萃取效果对比见表6,本方法具有提取率高、产品纯度较高的优势。

表6 不同复合溶剂萃取效果比较
4 结论
正丁醇/水复合溶剂处理油茶饼粕,研究各组分溶出的规律及其相互作用关系,重点研究各组分的相互作用对茶皂素纯度的影响规律。通过单因素实验分析确定油茶饼多组分同步萃取的工艺条件为萃取pH 4.5、萃取温度80 ℃、萃取液料比10∶1 mL/g、正丁醇含水量20%、萃取时间120 min。在单因素实验结果基础上,通过响应面试验设计考察萃取pH、萃取温度、萃取液料比3个因素及其相互作用对茶皂素溶出率及纯度的影响,得出最佳提取工艺:萃取pH为4.50、萃取温度84 ℃、萃取液料比10.60 mL/g,在该条件下,茶皂素溶出率为(92.38±0.57)%,茶皂素纯度为(78.47±0.37)%。与传统提取方法相比,正丁醇/水复合溶剂萃取茶皂素的提取率显著提高,碳水化合物等难分离物质显著减少,有利于茶皂素的进一步纯化利用。
